Превращение холестерина в жирные кислоты
Содержание статьи
ХОЛЕСТЕРИНОВЫЙ ОБМЕН — Большая Медицинская Энциклопедия
ХОЛЕСТЕРИНОВЫЙ ОБМЕН (греческий chole желчь + stereos твердый) — совокупность реакций биосинтеза холестерина (см.) и его распада в организме человека и животных. В организме человека за сутки около 500 мг холестерина окисляется в желчные кислоты, примерно такое же количество стеринов экскретируется с фекалиями, около 100 мг выделяется с кожным салом, небольшое количество холестерина (около 40 мг) используется для образования кортикоидных и половых гормонов, а также витамина D3, 1—2 мг холестерина выводится с мочой. У кормящих женщин с грудным молоком выделяется 100— 200 мг холестерина в сутки. Эти потери восполняются за счет синтеза холестерина в организме (у взрослого человека в сутки около 700—1000 мг) и поступления его с пищей (300— 500 мг). Холестерин, а также часть холестерина, поступившего в просвет кишечника с желчью, всасывается в тонкой кишке в форме жировых мицелл (см. Жировой обмен). Эфиры холестерина предварительно гидролизуются при действии холестеринэстеразы (см.) панкреатического и кишечного соков. В стенке тонкой кишки холестерин используется для образования хиломикронов (см. Липопротеиды), в составе которых он поступает сначала в лимфатическую систему, а затем в кровяное русло.
В капиллярах жировой и некоторых других тканей в результате воздействия на хиломикроны липопротеид-липазы образуются частицы, обогащенные эфирами холестерина и фосфолипидами, получившие название ремнантных (остаточных) частиц. Эти частицы задерживаются в печени, где подвергаются распаду. Освободившийся при этом холестерин наряду с холестерином, синтезированным в печени, образует так называемый общий пул печеночного холестерина, который используется по мере необходимости для образования липопротеидов (см.).
Установлено, что у человека и некоторых животных липопротеиды низкой плотности транспортируют холестерин в органы и ткани, причем захват липоиротеидных частиц клетками этих органов и тканей осуществляется при участии специфических рецепторов. Холестерин, доставленный в клетку в составе липопротеидных частиц, идет на покрытие потребностей клетки (образование мембран при делении клетки, синтез стероидных гормонов и др.). Избыточная часть неэтерифицированного (свободного) холестерина превращается в его эфиры при действии содержащегося в клетке фермента — холестеролацилтрансферазы (КФ 2.3.1.26). Обратный транспорт неэтерифицированного холестерина из различных органов и тканей в печень осуществляется липопротеидами высокой плотности, причем в кровяном русле происходит этерификация захваченного холестерина при участии лецитина и фермента холестерин-лецитин — ацилтрансферазы (КФ 2.3.1.43). Доставленный таким путем в печень холестерин идет на образование желчных кислот (см.).
Синтез холестерина

Общая схема биосинтеза холестерина
Синтез холестерина осуществляется в клетках почти всех органов и тканей, однако в значительных количествах он образуется в печени (80%), стенке тонкой кишки (10%) и коже (5%). К. Блох, Ф. Линен и др. показали основные реакции биосинтеза холестерина (их не менее 30). Сложный процесс биосинтеза холестерина можно разделить на три стадии: 1) биосинтез мевалоновой кислоты; 2) образование сквалена из мевалоновой кислоты; 3) циклизация сквалена и образование холестерина (см. схему).
Считают, что главным источником образования мевалоновой кислоты в печени является ацетил-КоА, а в мышечной ткани — лейцин. И то и другое соединения в результате ряда энзиматических реакций образуют бета-гидрокси-бета-метилглутарил-КоА (ГМГ-КоА), который затем восстанавливается в мевалоновую кислоту. В последнее время показано, что в синтез мевалоновой кислоты в печени может включаться и малонил-КоА.
Реакцией, определяющей скорость биосинтеза холестерина в целом, является восстановление ГМГ-КоА в мевалоновую кислоту; этот процесс катализирует фермент НАДФ-Н2-зависимая ГМГ-КоА-редуктаза (КФ 1.1.1.34). Именно этот фермент подвержен воздействиям со стороны ряда факторов. Так, активность ГМГ-КоА-редуктазы повышается (или содержание ее в печени возрастает) и скорость синтеза холестерина в целом увеличивается при действии ионизирующего излучения, введении тиреоидных гормонов, поверхностно-активных веществ, холестирамина, а также при гипофизэктомии. Угнетение синтеза холестерина отмечается при голодании, тиреоидэктомии и при поступлении в организм пищевого холестерина. Последний угнетает активность (или синтез) фермента ГМГ-КоА-редуктазы.
Синтез холестерина в стенке тонкой кишки регулируется исключительно концентрацией желчных кислот. Так, отсутствие их в кишечнике при наличии наружного желчного свища ведет к повышению синтеза холестерина в тонкой кишке в 5—10 раз.
На второй стадии синтеза происходит фосфорилирование мевалоновой кислоты при участии АТФ и образование нескольких фосфорилированные промежуточных продуктов (см. Фосфорилирование). При декарбоксилировании одного из них образуется изопентенил-пирофосфат, часть которого превращается в диметилаллил-пирофосфат. Взаимодействие этих двух соединений приводит к образованию димера — геранил-пирофосфата, содержащего 10 атомов углерода. Геранил-пирофосфат конденсируется с новой молекулой изопентенил-пирофосфата и образует тример — фарнезил-пирофосфат, содержащий 15 атомов углерода. Эта реакция идет с отщеплением молекулы пирофосфата. Затем две молекулы фарнезил-пирофосфата конденсируются, теряя каждая свой пирофосфат, и образуют гексамер сквален, содержащий 30 атомов углерода.
Третья стадия синтеза включает окислительную циклизацию сквалена, сопровождающуюся миграцией двойных связей и образованием первого циклического соединения — ланостерина. Ланостерин уже имеет гидроксильную группу в положении 3 и три лишние (по сравнению с холестерином) метильные группы. Дальнейшее превращение ланосте-рина может совершаться двумя путями, причем и в том и в другом случае промежуточными продуктами являются соединения стериновой природы. Более доказанным считается путь через 24, 25-дигидроланостерин и ряд других стеринов, включая 7-дигидрохолестерин, служащий непосредственным предшественником холестерина. Другой возможный путь — превращение ланостерина в зимостерин, а затем в десмостерин, из которого при восстановлении образуется холестерин.
Если суммировать общий итог всех реакций биосинтеза холестерина, то он может быть представлен в следующем виде:
18CH3CO-S-KoA + 10(H+) + 1/2O2 —> C27H46O + 9CO2 + 18KoA-SH. Источником углерода холестерина является ацетил-КоА (им может быть также малонил-КоА и лейцин), источником водорода — вода и никотин-амида дениндинуклеотидфосфат, а источником кислорода — молекулярный кислород.
Начиная со сквалена и кончая холестерином все промежуточные продукты биосинтеза нерастворимы в водной среде, поэтому они участвуют в конечных реакциях биосинтеза холестерина в связанном со сквален или стеринпереносящими белками состоянии. Это позволяет им растворяться в цитоплазме клетки и создает условия для протекания соответствующих реакций. Холестерин-переносящий белок обеспечивает также перемещение стеринов внутри клетки, что имеет важное значение для вхождения его в мембрану клетки, а также для транспорта в клеточные системы, осуществляющие катаболизм холестерина.
Катаболизм холестерина протекает в печени (окисление его в желчные кислоты), в надпочечниках и плаценте (образование из холестерина стероидных гормонов), в тестикулярной ткани и яичниках (образование половых гормонов). При биосинтезе холестерина в коже на завершающей стадии образуется небольшое количество 7-дегидрохолестерина. Под влиянием УФ-лучей он превращается в витамин D3.
Своеобразные превращения претерпевает холестерин в толстой кишке. Речь идет о той части пищевого холестерина или холестерина, поступившего в кишечник с желчью, которая не подверглась всасыванию. Под влиянием микробной флоры толстой кишки происходит восстановление холестерина и образование так наз. нейтральных стеринов. Главным их представителем является копростерин. Экспериментальные исследования, проведенные с использованием радиоизотопных и других методов, показали, что скорость обновления холестерина в различных органах и тканях неодинакова; наиболее высока она в надпочечниках и печени и чрезвычайно низка в мозге взрослых животных.
Патология холестеринового обмена
Нарушения холестеринового обмена обычно связаны с дисбалансом между количеством синтезируемого в организме и поступающего с пищей холестерина, с одной стороны, и количеством холестерина, подвергающегося катаболизму,— с другой. Эти нарушения проявляются в изменении уровня холестерина в плазме крови, которые классифицируются как гиперхолестеринемия или гипохолестеринемия (для взрослого населения высокоразвитых стран величины выше 270 мг/100 мл и ниже 150 мг/100 мл соответственно).
Гиперхолестеринемия может быть первичной (наследственной или алиментарной) и вторичной, обусловленной различными заболеваниями. Наследственная (семейная) гиперхолестеринемия характеризуется высоким уровнем холестерина и липопротеидов низкой плотности (ЛПНГЛ в плазме крови. При гомозиготной гиперхолестеринемии уровень холестеринемии может достигать 700— 800 мг/100 мл, а при гетерозиготной — 300—500 мг/100 мл. В основе наследственной гиперхолестеринемии лежит генетически обусловленное отсутствие (у гомозигот) или недостаток (у гетерозигот) специфических рецепторов к липопротеидам низкой плотности у клеток, вследствие чего резко снижается захват и последующий катаболизм этих богатых холестерином липопротеидов клетками паренхиматозных органов и тканей. В результате пониженного захвата и снижения катаболизма липопротеидов низкой плотности развивается гиперхолестеринемия (см.). Последняя приводит к раннему развитию атеросклероза (см.) и его клинических проявлений — ишемической болезни сердца (см.), преходящей ишемии мозга (см. Инсульт) и др. Особенно тяжело протекает атеросклероз при гомозиготной форме; у таких больных часто наблюдается ксантоматоз (см.), липоидная дуга роговицы (отложение холестерина в роговицу глаз), инфаркт миокарда в юношеском возрасте.
Распространенность гомозиготной формы гиперхолестеринемии невелика (примерно один случай на 1 млн. жителей). Чаще встречается гетерозиготная форма — один случай на 500 жителей.
Алиментарная гиперхолестеринемия характеризуется повышенным уровнем холестерина в плазме крови вследствие длительного потребления больших количеств пищи, богатой холестерином (куриные желтки, икра, печень, животные жиры и др.). Алиментарная гиперхолестеринемия той или иной степени выраженности характерна для жителей высокоразвитых индустриальных стран. Согласно популяционным исследованиям имеется прямая зависимость между уровнем холестерина в крови и распространенностью ишемической болезни сердца.
В эксперименте на различных животных (кролики, морские свинки, обезьяны) показано, что введение массивных доз холестерина с пищей приводит к резко выраженной гиперхолестеринемии и быстрому развитию атеросклероза. Экспериментальные модели гиперхолестеринемии и атеросклероза, впервые предложенные H. Н. Аничковым и С. С. Халатовым (1913), широко используются в научных исследованиях.
Вторичная гиперхолестеринемия встречается при гипотиреозе (см.), сахарном диабете (см. Диабет сахарный), нефротическом синдроме (см.), подагре (см.) и др. и нередко сопровождается развитием атеросклероза (см. Гиперхолестеринемия).
Выделяют первичную и вторичную гипохолестеринемию. Первичная гипохолестеринемия характерна для наследственного заболевания — абеталипопротеинемии (см.). При этой болезни отмечается почти полное отсутствие в плазме крови липопротеидов низкой плотности (у гомозигот) или значительное их снижение (у гетерозигот). Уровень общего холестерина не превышает 75 мг/ 100 мл. Гомозиготная форма болезни протекает исключительно тяжело. В основе абеталипопротеинемии лежит генетически обусловленное нарушение синтеза апопротеина В — главного белка липопротеидов низкой плотности.
Вторичные гипохолестеринемии наблюдаются при кахексии, гипертиреоидизме, аддисоновой болезни и паренхиматозных заболеваниях печени, при ряде инфекционных болезней и интоксикациях (см. Гипохолестеринемия). При недостаточной активности в плазме крови фермента лецитин — холестерин -ацилтрансферазы, или ЛХАТ (наследственная ЛXАТ-недостаточность), ответственного за этерификацию холестерина плазмы, наблюдается накопление неэтерифицированного холестерина в мембранах эритроцитов и клетках почек, печени, селезенки, костного мозга, роговицы глаза. Резко снижается доля этерифицированного холестерина в плазме крови и одновременно повышается уровень неэтерифицированного холестерина и лецитина. У больных с наследственной ЛXAT-недостаточностыо стенки артерий и капилляров подвержены деструктивным изменениям, что связано с отложением в них липидов. Наиболее тяжелые изменения происходят в сосудах почечных клубочков, что приводит к развитию почечной недостаточности (см.).
Одним из распространенных нарушений холестериновый обмен. является образование желчных камней, основной составной частью которых является холестерин (см. Желчнокаменная болезнь). Образование желчных камней происходит вследствие выкристаллизовывания холестерина при относительно высокой его концентрации в желчи и относительно низкой концентрации в ней желчных кислот и фосфолипидов, обладающих способностью растворять холестерин. Исследования показали, что имеется прямая связь между уровнем холестерина в плазме крови и распространенностью холестероза (см.) и желчнокаменной болезни.
Библиогр.: Климов А. Н, и Н икульчева Н. Г. Липопротеиды, дислипопротеидемии и атеросклероз, Л., 1984; Полякова Э. Д. Пути биосинтеза холестерина в печени и их регуляция, в кн.: Липиды, структура,биосинтез, превращения и функции, под ред. С. Е. Северина, с. 131, М., 1977;она же, Регуляция содержания холестерина в клетке, в кн.: Биохимия липидов и их роль в обмене веществ, под ред.С. Е. Северина, с. 120, М., 1981; Финагин Л. К. Обмен холестерина и его регуляция, Киев, 1980; Lipids and lipidoses, ed. by G. Schettler, B.— Heidelberg, 1967; Sodhi H. S., Kudchod-k a r B. J. a. Mason D. T. Clinical methods in study of cholesterol metabolism, Basel a. o., 1979.
A. H. Климов
Источник
37. Превращение холестерина в желчные кислоты, выведение из организма х и жк.
Жёлчные
кислоты синтезируются в печени из
холестерола. Часть жёлчных кислот в
печени подвергается реакции конъюгации
— соединения с гидрофильными молекулами
(глицином и таурином). Жёлчные кислоты
обеспечивают эмульгирование жиров,
всасывание продуктов их переваривания
и некоторых гидрофобных веществ,
поступающих с пищей, например
жирорастворимых витаминов и холестерола.
Жёлчные кислоты также всасываются,
через юротную вену попадают опять в
печень и многократно используются для
эмульгирования жиров. Этот путь называют
энтерогепатической циркуляцией жёлчных
кислот.
Синтез
жёлчных кислот
В
организме за сутки синтезируется 200-
600 мг жёлчных кислот. Первая реакция
синтеза — образование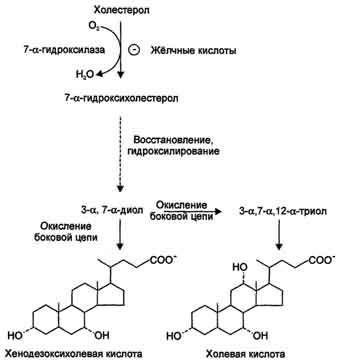
7-α-гидроксихолестерола
— является регуляторной. Фермент
7-α-гидроксилаза, катализирующий эту
реакцию, ингибируется конечным продуктом
— жёлчными кислотами. 7-α-Гидроксилаза
представляет собой одну из форм цитохрома
Р450 и
использует кислород как один из
субстратов. Один атом кислорода из
О2 включается
в гидроксильную группу в положении 7, а
другой восстанавливается до воды.
Последующие реакции синтеза приводят
к формированию 2 видов жёлчных кислот:
холевой и хенодезоксихолевой (рис.
8-71), которые называют «первичными
жёлчными кислотами».
(думаю
тут достаточно написать, без таблиц,
т.к. много получается)
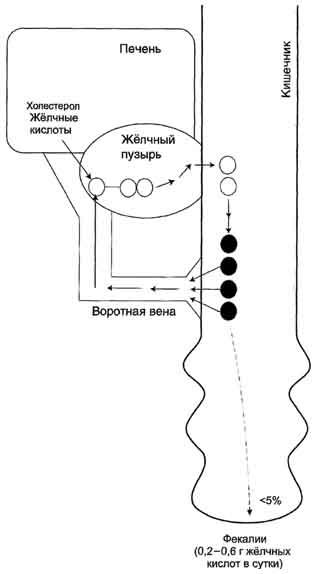
Путь
выведения жёлчных кислот одновременно
служит и основным путём выведения
холестерола из организма. Для восполнения
потери жёлчных кислот с фекалиями в
печени постоянно происходит синтез
жёлчных кислот из холестерола в
количестве, эквивалентном выведенным
жёлчным кислотам. В результате пул
жёлчных кислот (2-4 г) остаётся постоянным.
38. Конъюгация желчных кислот, первичные и вторичные жк
Конъюгирование
— присоединение ионизированных молекул
глицина или таурина к карбоксильной
группе жёлчных кислот; усиливает их
детергентные свойства, так как увеличивает
амфифильность молекул
Конъюгация
происходит в клетках печени и начинается
с образования активной формы жёлчных
кислот — производных КоА
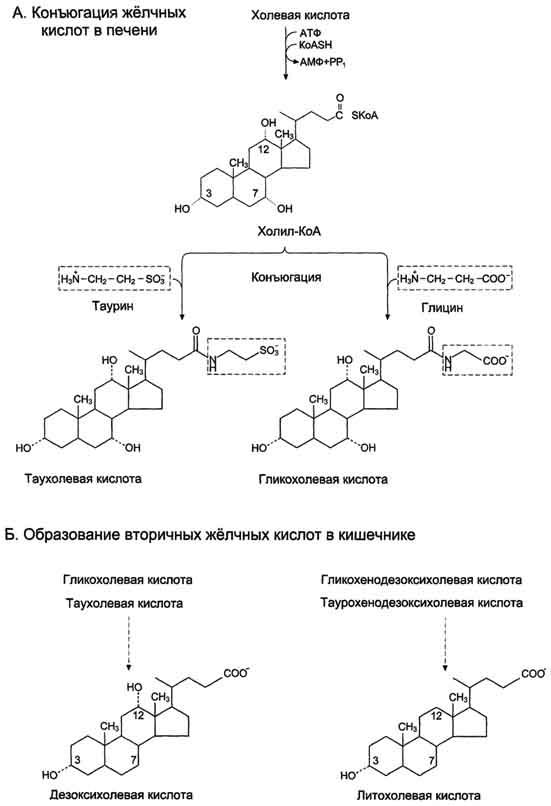
Затем
присоединяется таурин или глицин, и в
результате образуется 4 варианта
конъюгатов: таурохолевая и
таурохенодезоксихолевая, гликохолевая
или гликохенодезоксихолевая кислоты
(они значительно более сильные эмульгаторы,
чем исходные жёлчные кислоты). А потом
они превращаются во вторичные жк,
таурохолевая в дезоксихолевую, а
таурохендодезоксихолевая в литохолевую.
Ну а про первичные смотри выше.
39. Гиперхолестеринэмия и ее причины.
Гиперхолестеролемия.
Роль алиментарных факторов в развитии
гиперхолестеролемии
Концентрация
холестерола в крови взрослых людей
составляет 200±50 мг/дл (5,2±1,2 ммоль/л) и,
как правило, увеличивается с возрастом.
Превышение нормальной концентрации
холестерола в крови называют
гиперхолестеролемией.
Гиперхолестеролемия
часто развивается вследствие избыточного
поступления холестерола с пищей, а также
углеводов и жиров. Гиперкалорийное
питание — один из распространённых
факторов развития гиперхолестеролемии,
так как для синтеза холестерола необходимы
только ацетил-КоА, АТФ и NADPH. Все эти
субстраты образуются при окислении
глюкозы и жирных кислот, поэтому
избыточное поступление этих компонентов
пищи способствует развитию
гиперхолестеролемии. В норме поступление
холестерола с пищей снижает синтез
собственного холестерола в печени,
однако с возрастом эффективность
регуляции у многих людей снижается.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Жир — состав, свойства и роль в диете | Университетская клиника
Жиры или липиды плохо растворимы в воде, но растворимы в органических растворителях. Термин «жир» чаще всего используется для обозначения пищи и липидного обмена. Около 90% жиров в пище — триглицериды. Другие типы жиров включают холестерин, фосфолипиды, стерины и каротиноиды.
Жиры содержат три типа жирных кислот: насыщенные, мононенасыщенные и полиненасыщенные. Именно их соотношение определяет диетическую ценность.
Что такое липиды
Липиды — это различные классы соединений, таких как стероиды, жиры, сфинголипиды и т.п. Липиды включены в биологические мембраны и, следовательно, от них зависит проводимость мембраны, передача нервных импульсов и образование межклеточных связей.
Они образуют основные запасы энергии клеток. Также липиды — источник эндогенной воды. Они делятся на гидролизуемые и негидролизуемые. К последним относятся терпены и стероиды.
Классификация гидролизуемых липидов намного сложнее. Они делятся на:
- обычные, включающие триглицериды (сложные эфиры глицерина и жирных кислот);
- воски — сложные эфиры длинноцепочечных жирных кислот и длинноцепочечных одноатомных спиртов.
Классификация липидов
К сложным липидам относятся соединения, которые помимо жирных кислот и спирта содержат молекулы других веществ.
Функции жира в организме
Липиды являются концентрированными источниками энергии. В сутки при нормальном питании потребляется около 100 г липидов. Основные пищевые липиды — триглицериды. С пищей организму необходимо получать липиды животного и растительного происхождения — полиненасыщенные жирные кислоты.
Жир это:
- источник энергии – 1 грамм жира выделяет 9 ккал;
- источник незаменимых жирных кислот;
- переносчик жирорастворимых витаминов A, D, E и K;
- улучшитель вкуса и внешнего вида пищи.
Некоторые типы жиров важны для производства стероидных гормонов, интерлейкинов, тромбоксанов и простагландинов.
Холестерин необходим для производства желчных кислот, которые переваривают жиры.
Триглицериды
Триглецириды — это нейтральные жиры — сложные эфиры глицерина и жирных кислот. Это резервные жиры, которые являются основным источником эндогенной энергии. В жировой ткани триглицериды составляют 60-85% ее массы.
Триглицерид — это сложный эфир, состоящий из глицерина, связанного с тремя жирными кислотами, которые могут быть насыщенными или ненасыщенными. В организме человека преобладают насыщенные пальмитиновая и олеиновая (омега-9) кислоты.
Триглицериды
Триглицериды попадают с пищей или синтезируются в самом организме (печень, жировая ткань, слизистая тонкого кишечника, мышцы). Триглицериды, поступающие с пищей, гидролизуются в желудочно-кишечном тракте ферментом липазой. Скорость синтеза зависит от количества жирных кислот, полученных с пищей.
Триглицериды попадают в кровь в виде хиломикронов (липопротеин, несущий триглицериды). Произведенные жирные кислоты потребляются в тканях или повторно синтезируются из них, а триглицериды сохраняются.
Фосфолипиды
Состоят из двух групп соединений. Это глицерофосфолипиды (спирт-глицерин) и сфингомиелины (спиртовой сфингозин). Фосфолипиды имеют повышенную гидрофильную часть по сравнению с триглицеридами, состоящую из фосфатной группы и определенного аминоспирта, такого как холин. Из-за этой повышенной гидрофильной части фосфолипиды характеризуются полярностью и поэтому также называются полярными липидами.
Фосфолипиды являются основными липидами мембран. Их очень много в нервных клетках. Фосфолипиды образуют миелиновую оболочку нервных волокон и активно участвуют в энергетическом обмене.
Фосфолипиды
Жирные кислоты
- Насыщенные жирные кислоты. Они имеют высокую температуру плавления и поэтому сохраняют твердую консистенцию при комнатной температуре. Насыщенные жирные кислоты получают из животных источников. В растительных маслах (жирах) преобладают ненасыщенные жирные кислоты, за исключением кокосового и пальмового масел. Некоторые промышленные маргарины и спреды содержат много насыщенных жирных кислот.
- Мононенасыщенные жирные кислоты. Эти жирные кислоты находятся в жидкой форме при комнатной температуре. Оливковое и рапсовое масла — лучший источник мононенасыщенных жирных кислот.
- Полиненасыщенные жирные кислоты (PNRR). PNRR находятся в жидкой форме при комнатной температуре. Они легко окисляются в пище и в организме. PNRR участвуют в процессе метаболизма холестерина и входят в состав фосфолипидов клеточных мембран. Кроме того, они являются предшественниками таких активных биологических веществ, как простагландины, интерлейкины, тромбоксаны, играющих решающую роль в формировании иммунного ответа, регулировании свертывания крови и уменьшении воспаления.
Полиненасыщенные RR делятся на:
- Омега-3 (альфа-линоленовые) – содержатся в льняном, тыквенном, грецком, рапсовом и соевом маслах и зеленых листовых овощах;
- Эйкозапантан, докозагексаен — содержатся в масле морских рыб, масле морских водорослей.
Линоленовые жиры, арахидон — их производные. Они присутствуют в молочном жире, особенно летом, потому что в организме животных они состоят из линолевой кислоты, полученной с кормом.
Более длинные цепи RR: арахидон (AA), докозагексаеновая кислота (DHR), эйкозапентаеновая кислота (EPR) не считаются незаменимыми, но при отсутствии RR омега-3 и омега-6 в пище их выработка в организме может достигать критических уровней. Прямое поступление АК, ЭПК и ДГК с пищей позволяет избежать метаболизма линолевой и альфа линоленовой кислоты.
DHR и EPR очень важны для неврологического развития плода и ребенка. Дефицит DHR связан с болезнью Альцгеймера, синдромом дефицита внимания, фенилкетонурией, муковисцидозом и другими заболеваниями. Растительный α-линоленовый RR омега-3 может быть преобразован ферментами в физиологически важные EPR и DHR или соединения класса гормоноподобных эйкозаноидов.
Жирные кислоты омега-3 активно участвуют в клеточном метаболизме, в регуляции холестерина в организме человека: они снижают количество холестерина липопротеидов низкой плотности (так называемый плохой холестерин) в организме, а также вероятность сердечных заболеваний. Они также очень важны для функционирования клеток мозга, нейронных синапсов, сетчатки глаза, а также для выработки половых гормонов.
Метаболизм жирных кислот
Оптимальное соотношение жирных кислот омега-6 к омега-3 составляет 5:1. В современном рационе это соотношение превышает 15 раз и более. Неправильное соотношение Омега-3 и Омега-6 опасно для здоровья.
Трансизомерные кислоты
Трансизомерные кислоты в небольших количествах содержатся в натуральных жирах, в желудках коров и овец, баранине, говядине, молоке и сыре. Важнейшим источником транс-изомерных кислот являются гидрогенизированные спреды PNRR, маргарины.
Маргарин – источник транс-изомерных кислот
В процессе нагревания растительного масла ненасыщенные кислоты становятся насыщенными, а жидкие жиры становятся твердыми. Гидратированные диетические жиры имеют ряд преимуществ. Они дешевле, портятся медленнее, чем животные жиры, более устойчивы к окислению и высоким температурам.
Транс-изомерные кислоты, образующиеся во время гидрогенизации, связаны с увеличением холестерина ЛПНП и снижением холестерина ЛПВП, что увеличивает риск сердечно-сосудистых заболеваний, ожирения, диабета, а высокие уровни которых могут быть канцерогенными.
Стерины
Производные стероидов — это стероидные спирты, состоящие из четырех конденсированных колец атомов углерода, которые отличаются друг от друга функциональными группами (например, тестостерон, холестерин). Содержится в растениях, мясе и вырабатывается в организме.
В организме человека могут содержаться свободные стерины или сложные эфиры (стериды), образованные с жирными кислотами. Существует множество стеринов и стероидов, включая желчные кислоты, половые гормоны и гормоны коры надпочечников, витамины группы D, сердечные гликозиды, растительные фитостерины и некоторые алкалоиды.
В растениях есть стерины (эргостерин, стигмастерин и т. д.), но эти стерины не очень хорошо усваиваются организмом и, как считается, блокируют всасывание холестерина.
Самый распространенный стерол — это воскоподобный холестерин, который содержится только в продуктах животного происхождения. Фитостерины содержатся в растительной пище.
Холестерин является предшественником желчных кислот, стероидных гормонов и витамина D и представляет собой пергидрофенантреновое производное циклопентана. Это циклический ненасыщенный одноатомный спирт, имеющий полярную гидроксигруппу. Из холестерина в организме синтезируются другие стероиды: гормоны надпочечников, кортикостероиды, половые гормоны, желчные кислоты. Он синтезируется во многих клетках организма, но наиболее интенсивно в эндоплазматическом ретикулуме и цитоплазме эпителиальных клеток печени и кишечника. Холестерин синтезируется из ацетил-КоА. Выводится из организма с желчью или в виде солей желчных кислот.
Пищевой холестерин слабо влияет на уровень холестерина в плазме крови, поскольку большая его часть имеет эндогенное происхождение. Однако уменьшение количества насыщенных жиров в пище также резко снижает уровень холестерина в крови.
Животные и растительные жиры в диете
Животные жиры содержат много насыщенных жирных кислот. Они повышают уровень холестерина в крови и, следовательно, способствуют развитию атеросклероза, сердечно-сосудистых заболеваний и рака. Чрезмерное потребление насыщенных жирных кислот может привести к раку легких, кишечника, прямой кишки, груди и простаты.
Единственное исключение составляет один вид животного жира — жир морской рыбы, такой как скумбрия, сельдь, лосось, треска. Рекомендуется есть их как можно чаще из-за наличия полиненасыщенных жирных кислот омега-3.
Жиры в морской рыбе
Пищевая ценность масла определяется соотношением содержащихся в нем жирных кислот и количества жирорастворимых витаминов. В растительных маслах ненасыщенные жирные кислоты, то есть олеиновая, линолевая и α-линоленовая кислоты, составляют значительную часть всех жирных кислот. Особенно важны группы PNRR омега-6 и омега-3.
- Считается, что дефицит производных омега-6 RR может быть одним из факторов риска, связанных с развитием рака.
- Омега-3 PNRR снижает агрегацию тромбоцитов, а также риск образования тромбов, влияет на электрическую активность сердечной мышцы, тормозит возникновение аритмий. Они снижают уровень триглицеридов в крови, а также частоту ишемической болезни сердца.
Соотношение RR омега-6 и омега-3 в пищевых продуктах, рекомендованных Всемирной организацией здравоохранения (ВОЗ), должно составлять от 1:1 до 5:1. В последние десятилетия стала очевидной искаженная тенденция в этой рекомендации: растет потребление масел с высоким содержанием омега-6 и слишком низким содержанием омега-3 RR. Например, подсолнечное масло.
Соотношение этих кислот в различных продуктах питания колеблется от 10:1 до 20:1. Превышение омега-6 снижает уровень холестерина ЛПВП и увеличивает холестерин ЛПНП. Арахидон, производимый из кислот омега-6 и его метаболиты вызывают сужение сосудов и агрегацию тромбоцитов.
Более насыщенных транс-изомерных кислот, образующихся при гидрогенизации растительных масел, то есть при их затвердевании, увеличивают риск дислипидемии, CD типа II, а также попадания канцерогенов в клетки.
Качество растительного масла определяется его химическим составом, способом экстракции, технологией рафинирования и сохраняемыми при нем естественными физиологически активными веществами. Рекомендуется употреблять не менее 2-3 столовых ложек ненагретого масла в день с различными блюдами или салатами.
Поделиться ссылкой:
Источник