При каком гемоглобине делают кесарево
Содержание статьи
Современные принципы лечения родильниц с железодефицитной анемией
Комментарии
Н.А. Якунина, к.м.н. Н.В. Дубровина, А.А. Балушкина
Научный центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова Министерства здравоохранения и социального развития РФ, Москва
Железодефицитная анемия (ЖДА) — гипохромная микроцитарная анемия, развивающаяся вследствие абсолютного уменьшения запасов железа в организме. Железодефицитная анемия возникает, как правило, при хронической потере крови или недостаточном поступлении железа в организм, достаточно часто в послеродовом периоде.
По определению ВОЗ, анемией у родильниц следует считать состояние, при котором уровень гемоглобина составляет менее 100 г/л [2]. По данным различных авторов, анемия в послеродовом периоде встречается у 20-40% женщин [3,15]. Чаще всего анемия у родильниц развивается вследствие кровопотери в родах в объеме свыше 1000 мл, которая бывает у 5% всех родивших [5,10]. Наиболее часто повышенная кровопотеря возникает при абдоминальном родоразрешении.
Постгеморрагическая, ЖДА приводит к более тяжелому течению послеродового периода и способствует развитию различных осложнений, в том числе инфекционных. Кроме того, имеются данные, что у родильниц с анемий наблюдается снижение лактации и психоэмоциональный стресс. Изменения, происходящие в организме, при данной патологии приводят к развитию тканевой гипоксии, что служит сигналом для выработки в почках гликопротеинового гормона эритропоэтина (ЭПО), который является одним из регуляторов эритропоэза. Однако доказано, что при ЖДА средней и тяжелой степени, продукция ЭПО может быть недостаточна [13,14]. Это является одной из причин низкой эффективности, в ряде случаев, традиционной антианемической терапии с применением железосодержащих препаратов во время беременности и после родов. Кроме того, такая терапия длительна, что иногда вызывает побочные реакции со стороны желудочно-кишечного тракта. Применение гемотрансфузий после кровотечений в акушерстве, также как и в хирургии, в настоящее время все более ограничено как риском заражения вирусными инфекциями и возникновением осложнений, так и дороговизной препаратов крови.
Все вышеперечисленное предопределило необходимость разработки рациональных схем лечения родильниц с ЖДА с учетом степени тяжести анемии.
В зависимости от уровня гемоглобина (Hb) ЖДА принято делить на стадии. Легкая степень анемии у родильниц характеризуется снижением Hb до 100-90 г/л; средняя степень — от 89 до 70 г/л; тяжелая -менее 70 г/л [1,3].
Патогенетическая терапия ЖДА включает препараты железа.
Без их применения устранить анемию и дефицит железа невозможно. Препараты железа обычно назначают внутрь, реже парентерально. Среди основных лекарственных препаратов железа для приема внутрь, практически не вызывающих побочные эффекты и имеющихся в продаже в настоящее время, для лечения родильниц с постгеморрагической анемией, рекомендуются препараты трехвалентного железа. Начальная доза элементарного железа в сутки и длительность лечения ЖДА зависят от исходной степени тяжести анемии. Рекомендуемая терапевтическая доза составляет 100-200 мг элементарного железа в сутки. Более высокие дозы не увеличивают эффективность, однако могут учащать появление побочных эффектов [4,6,7,9].
Лечение беременных и родильниц с анемией должно быть комплексным. Помимо препаратов железа Fe2+ или Fe3+, перорально показан прием поливитаминов и биологически активных добавок, содержащих железо [6,10,16].
У беременных и родильниц при развитии железодефицитных состояний отмечается снижение уровня коэффициента адекватности продукции эритропоэтина пропорционально стадии дефицита железа. Частота неадекватной продукции эритропоэтина в среднем выявляется у 47,2% беременных с ЖДА легкой степени, а у родильниц — пропорционально степени тяжести ЖДА (у 12% родильниц при легкой степени тяжести, у 50% -при средней и у 80% — при тяжелой степени тяжести ЖДА) [2,17].
Необходимо отметить, что эффективность лечения препаратами железа беременных и родильниц с ЖДА зависит от суточной дозы элементарного железа и от уровня эндогенного эритропоэтина. При адекватном уровне эритропоэтина эффективность лечения в 2,5 раза выше по сравнению с таковой у пациенток с неадекватным уровнем.
Следует отметить, что в ряде случаев лечение родильниц с ЖДА препаратами железа перорально бывает неэффективным [8,11,15]. В таких случаях следует использовать препараты парентерального железа.
Оптимальным является применение препарата Венофер для внутривенного введения, представляющего собой железо в форме гидроксид сахарозного комплекса.
Родильницам с неадекватной продукцией эритропоэтина, помимо препаратов железа, необходимо проводить заместительную терапию с помощью стандартных доз рекомбинантного эритропоэтина (РЭПО). К данной группе лекарственных средств относятся препараты Эпокрин, Эритростим, а также эритропоэтин пролонгированного действия Мирцера.
ЖДА является заключительным этапом железодефицитного состояния, крайней его степенью. ЖДА возникает при снижении гемоглобинового фонда железа и проявляется симптомами анемии и гипосидероза. Поэтому в лечении ЖДА принято выделять несколько этапов.
На I этапе лечения, целью которого является восстановление нормального уровня гемоглобина, происходит купирование анемии. Длительность терапии составляет 1,5-2 месяца. Средние суточные дозы элементарного железа на I этапе должны составлять 120-150 мг, что соответствует 350-450 мг сульфата железа. На II этапе, получившем название «терапия насыщения», происходит восстановление запасов железа в организме. Терапия на этом этапе длительна и продолжается от 3 до 5-6 месяцев. Средняя суточная доза элементарного железа на II этапе составляет 50 мг, что соответствует 150 мг сульфата железа [3,10].
Лечение родильниц с ЖДА имеет свои особенности и требует учета многих факторов, в частности, степени тяжести анемии, суток послеродового периода и способа родоразрешения, наличия сопутствующей экстрагенитальной патологии, степени выраженности анемического синдрома, дефицита железа и т.д. Лечение родильницы с ЖДА всегда должно быть индивидуальным, с обязательным учетом клинических проявлений анемического и сидеропенического синдрома, сопутствующей патологии, а также данных лабораторного исследования. Лабораторные исследования включают определение основных гематологических показателей (гемоглобин, эритроциты, гематокрит, ретикулоциты) и ключевых показателей обмена железа (ферритин, коэффициент насыщения трансферрина железом, сывороточное железо), а также уровня эритропоэтина в сыворотке (при имеющихся лабораторных возможностях).
При отсутствии эффекта от лечения ЖДА легкой степени тяжести препаратами железа, а также при лечении родильниц с ЖДА тяжелой и средней степени показано применение эпоэтина -альфа или -бета (по 70-80 ед/кг массы тела у родильниц, через день, подкожно, 3-6 инъекций) в сочетании с препаратами железа (Ш)-гидроксид полимальтозата: железа (Ш)-гидроксид полимальтозат (Мальтофер), железа (Ш)-гидроксид полимальтозат/фолиевая кислота (Мальтофер Фол) или с железа (Ш)-гидроксид сахарозным комплексом (Венофер) по 5-10 мл в 200-400 мл физиологического раствора в/в капельно через день.
Лечение беременных и родильниц с атипичным клиническим вариантом ЖДА, развившимся на фоне заболеваний, сопровождающихся воспалением (заболевания почек; острые и хронические инфекционно-воспалительные заболевания; аутоиммунные заболевания; злокачественные новообразования и др.) рекомендуется начинать в первую очередь с терапии основного заболевания, вызвавшего воспалительный процесс в организме. При этом в случае отсутствия эффекта от лечения препаратами железа необходимо использовать вышеуказанные препараты эритропоэтина в сочетании с препаратами железа (Ш)-гидроксид полимальтозата перорально или с железа (Ш)-гидроксид сахарозным комплексом (Венофер) парентерально.
Родильницам с анемией после кесарева сечения в первые трое суток после операции, учитывая диету, рекомендуется прием внутрь препаратов железа в форме раствора: железа протеинит сукцинилат (Ферлатум) внутрь 1 флакон 2 раза в сутки или железа глюконат внутрь 1 ампула 2 раза в сутки (Тотема) или железа (Ш)-гидроксид сахарозный комплекс (Венофер) парентерально.
Опыт многолетней научно-практической работы по проблеме железодефицитных состояний в пуэрперии позволил разработать и внедрить рациональные схемы лечения ЖДА для наиболее типичных групп родильниц.
ЖДА средней степени тяжести после кесарева сечения
I Этап (купирование анемии)
А. (в стационаре). Венофер (Швейцария) по 5 мл в 200 мл физиологического раствора в/в капельно (медленно!) через день 5 раз.
Б. (после выписки). Мальтофер Фол по 1 табл. 3 раза в сутки (1 месяц)
II Этап (терапия насыщения)
А. Мальтофер Фол по 1 табл. 2 раза в сутки (2 месяца).
Б. Мальтофер Фол по 1 табл. 1 раз в сутки (3 месяца).
ЖДА тяжелой степени после родов
I Этап (купирование анемии)
А. (в стационаре). Венофер по 10 мл в 400 мл физиологического раствора в/в капельно (медленно!) через день 5 раз.
Б. (после выписки). Мальтофер Фол по 1 табл. 3 раза в сутки (1 месяц).
II Этап (терапия насыщения)
A. Мальтофер Фол по 1 табл. 2 раза в сутки (2 месяца).
Б. Мальтофер Фол по 1 табл. 1 раз в сутки (3 месяца).
B. Ферретаб, Актиферрин, Фенюльс по 1 табл. 1 сутки (3 месяца).
ЖДА тяжелой степени после кесарева сечения
I. Этап (купирование анемии)
А. (в стационаре). Венофер по 10 мл в 400 мл физиологического раствора в/в капельно (медленно!) через день 5 раз + Эпокрин по 50 единиц/кг массы тела, подкожно, 3 раза в неделю 6 раз.
Б. (после выписки). Мальтофер Фол по 1 табл. 1 раз в сутки (3 месяца).
II. Этап (терапия насыщения)
A. Мальтофер Фол по 1 табл. 2 раза в сутки (2 месяца).
Б. Мальтофер Фол по 1 табл. 1 раз в сутки (3 месяца).
B. Ферретаб, Актиферрин, Фенюльс по 1 табл. 1 день (3 месяца).
При оценке эффективности 1-го этапа лечения, необходимо учитывать последовательность появления положительных признаков. Клиническое улучшение (уменьшение мышечной слабости, одышки, улучшение настроения) может наступать уже к 3-6-му дню лечения. Особенно ярко эти улучшения проявляются на фоне лечения препаратами железа в сочетании с рекомбинантным эритропоэтином. Повышение уровня ретикулоцитов чаще наблюдается на 8-12-й день. Нарастание уровня гемоглобина у многих родильниц начинается через 1-2 недели лечения. Иногда подъем Hb носит скачкообразный характер. В среднем нормализация уровня Hb происходит через 1-1,5 месяца, в зависимости от степени тяжести анемии [1,3,6]. На II этапе при проведении терапии насыщения, направленной на восстановление запасов железа в организме родильницы, учитывается динамика показателей, характеризующих обмен железа. Контроль эффективности, длительности применения и дозы препарата на II этапе осуществляется индивидуально, на основе динамической оценки феррокинетических показателей не реже 1 раза в месяц. Нормализация уровня сывороточного железа, коэффициента насыщения трансферрина железом и уровня сывороточного ферритина происходит постепенно, в указанной последовательности и свидетельствует о восстановлении запасного фонда железа и полного устранения железодефицитного состояния в организме.
Е.Н. Коноводовой [2], В.Н. Серовым и соавт. [3] накоплен большой практический опыт использования препарата Венофер для парентерального применения у родильниц со средней и тяжелой степенью анемии.
Венофер — стимулятор эритропоэза, антианемический препарат. В препарате Венофер железо находится в виде комплексного соединения гидроксида железа (III) (0,02 г железа в 1 мл) с сахарозой. Трехвалентное железо стимулирует образование гема, что, в конечном итоге, способствует повышению уровня гемоглобина. Поскольку железо в препарате Венофер находится в неионизированной форме, препарат не оказывает таких побочных эффектов, как раздражение слизистой оболочки желудочно-кишечного тракта, окрашивание зубов,
металлический привкус во рту. После однократного внутривенного введения препарата Венофер, содержащего 100 мг железа, максимальная концентрация железа достигается спустя 10 мин после инъекции. Период полувыведения препарата — около 6 ч. Благодаря низкой стабильности железа сахарата в сравнении с трансферрином наблюдается конкурентный обмен железа в пользу трансферрина [5,12].
Многоядерные центры железа (III) гидроксида окружены снаружи множеством нековалентно связанных молекул сахарозы. В результате образуется комплекс, молекулярная масса которого составляет приблизительно 43 кД, вследствие чего его выведение через почки в неизмененном виде невозможно. Данный комплекс стабилен и в физиологических условиях не выделяет ионы железа. Железо в этом комплексе связано со структурами, сходными с естественным ферритином.
Препарат назначают по 0,05-0,2 г на 400 мл 0,9% раствора хлорида натрия в сутки внутривенно капельно.Стандартная дозировка: 5-10 мл Венофер (100-200 мг железа) 1-3 раза в неделю в зависимости от уровня гемоглобина.
Следует отметить, что Венофер предпочтительнее вводить в ходе капельной инфузии для того, чтобы уменьшить риск выраженного снижения артериального давления и опасность попадания раствора в околовенозное пространство. Непосредственно перед инфузией Венофер нужно развести 0,9% раствором натрия хлорида в соотношении 1:20 [например, 1 мл (20 мг железа) в 20 мл 0,9% раствора натрия хлорида]. Полученный раствор вводится со следующей скоростью: 100 мг железа — не менее чем за 15 минут; 200 мг железа — в течение 30 минут; 300 мг железа — в течение 1,5 часов; 400 мг железа — в течение 2,5 часов; 500 мг железа — в течение 3,5 часов. Введение максимально переносимой разовой дозы, составляющей 7 мг железа/кг массы тела, следует производить в течение минимум 3,5 часов, независимо от общей дозы препарата.
Перед первым капельным введением терапевтической дозы препарата Венофер, необходимо ввести тест-дозу — 20 мг железа. При отсутствии нежелательных явлений оставшуюся часть раствора следует вводить с рекомендованной скоростью.
Расчет дозы. Доза рассчитывается индивидуально в соответствии с общим дефицитом железа в организме по формуле:
Общий дефицит железа (мг) = масса тела (кг) х (нормальный уровень Hb — Hb больного) (г/л) х 0,24* + депонированное железо (мг).
Общий объем препарата Венофер, который необходимо ввести (в мл) = общий дефицит железа (мг) / 20 мг/мл.
Оценка эффективности лечения проводится через 3-4 недели от начала лечения препаратами железа путем подсчета процентного роста значений гематологических показателей (Hb, Ht, RBC) по отношению к исходному уровню. Повышения Hb менее чем на 6% (2% в неделю); Ht — менее чем на 1,5% (0,5% в неделю); RBC менее чем на 3% (1% за неделю) свидетельствуют о неэффективности лечения.
Таким образом, применение алгоритма диагностики и лечения ЖДА у родильниц, учитывающего клинический вариант (типичный, атипичный), стадию, степень тяжести, уровень коэффициента адекватности продукции эритропоэтина (адекватный, неадекватный) обеспечивает эффективное патогенетическое лечение ЖДА благодаря индивидуально подобранной терапии (препараты железа, доза, форма, способ введения и длительность приема, сочетание с поливитаминами и препаратами эритропоэтина). Вышеотмеченное приводит к сокращению сроков лечения, снижению частоты гемотрансфузий, улучшению качества жизни и уменьшению числа койкодней в стационаре. Парентеральные препараты железа зарекомендовали себя, как альтернатива гемотрансфузиям у родильниц с тяжелой степенью анемии. Опыт применения препарата Венофер показал его высокую эффективность и переносимость в лечении ЖДА у родильниц.
Литература
1. Коноводова Е.Н. Железодефицитные состояния у беременных и родильниц (патогенез, диагностика, профилактика, лечение). Автореф. дисс. доктора мед. наук.- М.-2008.- 46с.
2. Серов В. Н., Бурлев В.А., Коноводова Е. Н. и др. Лечение манифестного дефицита железа у беременных и родильниц (медицинская технология). // Разрешение (серия АА №0000151) федеральной службы по надзору в сфере здравоохранения и социального развития на применение новой медицинской технологии ФС №2010/003 от 18.01.2010 г. М.: МедЭкспертПресс, 2010.-28с.
3. Серов В.Н., Бурлев В.А., Коноводова Е.Н. Железодефицитные состояния у беременных и родильниц. // Глава №5 в книге: Алгоритмы диагностики и лечения гинекологических заболеваний. Под редакцией В.Н. Серова, «Литтерра».- М., 2008.- 1600с.
4. Хух Р., Брейман К. Анемия во время беременности и в послеродовом периоде.- М.: «Триада-Х», 2007.- 73с.
5. Шалина Р.И., Кутакова Ю.Ю., Бреусенко Л.И. и др. Оценка эффективности применения препарата Венофер при железодефицитных состояниях после акушерских кровотечений. // Вопросы гинекологии, акушерства и перинатологии.-2004.-Т.3, № 1.- C.37-42.
6. Allen L. H. Anemia and iron deficiency: effects on pregnancy outcome. Am. J. Clin. Nutr. 2000; 71: 1280-4.
7. Barroso F., Allard S., Kahan B.C. et al. Prevaence of maternal anaemia and its predictors: a multi-centre study. Eur J Obstet Gynecol Reprod Biol. 2011; 2: 179-86.
8. Bhanda N., Russel R. Intravenosus versus oral iron therapy for postpartum anaemia. BJOG.2006; 113 (11): 1248-52.
9. Bergmann R.L., Richter R., Bergmann K.E., Dudenhausen J.W. Prevaence and risk factors for early postpartum anemia. Eur J Obstet Gynecol Reprod Biol. 2010; 150(2):126-31
10. Breymann C, Honegger C, Holzgreve W, Surbek D.Diagnoss and treatment of iron-defciency anaemia during pregnancy and postpartum.Arch Gynecol Obstet. 2010; 282 (5): 577-80.
11. Daniilidis A, Giannoulis C, Pantelis A, et a. Tota infusion of low molecular weight iron-dextran for treating postpartum anemia. Clin Exp Obstet Gynecol. 2011;38(2):159-61.
12. Khalafallah A., Dennis A., Bates J. et al.A prospective randomized, controlled trial of intravenous versus oral iron for moderate iron deficiency anaemia of pregnancy.J. Intern. Med. 2010;
268(3):286-95.
13. Krafft A, Bencaiova G., Breymann C. Selective use of recombinant human erythropoietin in pregnant patients with severe anemia or nonresponsive to iron sucrose alone.Fetal Diagn Ther. 2009; 25 (2): 239-45.
14. Krafft A., Breymann C. Iron sucrose with and without recombinant erythropoietin for the treatment of severe postpartum anemia: a prospective, randomized, open-label study. J. Obstet. Gynaecol. Res. 2011; 37 (2): 119-24.
15. Milman N. Postpartum anemia: definition, prevalence, causes, and consequences. Ann Hematol. 2011; 28: 7-15.
16. Mitra A.K., Khoury AJ. Universal iron supplementation: a simple and effective strategy to reduce anaemia among low-income, postpartum women.Public Heath Nutr. 2011; 23:1-8.
17. Wagstr m E, Akesson A, Van Rooijen M. et al. Erythropoietin and intravenous iron therapy in postpartum anaemia.Acta Obstet Gynecol Scand. 2007;86(8): 957-62.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Источник
Гестационный диабет при беременности
Что это такое?
Гестационный сахарный диабет (ГСД) – нарушение обмена глюкозы в организме беременной женщины. Он сопровождается повышенным содержанием глюкозы в крови и развивается строго во время беременности у пациенток, которые до этого были здоровы. Заболевание возникает только в период беременности и зачастую проходит после родов.
В чем его причина?
Сахарный диабет у беременных развивается из-за гормонального взрыва, связанного с вынашиванием ребенка. Поступающий в кровь гормональный коктейль (кортизол, хорионический гонадотропин, эстрогены и прогестерон) тормозит действие инсулина, который обязан обеспечивать поступление глюкозы из крови в клетки. Происходит это потому, что организм пытается сэкономить глюкозу для растущего плода и провоцирует «инсулиновую резистентность», когда клетки матери перестают реагировать на обычное количество инсулина. В ответ на возрастающее количество глюкозы в крови поджелудочная железа должна вырабатывать больше инсулина, но иногда она не справляется. Возникает гестационный диабет.
До 39% всех беременностей осложнены ГСД.
Кто в группе риска
| Фактор риска | Последствия |
| Возраст матери — старше 40 лет | Крупный плод |
| Ожирение матери, или избыток массы тела | Многоводие |
| Гестационный диабет в анамнезе | Избыточная прибавка веса во время текущей беременности |
| Ранний или поздний гестозы в анамнезе | Врожденные пороки развития плода |
| Сахарный диабет у ближайших родственников | Выделение глюкозы с мочой |
| Выкидыши или мертворождения в анамнезе | |
| Заболевания и состояния, которые могут провоцировать развитие диабета (метаболический синдром, синдром поликистозных яичников, повышенное артериальное давление, высокий уровень холестерина) | |
| Многоплодная беременность |
Чем опасен ГСД?
ГСД может стать причиной различных осложнений беременности, что опасно как для матери, так и для ребенка.
Опасность ГСД для матери
Риск для здоровья будущей матери связан с избытком глюкозы в крови и ее отложением в тканях и органах. Как и любая разновидность сахарного диабета, ГСД может способствовать возникновению:
- Диабетической ретинопатии – поражению сосудов и рецепторов сетчатки с постепенным ухудшением зрения (рис. 1).
- Диабетической нефропатии – повреждение клубочкового и канальцевого аппарата почек, в котором плазма крови фильтруется с образованием мочи. В результате развивается хроническая почечная недостаточность.
- Артериальной гипертензии – повышенное давление, возникающее из-за поражения сосудов, почек и изменения гормонального фона с развитием диабета. Все это увеличивает риск прерывания беременности и появления отклонений у плода.
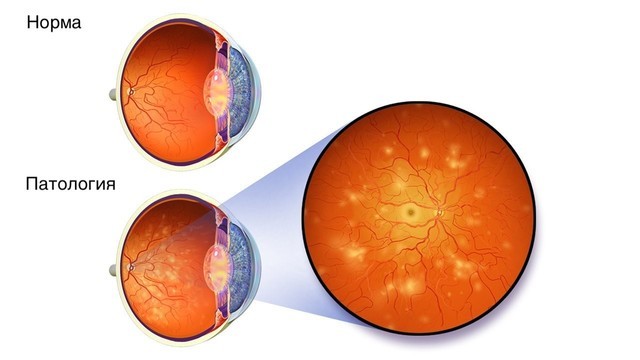 Рисунок 1. Диабетическая ретинопатия. Источник: WikiMedia
Рисунок 1. Диабетическая ретинопатия. Источник: WikiMedia
Риск для ребенка
Повышенное содержание глюкозы в крови беременной женщины может навредить не только ей самой, но и будущему ребенку, способствуя:
- диабетической фетопатии (нарушение обмена углеводов у будущего ребенка, которое может перейти в неонатальный, младенческий сахарный диабет);
- рождению крупного плода – макросомии (увеличивает риск кесарева сечения и травм ребенка при родах);
- неонатальной гипогликемии (низкий уровень сахара в крови новорожденного и дыхательные нарушения, что может привести к его смерти);
- внутриутробной гибели плода (это самое страшное последствие ГСД);
- многоводию (опасно преждевременными родами, неправильным положением плода, выпадением петель пуповины и их пережатию, отслойке плаценты при разрыве плодных оболочек);
- увеличению размеров печени и сердца у плода.
- нарушению роста и развития ребенка уже после рождения.
ГСД также увеличивает риск выкидыша – сосуды плаценты «пропитываются» глюкозой, что ведет к нарушению кровотока и гипоксии (кислородному голоданию) плода, что провоцирует преждевременную родовую активность матки.
Симптомы
Клиническая картина гестационного сахарного диабета довольно скудна, женщина может и вовсе не предъявлять никаких жалоб. Стоит обратить внимание на такие признаки:
- Немотивированная слабость,
- Жажда, сухость во рту,
- Частое мочеиспускание,
- Нечеткость зрения.
Диагностика
Диагностика гестационного диабета не представляет особой сложности. Она основана на определении уровня глюкозы в крови и анализе других показателей углеводного обмена.
К какому врачу обратиться?
После того, как женщина узнала о своей беременности, ей следует пойти в женскую консультацию и встать на учет. Терапевт или акушер-гинеколог во время первого приема расскажут, какие обследования и в каком объеме ей предстоят до родов.
Анализы и их показатели
Обычно при постановке на учет, на сроке 10-13 недель, все женщины проходят скрининг здоровья, который должен выявить основные отклонения беременности, включая нарушения углеводного обмена. В рамках этого скрининга проводят исследование уровня гликированного гемоглобина, а также исследование глюкозы венозной плазмы натощак и в течение дня. Этот анализ позволяет определить, был ли сахарный диабет у женщины до беременности. Чтобы диагноз подтвердили, значение гликированного гемоглобина должно превышать 6,5%.
Между 24 и 28 неделями беременности женщинам, у которых никаких отклонений ранее обнаружено не было, делают повторный тест: на определение гестационного диабета (рис. 2). Называется этот анализ «глюкозотолерантный тест» и проводится по следующей схеме:
- Утром женщина сдает кровь на глюкозу натощак,
- Затем ей дают выпить концентрированный раствор глюкозы (75 г глюкозы),
- Через 1 и 2 часа после нагрузки (выпитого раствора) проводят повторное исследование крови.
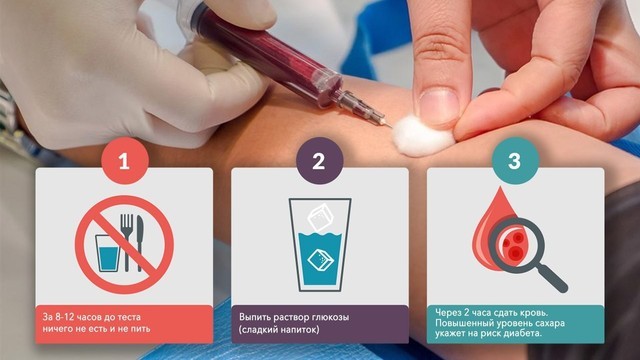 Рисунок 2. Проведение глюкозотолерантного теста. Источник: СС0 Public Domain
Рисунок 2. Проведение глюкозотолерантного теста. Источник: СС0 Public Domain
Результаты теста считаются положительными, если обнаружен хотя бы один из перечисленных признаков:
- Уровень глюкозы натощак выше 5,1 ммоль/л,
- Уровень глюкозы через 1 час после нагрузки выше 10,0 ммоль/л,
- Уровень глюкозы через 2 часа после нагрузки выше 8,5 ммоль/л.
Важно! Для диагностики ГСД подходит ТОЛЬКО глюкозотолерантный тест. Тест на гликированный гемоглобин не применяют, так как это исследование часто дает ложноотрицательный результат. Кроме того, с его помощью нельзя отследить степень повышения глюкозы в крови после приема пищи.
Есть ли противопоказания к проведению теста?
Да, есть. Абсолютные и относительные.
К абсолютным противопоказаниям относятся:
- Аллергия и/или непереносимость глюкозы,
- Сахарный диабет в острой фазе (тогда тест не нужен),
- Заболевания желудочно-кишечного тракта, при которых нарушается нормальное всасывание глюкозы (обострение панкреатита, операции на желудке).
Относительные (временные) противопоказания:
- Ранний токсикоз (гестоз) беременных,
- Обострение хронических заболеваний
Важно! Вовремя определить наличие ГСД очень важно. Скрининг рекомендован всем беременным женщинам. Глюкозотолерантный тест не вредит печени, этого тестирования не следует бояться.
При постановке диагноза ГСД иногда прибегают к дополнительным исследованиям, в их числе:
- Общий анализ мочи (глюкозурия – обнаружение глюкозы в моче, которой в норме там не должно быть, а также кетоновые тела – продукты нарушенного метаболизма глюкозы),
- УЗИ плода (наличие фетопатии – нарушений развития плода).
Лечение во время беременности
Терапия ГСД – задача сложная и комплексная. Препараты подбираются так, чтобы не нанести вред плоду. А лечение при необходимости может продолжаться и после родов.
Диета
Соблюдение особого режима питания — это первая ступенька на пути к избавлению от диабета беременных. Медикаментозное лечение ГСД не будет эффективным без соблюдения диеты. На что нужно обратить внимание:
- Необходимо исключить быстрые углеводы (сладости, выпечку, белый хлеб, пирожные, фрукты), а также ограничить жиры,
- Приемов пищи должно быть несколько, питаться следует каждые 2-3 часа,
- Следует потреблять достаточно белка и сократить потребление продуктов с высоким содержанием крахмала (рис, хлеб, макаронные изделия, картофель, кукуруза),
- Полезным будет увеличение потребления овощей и зелени, растительных масел и других продуктов, богатых ненасыщенными жирами,
- Важно соблюдать баланс белков, углеводов и жиров, а также следить за калорийностью своего рациона.
Важно! Нельзя самостоятельно назначать себе диету! Она должна быть составлена специалистом с учетом потребностей будущей мамы и малыша.
Помимо изменений в рационе, включите в свой распорядок дня умеренную регулярную физическую активность. Занимайтесь не менее 150 минут в неделю, очень полезно плавание.
Отслеживание содержания сахара в крови
Второй шаг в борьбе с ГСД — это ежесуточный контроль сахара в крови. Он нужен, чтобы понять, помогает ли диета.
Чтобы определять у себя глюкозу, не нужно ходить к врачу, для это существует специальный прибор — глюкометр (рис.3).
 Рисунок 3. Комплект из глюкометра, ручки для прокалывания кожи, набора тест-полосок и иголок для ручки-картриджа. Источник: WikiMedia
Рисунок 3. Комплект из глюкометра, ручки для прокалывания кожи, набора тест-полосок и иголок для ручки-картриджа. Источник: WikiMedia
С его помощью больные с ГСД проверяют свои показатели глюкозы натощак и через 1-2 часа после еды каждый день в течение недели, занося полученные данные в журнал. Исходя из полученных результатов врач-эндокринолог решает, потребуется ли медикаментозное лечение, или ГСД уже взят под контроль с помощью ограничений в питании. Лекарства назначают, если одна треть или более результатов говорят о содержании глюкозы:
- натощак — более 5,3 ммоль/л,
- через час после еды — более 7,2-7,8 ммоль/л,
- через 2 часа после еды — более 6,5 ммоль/л.
Иногда врач также просит вести дневник артериального давления, массы тела и питания. Контролировать сахар также можно в моче, используя тест-полоски.
Важно! Уже появились приборы без иголки – ее заменяет датчик в виде пластыря, который наклеивают на кожу. Глюкометр считывает его показания в непрерывном режиме. Можно настроить прибор так, чтобы данные шли на мобильный телефон или сразу отправлялись врачу.
Медикаментозное лечение: инсулин
Для контроля уровня гликемии назначают сахароснижающие препараты:
- При неконтролируемой гликемии и наличии фетопатии в первую очередь применяют инсулин. Он безопасен для плода, дозу и режим введения устанавливает эндокринолог в индивидуальном порядке.
- В некоторых случаях для лучшего контроля гликемии устанавливают инсулиновую помпу.
- Применяют таблетированные сахароснижающие препараты строго по показаниям.
Во время лечения контроль сахара в крови не прерывают, все данные о дозах препаратов и содержании глюкозы в крови записывают, чтобы врач мог корректировать схему их приема.
Важно! Инсулин считают лучшим средством лечения ГСД. На сегодняшний день нет достаточно данных, чтобы судить об отложенных эффектах других сахароснижающих препаратов.
Роды при ГСД
Гестационный диабет не мешает естественным родам и не является показанием к кесареву сечению. Рожать следует не позднее 38–39 недель беременности. Кесарево сечение выполняют по стандартным показаниям:крупный плод, его тяжелая патология, узкий таз и т.д. Дополнительными показаниями являются выраженные признаки диабетической фетопатии.
После родов
Гестационный диабет – заболевание, характерное для беременности. После родов ГСД проходит, так как гормональный фон нормализуется.
Однако нельзя забывать, что ГСД служит фактором риска развития сахарного диабета 2 типа и повторного заболевания во время следующей беременности.
Сразу после родов, если была назначена инсулинотерапия, она отменяется. В течение первых дней уровень глюкозы контролируют путем забора венозной крови. Если никаких отклонений нет, через 6–12 недель после родов проводят глюкозотолерантный тест, чтобы исключить диабет 2-го типа.
Если во время беременности был диагностирован ГСД, необходимо соблюдать диету и заниматься дозированными физическими нагрузками. В остальном нет никаких ограничений, после ГСД можно кормить грудью как обычно.
Прогноз
Своевременная терапия ГСД с помощью инсулина сокращает риск развития осложнений на 98%. Тяжелые последствия после болезни наблюдаются, если вовремя не поставлен диагноз и лечение отсутствует.
Важно! ГСД протекает незаметно, но может нанести большой вред ребенку, став причиной:
- различных пороков развития плода,
- Макросомии (крупные размеры плода),
- Гипогликемии и дыхательных нарушений у новорожденного,
- Сердечно-сосудистых и неврологических заболеваний,
- Метаболического синдрома (нарушение углеводного обмена).
Самый страшный исход – внутриутробная гибель плода и выкидыш.
Однако, ГСД увеличивает риск развития диабета первого и второго типа в будущем. Вероятность развития сахарного диабета 1 типа составляет 5,7% в течение последующих 7 лет, 2 типа — вплоть до 50%.
У ребенка, родившегося у матери с ГСД, также повышен риск ожирения и возникновения сахарного диабета.
Профилактика
Основная мера профилактики ГСД – контроль веса и тщательное планирование беременности.
Ожирение является одним из главных факторов риска развития ГСД. Чем больше жира в организме, тем в меньшей степени его клетки становятся отзывчивыми на команды инсулина захватить из крови глюкозу.
Важно! Пытаться похудеть во время беременности не стоит. Вы должны есть достаточно, чтобы плод не пострадал от недостатка нутриентов.
Заключение
Итак, что необходимо запомнить о гестационном сахарном диабете:
- ГСД – заболевание, затрагивающее исключительно беременных женщин. После родов оно проходит.
- ГСД несет существенные риски осложнений как для матери, так и плода.
- Заболевание поддается профилактике – рекомендуют контролировать вес и тщательно планировать беременность.
- Сахарный диабет беременных не является абсолютным показанием для кесарева сечения.
- Если поставлен диагноз ГСД – не паниковать! Следуйте рекомендациям врача, следите за уровнем глюкозы, артериальным давлением, ведите дневник питания, а также не забывайте об умеренных физических нагрузках (ходьбы будет достаточно).
Источники
- Gestational Diabetes Mellitus // American Diabetes Association Diabetes Care 2003 Jan; 26(suppl 1): s103-s105. https://doi.org/10.2337/diacare.26.2007.S103
- Thomas R. Moore. Maternal Morbidity. Diabetic retinopathy // Medscape. – 2020
Источник