Разрушение эритроцитов с выходом гемоглобина характеризуется как
Содержание статьи
тарение эритроцитов. Разрушение эритроцитов. Длительность жизни эритроцита. Эхиноцит. Эхиноциты.
| Оглавление темы «Функции клеток крови. Эритроциты. Нейтрофилы. Базофилы.»: 1. Функции клеток крови. Функции эритроцитов. Свойства эритроцитов. Цикл Эмбдена-Мейергофа. Строение эритроцитов. 2. Гемоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина. 3. Старение эритроцитов. Разрушение эритроцитов. Длительность жизни эритроцита. Эхиноцит. Эхиноциты. 4. Железо. Железо в норме. Роль ионов железа в эритропоэзе. Трансферрин. Потребность организма в железе. Дефицит железа. ОЖСС. 5. Эритропоэз. Эритробластические островки. Анемия. Эритроцитоз. 6. Регуляция эритропоэза. Эритропоэтин. Половые гормоны и эритропоэз. 7. Лейкоциты. Лейкоцитоз. Лейкопения. Гранулоциты. Лейкоцитарная формула. 8. Функции нейтрофильных гранулоцитов ( лейкоцитов ). Дефенсины. Кателицидины. Белки острой фазы. Хемотаксические факторы. 9. Бактерицидный эффект нейтрофилов. Гранулопоэз. Нейтрофильный гранулопоэз. Гранулоцитоз. Нейтропения. 10. Функции базофилов. Функции базофильных гранулоцитов. Нормальное количество. Гистамин. Гепарин. Старение эритроцитов. Разрушение эритроцитов. Длительность жизни эритроцита. Эхиноцит. Эхиноциты.Эритроциты у человека функционируют в крови максимум 120 дней, в среднем 60-90 дней. Старение эритроцитов связано с уменьшением образования в эритроците количества АТФ в ходе метаболизма глюкозы в этой клетке крови. Уменьшенное образование АТФ, ее дефицит нарушает в эритроците процессы, обеспечиваемые ее энергией, — восстановление формы эритроцитов, транспорт катионов через его мембрану и защиту компонентов эритроцитов от окисления, их мембрана теряет сиаловые кислоты. Старение эритроцитов вызывает изменения мембраны эритроцитов: из дискоцитов они превращаются в эхиноциты, т. е. эритроциты, на поверхности мембраны которых образуются многочисленные выступы, выросты (рис. 7.3). Причиной формирования эхиноцитов помимо уменьшения воспроизводства молекул АТФ в эритроците при старении клетки является усиленное образование лизолецитина в плазме крови, повышенное содержание в ней жирных кислот. Под влиянием перечисленных факторов изменяется соотношение поверхности внешнего и внутреннего слоев мембраны эритроцита за счет увеличения поверхности внешнего слоя, что и приводит к появлению выростов на мембране.
По степени выраженности изменений мембраны и формы эритроцитов различают эхиноциты I, И, III классов и сфероэхиноциты I и II классов. При старении эритроцит последовательно проходит этапы превращения в эхиноцит III класса, теряет способность изменять и восстанавливать дисковидную форму, превращается в сфероэхиноцит и разрушается. Устранение дефицита глюкозы в эритроците легко возвращает эхиноциты I-II классов к форме дискоцита. Эхиноциты начинают появляться, например, в консервированной крови, сохраняемой в течение нескольких недель при 4°С, или в течение 24 ч, но при температуре 37 °С. Это связано с уменьшением образования АТФ внутри клетки, с появлением в плазме крови лизолецитина, образующегося под влиянием лецитин-холестерол-ацетилтранс-ферразы, ускоряющих старение клетки. Отмывание эхиноцитов в свежей плазме от содержащегося в ней лизолецитина или активация в них гликолиза, восстанавливающей уровень АТФ в клетке, уже через несколько минут возвращает им форму дискоцитов. Стареющие эритроциты становятся менее эластичными, вследствие чего разрушаются внутри сосудов (внутрисосудистый гемолиз) или же становятся добычей захватывающих и разрушающих их макрофагов в селезенке, купферовских клетках печени и в костном мозге (внесосудистый или внутриклеточный гемолиз). Внутриклеточным гемолизом в сутки разрушается 80-90 % старых эритроцитов, содержащих 6-7 г гемоглобина, из которых освобождается в макрофагах до 30 мг железа. После отщепления от гемоглобина гем превращается в желчный пигмент билирубин, который поступает с желчью в кишечник и под влиянием микрофлоры кишечника последовательно превращается в уробилиноген, а затем в стеркобилиноген. Оба соединения выводятся из организма с калом и мочой, под влиянием света и воздуха превращаясь в стеркобилин и уробилин. При метаболизме 1 г гемоглобина образуется 33 мг билирубина. Внутрисосудистым гемолизом разрушается 10-20 % эритроцитов. При этом гемоглобин поступает в плазму, образует с плазменным гликопротеином гаптоглобином комплекс гемоглобин-гаптоглобин. В течение 10 мин 50 % комплекса поглощается из плазмы паренхиматозными клетками печени, что предупреждает поступление свободного гемоглобина в почки и тромбирование им их нефронов. У здорового человека в плазме содержится около 1 г/л плазмы гаптоглобина, что оставляет несвязанным с ним в плазме крови не более 3-10 мг гемоглобина. Молекулы гема, высвобождающиеся из связи с глобином при внутрисосудистом гемолизе, связываются белком плазмы — гемопексином, транспортируются им в печень и также поглощаются паренхиматозными клетками печени, где подвергаются ферментному разрушению до билирубина. — Также рекомендуем «Железо. Железо в норме. Роль ионов железа в эритропоэзе. Трансферрин. Потребность организма в железе. Дефицит железа. ОЖСС.» |
Источник
азрушение гемоглобина. Разновидности анемий
Разрушение гемоглобина. Разновидности анемий
При разрыве эритроцитов их гемоглобин почти сразу же фагоцитируется макрофагами во многих частях тела, но особенно клетками Купфера печени и макрофагами селезенки и костного мозга. В течение нескольких следующих часов или дней макрофаги освобождают железо из гемоглобина, и оно возвращается в кровь и переносится трансферрином либо в костный мозг для формирования новых красных клеток крови, либо в печень и другие ткани для хранения в форме ферритина.
Порфириновая часть молекулы гемоглобина превращается макрофагами через ряд стадий в желчный пигмент билирубин, который выделяется в кровь и позднее удаляется из организма путем секреции печенью в желчь.
Анемии
Анемия означает недостаток гемоглобина в крови, причиной может быть либо слишком малое число красных клеток крови, либо слишком малое количество гемоглобина в этих клетках. Далее представлены некоторые типы анемий и их физиологические причины.
а) Анемия, связанная с потерей крови. После острой кровопотери организм возмещает жидкую часть плазмы в течение 1-3 сут, но при этом концентрация красных клеток крови остается низкой. Концентрация эритроцитов обычно восстанавливается до нормы в течение 3-6 нед, если не происходит повторного кровотечения.
Часто при хронической кровопотере у человека железо из кишечника не может всасываться достаточно быстро, чтобы обеспечить адекватное возмещение теряемого с кровью гемоглобина. Формируемые в этом случае красные клетки крови гораздо мельче нормальных эритроцитов и содержат слишком мало гемоглобина, что характерно для микроцитарной гипохромной анемии; такие эритроциты показаны на рисунке.
б) Апластическая анемия. Аплазия костного мозга означает потерю функционирующего костного мозга. Например, у человека, подвергшегося облучению гамма-лучами при взрыве атомной бомбы, может произойти полное разрушение костного мозга с последующим развитием в течение нескольких недель летальной анемии. Тот же эффект могут вызвать избыточная рентгенотерапия, некоторые промышленные химикаты и даже лекарства, к которым у человека может быть повышенная чувствительность.
в) Мегалобластная анемия. На основании изложенного ранее обсуждения роли витамина B12, фолиевой кислоты и внутреннего фактора, секретируемого слизистой желудка, легко понять, что недостаток любого из этих веществ может привести к замедлению репродукции эритроцитов в костном мозге. В результате формируются слишком крупные красные клетки крови разнообразной формы, которые называют мегалобластами.
Следовательно, атрофия слизистой желудка, например при пернициозной анемии, или потеря всего желудка после хирургической тотальной гастрэктомии могут привести к мегалобластной анемии. Мегалобластная анемия часто развивается также у больных с кишечной спру, при которой плохо всасываются фолиевая кислота, витамин B12 и другие соединения витаминов группы В. Поскольку при этих состояниях эритробласты не могут пролиферировать достаточно быстро, чтобы формировать нормальное количество красных клеток крови, те эритроциты, которые формируются, по большей части увеличены в размерах, имеют неправильную форму и ломкие мембраны. Эти клетки легко рвутся, оставляя человека без необходимого количества красных клеток крови.
г) Гемолитическая анемия. Различные аномалии красных клеток крови, многие из которых — наследственные, делают клетки столь хрупкими, что они легко разрываются, проходя через капилляры, особенно в селезенке. Даже если количество формируемых красных клеток крови в норме или значительно ее превышает, как при некоторых гемолитических болезнях, срок жизни хрупкого эритроцита так короток, что клетки разрушаются быстрее, чем могут формироваться нормальные эритроциты; результатом этого является тяжелая анемия. Далее указаны некоторые из таких типов анемий.
При наследственном сфероцитозе красные клетки крови очень мелкие и сферические, а не двояковогнутые диски. Эти клетки не могут выдерживать сдавливания, поскольку не имеют нормальной свободной, мешкообразной клеточной мембраны, характерной для двояковогнутых дисков. При прохождении через пульпу селезенки и некоторые другие сосудистые ложа они легко ломаются даже при небольшом сдавливании.
При серповидно-клеточной анемии, которой болеют 0,3-1,0% коренных жителей Западной Африки, красные клетки крови содержат аномальный гемоглобин — гемоглобин S с поврежденными цепочками в его молекуле. Под действием низких концентраций кислорода такой гемоглобин осаждается в виде длинных кристаллов внутри эритроцита. Эти кристаллы удлиняют клетку и придают ей вид серпа, а не двояковогнутого диска.
Кроме того, осажденный гемоглобин повреждает клеточную мембрану, в результате клетка становится очень хрупкой, что сопровождается тяжелой анемией. Такие больные часто переживают порочный круг событий, называемый кризисом серповидно-клеточной болезни, при котором низкое напряжение кислорода в тканях вызывает образование серповидных форм эритроцитов, что ведет к разрушению красных клеток крови, а значит — к дальнейшему снижению напряжения кислорода, усилению образования серповидных форм и разрушению красных клеток крови. Сразу после начала процесс быстро прогрессирует, приводя в течение нескольких часов к резкому снижению числа красных клеток крови и часто — к смерти.
При гемолитической болезни новорожденных (эритробластозе) антитела от резус-отрицательной (Rh-) матери атакуют резус-положительные (Rh+) эритроциты плода. В результате резус-положительные клетки становятся ломкими, что ведет к их быстрому разрушению, способствуя развитию у новорожденного тяжелой анемии. Чрезвычайно быстрое формирование новых эритроцитов для возмещения разрушенных при гемолитической болезни новорожденных ведет к выделению в кровь из костного мозга большого количества молодых бластных форм красных клеток крови.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Также рекомендуем «Влияние анемии на кровообращение. Полицитемия — эритремия»
Оглавление темы «Эритропоэз. Белые клетки крови»:
1. Влияние эритропоэтина на эритрогенез. Витамин В12 и фолиевая кислота в эритропоэзе
2. Пернициозная анемия. Образование гемоглобина
3. Связывание гемоглобина с кислородом. Обмен железа
4. Всасывание железа в кишечнике. Длительность жизни эритроцитов
5. Разрушение гемоглобина. Разновидности анемий
6. Влияние анемии на кровообращение. Полицитемия — эритремия
7. Влияние полицитемии на кровообращение. Лейкоциты — белые клетки крови
8. Типы белых клеток крови. Происхождение белых клеток крови
9. Длительность жизни белых клеток крови. Нейтрофилы и макрофаги
10. Фагоцитоз. Механизмы и значение фагоцитоза
Источник
Анемия вследствие повышенного разрушения эритроцитов
Главная
Анемия вследствие повышенного разрушения эритроцитов
В норме эритроциты живут и функционируют приблизительно 120 дней. Затем макрофаги в костном мозге, селезенке и печени обнаруживают и уничтожают их. Если в результате болезни эритроциты разрушаются преждевременно (гемолиз), то костный мозг компенсирует это, усиленно вырабатывая новые эритроциты — иногда его работа ускоряется в 10 раз. Когда разрушение эритроцитов превышает их выработку, развивается гемолитическая анемия. Гемолитические анемии встречаются относительно редко по сравнению с анемиями вследствие кровопотери или снижения выработки эритроцитов. |
Симптомы гемолитической анемии подобны симптомам других форм анемии. Иногда гемолиз возникает внезапно и бывает очень тяжелым, приводя к гемолитическому кризу: появляются озноб, повышение температуры тела, боль в спине и животе, головокружение, снижается артериальное давление, возникает желтуха, моча приобретает темную окраску. Увеличивается селезенка, поскольку она отфильтровывает фрагменты поврежденных эритроцитов; увеличение селезенки иногда сопровождается болью в животе. Длительный гемолиз может сопровождаться формированием пигментных желчных камней, состоящих из темноокрашенного содержимого эритроцитов. |
Повышенное разрушение эритроцитов может быть обусловлено множеством факторов, в том числе увеличением селезенки (спленомегалией). Эритроциты могут механически повреждаться из-за каких-то препятствий в кровотоке. Эритроциты могут быть атакованы антителами собственной иммунной системы в результате аутоиммунной реакции. Иногда эритроциты разрушаются из-за аномалии в них самих — патологических изменений формы и поверхностной структуры, нарушения функции или аномалии гемоглобина. Разрушение эритроцитов усиливается при таких заболеваниях, как системная красная волчанка и некоторые злокачественные опухоли, особенно лимфомы. Прием различных лекарств, например содержащих серу, может также приводить к повреждению эритроцитов. |
Гемолитическая анемия можно заподозрить при осмотре пациента и после общего анализа крови (умеренное снижение содержания гемоглобина и эритроцитов, цветовой показатель — в норме). При миелографии (исследовании костного мозга) выявляется значительное усиление кроветворения. Уровень билирубина в крови повышен, повышено содержание уробилина в моче и стеркобилина в кале. Уровень железа в крови повышен. Обязательно проводится УЗИ брюшной полости для определения размеров печени и селезенки. При гемолитической анемии селезенка увеличивается. |
Лечение гемолитической анемии зависит от ее причины. При аутоиммунной гемолитической анемии назначают стероидные гормоны (глюкокортикоиды), иммунодепрессанты, в тяжелых случаях применяются цитостатики. Приобретенная гемолитическая анемия (например, при отравлении) лечится устранением причины, приведшей к развитию заболевания. Любая гемолитическая анемия может потребовать симптоматического лечения в виде переливания эритроцитарной массы (при уровне гемоглобина ниже 50 г/л или предобморочном состоянии больного). Эффективным методом лечения является удаление селезенки — спленэктомия. |
Источник
ГЕМОЛИЗ
ГЕМОЛИЗ (греч, haima кровь + lysis разрушение, растворение; син.: гематолиз, эритроцитолиз) — процесс разрушения эритроцитов, при к-ром гемоглобин выходит из них в плазму. Однако имеются данные [Пранкерд (Т. A. Prankerd), 1961] о том, что нарушение целости эритроцитов при Гемолизе не обязательно и что процесс может ограничиваться и функциональными изменениями эритроцитов с растяжением мембраны клетки и изменением ее проницаемости.
Кровь после Гемолиза эритроцитов (Гемолизированная кровь) представляет собой прозрачную жидкость красного цвета (лаковая кровь).
Следует различать Гемолиз в условиях организма и in vitro.
В условиях организма Гемолиз имеет место и в норме. Это так наз. физиологический гемолиз, происходящий вследствие естественного старения эритроцитов. Гемолиз как патологическое явление может возникнуть под влиянием ряда факторов: переливания несовместимой крови, инфузии гипотонических р-ров, действия гемолитических ядов (см.), гемотоксинов (см.); вследствие наследственной недостаточности ферментных систем в эритроцитах (см. Энзимопеническая анемия); при наличии в эритроцитах аномальных гемоглобинов (см. Гемоглобинопатии), обусловленных как аномалией первичной структуры молекулы гемоглобина (см. Серповидноклеточная анемия), так и нарушением синтеза полипептидных цепей гемоглобинов (см. Талассемия); при возникновении антител к эритроцитам (см. Гемолитическая анемия, иммунные гемолитические анемии; Гемолитическая болезнь новорожденных; Переливание крови, посттрансфузионная анемия); под влиянием некоторых лекарственных препаратов. При некоторых заболеваниях в сыворотке крови обнаруживают «аутогемолизины», образующиеся в ответ на иммунизирующее действие продуктов денатурации и распада тканей (при лучевой болезни или опухолевых процессах).
Г. как биофиз, процесс изучают in vitro, поскольку in vivo невозможно проследить детально разрушение эритроцита. Кроме того, изучение механизма Г. необходимо и с целью предотвращения его при исследованиях продолжительности жизни эритроцитов, в условиях хранения консервированной крови и эритроцитарной массы, при постановке реакции связывания комплемента и других тестах, проводимых с кровью или эритроцитами.
Мембрана эритроцита состоит из бимолекулярного слоя липидов с монослоями белка с обеих сторон. Липидные молекулы лежат параллельно друг другу, но перпендикулярно плоскости мембраны, причем полярные головки фосфолипидов направлены наружу, а длинные углеводородные цепи — к центру мембраны. На полярных головках адсорбированы белковые цепочки. Предполагают, что взаимодействие белка и фосфолипидов обеспечивается электростатическими силами и силами Ван-дер-Ваальса (см. Молекула). Длина липидных молекул равна примерно 30 А, или 3 нм [Фрик (H. Fricke), 1935], толщина монослоя белка не превышает 1 нм, толщина клеточной мембраны ок. 8 нм [Даниэлли и Давсон (J. F. Danielli, H. Davson), 1952]. По данным О’Брайена (J. S. O’Brien, 1967), в мембране эритроцитов человека содержатся холестерин, фосфатидилсерин, сфингомиелин, цереброзиды и другие липиды. Вода и мелкие ионы диффундируют через мембрану с большой скоростью через специальные поры диам. 0,3-0,4 нм. Эти поры непроходимы для ионов кальция и магния, для сахаров и тем более для крупномолекулярных коллоидов. Время полуобмена воды через мембрану равно 0,004 сек., для аниона хлора — 0,2 сек., а для катионов значительно больше: для катиона калия ок. 30 час., для катиона натрия ок. 20 час. [Джандл (J. Jandl), 1965].
Г. in vitro можно вызвать физ. воздействиями на эритроциты, хим. агентами, гемолитическими ядами растительного, животного и бактериального происхождения, добавлением сыворотки крови животных, не иммунизированных к эритроцитам.
Физическими воздействиями являются нагревание или повторное замораживание и оттаивание взвеси эритроцитов или крови (термический Г.), помещение эритроцитов в гипотонический р-р или в другую среду, способствующую повышению осмотического давления внутренней среды эритроцитов (осмотический Г.), лучистая энергия, ультразвук, электрическая энергия. При этом Г. может быть полным или неполным, с большими или меньшими изменениями и повреждениями эритроцитов.
Нагревание взвеси эритроцитов до t° 49° ведет к набуханию их, а при t° 62-63°- к их распаду с выделением гемоглобина; часть фрагментов эритроцитов сохраняет гемоглобин. Г. при повторном замораживании и оттаивании эритроцитов происходит вследствие механического травмирования их кусочками льда и повышения концентрации веществ внутри эритроцита.
Механизм осмотического Г. заключается в проникновении воды в эритроцит (объем его увеличивается, а оболочка растягивается). При растягивании оболочки эритроцита водой расширяются поры, через которые выходят молекулы гемоглобина. По данным Давсона (1940), выходу гемоглобина предшествует увеличение проницаемости оболочки эритроцита для ионов калия. При полном Г. гемоглобин эритроцитов почти полностью выделяется в плазму. При этом сначала освобождается свободный гемоглобин, а затем расщепляется гемоглобин, лабильно связанный с фосфатидами; часть гемоглобина остается прочно связанной со стромой (С. И. Афонский, 1947); стромы эритроцитов имеют вид так наз. теней.
Объем эритроцита, при к-ром начинается Г., называют критическим объемом эритроцита; у разных видов животных он различен. Для эритроцитов человека критический объем составляет 146% первоначального объема, для эритроцитов барана — 126%, для эритроцитов кролика — 137%.
Аналогичен механизм осмотического Г. при помещении эритроцитов в изотонические р-ры мочевины, глюкозы, глицерина и др. При применении уретанового и алкогольного наркоза уменьшается проницаемость оболочки эритроцита для воды, калия и гемоглобина и происходит замедление осмотического Г.
Осмотический Г. эритроцитов исследуют в клин, практике при различных заболеваниях в виде пробы на устойчивость (резистентность) эритроцитов к гипотоническим р-рам хлорида натрия. Концентрацию хлорида натрия, при к-рой начинается осмотический Г., принимают за показатель минимальной осмотической резистентности эритроцитов. Концентрацию, при к-рой происходит полный Г., считают показателем максимальной резистентности эритроцитов. Эритроциты здорового человека начинают гемолизироваться в 0,44-0, 48% р-ре хлорида натрия и полностью гемолизируются в 0,28- 0,32% р-ре.
Интенсивность Г. под воздействием лучистой энергии зависит от длины волны, причем кривая действия света на процесс Г. параллельна кривой адсорбции гемоглобина. В присутствии небольших количеств фотосенсибилизаторов (эозина, флюоресцеина, эритрозина, гематопорфирина и др.) гемолитическое действие лучистой энергии усиливается. Полагают, что краски-фотосенсибилизаторы адсорбируются только определенными участками поверхности эритроцита, где под влиянием лучистой энергии возникают поры для выхода гемоглобина в плазму.
Ультразвук повреждает эритроциты в результате разности давлений в звуковом поле. При небольшой энергии ультразвука эритроциты деформируются, оболочка их становится пористой; при более сильной энергии — разрушается структура эритроцита.
Под влиянием постоянного электрического тока из эритроцита выделяется гемоглобин, существенно разрушается строма эритроцита (строматолиз). Переменный ток не разрушает эритроциты.
Среди химических агентов гемолитическое действие оказывают нитриты, нитробензол, нитроглицерин, эфир, бензол, олеиновокислый натрий, холево- и дезоксихолевокислый натрий, соединения анилина, сапонин, л изо лецитин и др. Подавляющее большинство хим. гемолитических агентов вызывает прямое повреждение структуры мембран эритроцитов, нарушая расположение молекул липидов в ней, с образованием пор. Хамфри (J. Humphrey) с сотр. (1969) описал гексагонально расположенные поры диам. 8-10 нм при воздействии на эритроциты сапонином; после Г. стрептолизином О, фосфолипазой С были обнаружены дефекты (поры) диаметром до 40- 50 нм. Д. Л. Рубинштейн и Р. А. Рутберг (1948) установили, что под влиянием хим. гемолитических средств сначала распадаются соединения гемоглобина с липопротеидными комплексами эритроцита. Олеиновокислый натрий или желчные к-ты вызывают Г., повреждая мембраны эритроцита, растворяя ее лецитин. Повреждаются и более глубокие части стромы с освобождением связанного с ней гемоглобина. Гемолитическое действие сапонина обусловлено повреждением эритроцита путем соединения его с холестерином эритроцита: прибавление холестерина в среду с сапонином сдерживает гемолитическое действие последнего.
Гемолитическим действием обладают яды глистов, насекомых (пчел, паука каракурта, скорпиона), змей. Механизм гемолитического действия ядов животных связан, по-видимому, с изменением структуры липоидного компонента мембраны эритроцитов и сходен с действием фермента лецитиназы. Лецитиназной активностью обладают гемолизины многих бактериальных токсинов (тетанолизин, стафилолизин, стрептолизин О и S и др.).
Г. под действием нормальных гемолизинов, содержащихся в сыворотке крови неиммунизированных млекопитающих одного вида по отношению к эритроцитам животных другого вида, связан с первичной токсичностью этих сывороток для организма соответствующих видов животных. Однако полного соответствия между гемолитической активностью и токсичностью чужеродных сывороток не выявлено. Существенное место в механизме Г. от воздействия чужеродных сывороток занимают процессы ферментативного разрушения липопротеидных комплексов мембраны эритроцита. В результате растворения части липидов первично повреждается поверхность эритроцита, коллоидно-осмотические силы ведут к разбуханию эритроцита, далее — аналогично помещению эритроцита в гипотоническую среду.
Под влиянием гемолизинов, специфических антител, способных соединяться только с эритроцитами иммунизированного животного, возникает иммунный гемолиз. Иммунный гемолизин (см. Амбоцептор) представляет собой антитело, обнаруживающееся в гамма-глобулиновой фракции сыворотки крови, в IgG- и IgM-фракциях. Гемолизины присоединяют комплемент к эритроциту: для растворения одного эритроцита нужно 30-50 молекул гемолизина и 25 000 молекул комплемента. Действующим агентом в механизме специфического Г. является именно комплемент (см.), а гемолизин играет только роль связующего звена между комплементом и эритроцитом.
Сравнительно небольшое количество гемолизина, потребляемого в процессе специфического иммунного Г., объясняется, по-видимому, локальным повреждением эритроцита комплементом. Бруниус (F. Brunius, 1936) рассчитал, что при специфическом Г. гемолизины покрывают только 0,001% поверхности эритроцита.
При воздействии комплемента на сенсибилизированный эритроцит из клетки через поврежденную клеточную мембрану проходят ионы калия, фосфаты и рибонуклеотиды. Нарушение ионного баланса сопровождается поступлением воды в клетку и разбуханием ее, а также уменьшением клеточной поверхности и достижением критического гемолитического объема. Дальнейшее растяжение мембраны и увеличение ее пор способствуют выходу гемоглобина из эритроцита. Чтобы через мембрану могли проходить белковые молекулы, диаметр пор должен быть не менее 6 нм. Часто образуются множественные поры, которые затем могут сливаться и способствовать разрыву мембраны и разрушению эритроцита. Образование многочисленных пор, по мнению Хамфри, зависит от избытка комплемента.
При иммунизации животного сывороткой крови, содержащей иммунный гемолизин, в организме образуются антитела — антигемолизины, специфически соединяющиеся с гемолизинами и, т. о., препятствующие их соединению с эритроцитом, в результате чего специфический Г. затормаживается.
Различают следующие стадии Г.: прегемолитическую (увеличение проницаемости оболочки эритроцита), гемоглобинолиз (распад гемоглобина), собственно гемолиз (выделение гемоглобина), строматолиз (разрушение стромы). При иммунном Г. различают еще три стадии — сенсибилизации, повреждающего действия комплемента и диффузии гемоглобина из эритроцита.
См. также Эритроциты.
Библиография: Афонский С. И. К вопросу о химическом составе и свойствах стромы эритроцитов лошади, Учен. зап. Казанск. вет. ин-та, т. 55, с. 20, 1947; Идельсон Л. И., Дидковский Н. А. и Ермильченко Г. В. Гемолитические анемии, М., 1975, библиогр.;
Кэбот Е. и Мейер М. Экспериментальная иммунохимия, пер. с англ., М., 1968;
Лорие Ю. И. Аутоиммунные гемопатии, Тер. арх., т. 39, № 2, с. 10, 1967, библиогр.; Поликар А. Молекулярная цитология мембран животной клетки и ее микроокружение, пер. с франц., Новосибирск, 1975; Рубинштейн Д. Л. и Рутберг Р. А. Отщепление гемоглобина при химическом гемолизе, Биохимия, т. 13, № 2, с. 147, 1948; Blood and its disorders, ed. by R. Ж. Hardisty a. D. J. Weatherall, Oxford, 1974; O’Brien J. S. Cell membra-nes-composition, structure , J. theor. Biol., v. 15, p. 307, 1967, bibliogr.; The cell surface, ed. by B. D. Kahan a. R. A. Reisfeld, N. Y.-L., 1974; Cooper R. A. a. Shallil S. Y. The red cell mebrane in hemolytic anemia, в кн.: Modern treatment, ed. by L. S. Lessin a. W. F. Rosse, y. 8, p. 329, N. Y., 1971, bibliogr.; Davson H. a. Daniel li J. F. Permeability or natural membranes, L., 1952; Erythrocytes, thrombocytes, leukocytes, ed. by E. Gerlach a. o., Stuttgart, 1973; Humhrey J. H. a. Dourmashkin R. R. The lesions in cell membranes caused by complement, в кн.: Advanc, in immunol., ed. by F. J. Dixon, a. H. G. Kunkel, v, 11, p. 75, N. Y.- L., 1969, bibliogr.; Ponder E. Red cell structure and its breakdown, Wien, 1955, bibliogr.; Red cell shape, physiology, pathology, ultrastructure, ed. by M. Bessis a. o., N. Y. a. o., 1973; Shohet S. B. Hemolysis and changes in erythrocyte membrane lipids, New Engl. J. Med., v. 286, p. 577, p. 638, 1972, bibliogr.
Л. М. Ишимова.
Источник
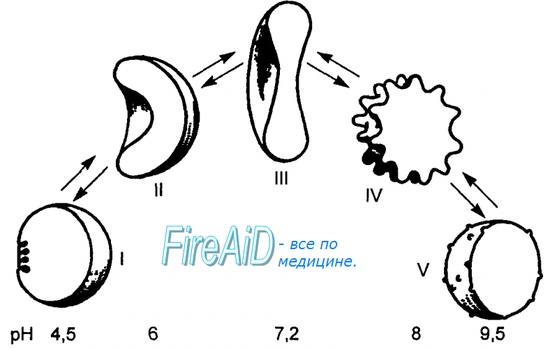 Рис. 7.3. Схема формирования эхиноцитов и стоматоцитов из дискоцита (нормоцита) при разных значениях рН, создаваемых in vitro. I — сферостоматоцит, II — стоматоцит, III — дискоцит, IV — эхиноцит, V — сфероэхиноцит.
Рис. 7.3. Схема формирования эхиноцитов и стоматоцитов из дискоцита (нормоцита) при разных значениях рН, создаваемых in vitro. I — сферостоматоцит, II — стоматоцит, III — дискоцит, IV — эхиноцит, V — сфероэхиноцит.