Регуляция связывания кислорода с гемоглобином в тканях
Содержание статьи
Эффективность связывания кислорода с гемоглобином регулируется
Кооперативное взаимодействие
Взаимовлияние протомеров олигомерного белка друг на друга называется кооперативное взаимодействие.
В легких такое взаимодействие субъединиц гемоглобина повышает его сродство к кислороду и ускоряет присоединение кислорода в 300 раз. В тканях идет обратный процесс, сродство снижается и ускорение отдачи кислорода также 300-кратное.
Схема кооперативного взаимодействия субъединиц гемоглобина
Объясняется такой феномен тем, что в легких при присоединении первой молекулы кислорода к железу (за счет 6-й координационной связи) атом железа втягивается в плоскость гема, кислород остается вне плоскости. Это вызывает перемещение участка белковой цепи и изменение конформации первого протомера. Такой измененный протомер влияет на другие субъединицы и облегчает связывание кислорода со второй субъединицей. Это меняет конформацию второй субъединицы, облегчая присоединение последующих молекул кислорода и изменение других протомеров.
Изменение формы субъединиц гемоглобина
при присоединении и отщеплении кислорода
Дезоксиформа гемоглобина обозначается как Т-форма, напряженная (англ. tense), она обладает существенно более низким сродством к кислороду. Оксигенированная форма, или R-форма (англ. relaxed), обладает высоким сродством к кислороду.
Изменение рН среды
Влияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании — повышается.
При повышении концентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина. В легких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н+ из гемоглобина.
Реакция взаимодействия кислорода с гемоглобином упрощенно имеет вид:
Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H+ и О2 обусловлено конформационными перестройками глобиновой части молекулы. В тканях молекула О2 отрывается от железа и ионы водорода присоединяются к остаткам гистидина (глобиновой части), образуя восстановленный гемоглобин (H-Hb) с низким сродством к кислороду. В легких поступающий в больших количествах кислород «вытесняет» ион водорода из связи с остатком гистидина гемоглобиновой молекулы.
Механизм эффекта Бора
Роль 2,3-дифосфоглицерата
2,3-Дифосфоглицерат образуется в эритроцитах из 1,3-дифосфоглицерата, промежуточного метаболита гликолиза, в реакциях, получивших название шунт Раппопорта.
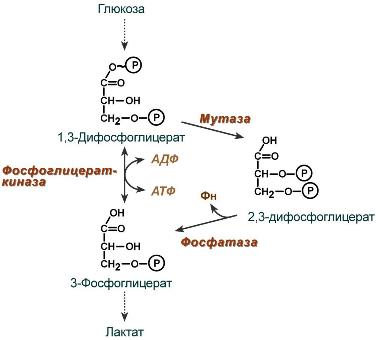
Реакции шунта Раппопорта
2,3-Дифосфоглицерат располагается в центральной полости тетрамера дезоксигемоглобина и связывается с β-цепями, образуя поперечный солевой мостик между атомами кислорода 2,3-дифосфоглицерата и аминогруппами концевого валина обеих β-цепей, также аминогруппами радикалов лизина и гистидина.
Расположение 2,3-дифосфоглицерата в гемоглобине
Функция 2,3-дифосфоглицерата заключается в снижении сродства гемоглобина к кислороду, что имеет особенное значение при подъеме на высоту и при нехватке кислорода во вдыхаемом воздухе. В этих условиях связывание кислорода с гемоглобином в легких не нарушается, так как концентрация его относительно высока. Однако в тканях за счет 2,3-дифосфоглицерата отдача кислорода возрастает в 2 раза.
Источник
Эффект Вериго — Бора
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 10 июля 2013; проверки требуют 29 правок.
Эффект Вериго — Бора (синонимы — эффект Вериго, эффект Бора) — зависимость степени диссоциации оксигемоглобина от величины парциального давления углекислоты в альвеолярном воздухе и крови, при снижении которого сродство кислорода к гемоглобину повышается, что затрудняет переход кислорода из капилляров в ткани. Эффект этот был открыт независимо друг от друга Б. Ф. Вериго в 1892 году[1] и датским физиологом К. Бором в 1904 году[2].
История открытия[править | править код]
Основу разработки проблемы гипоксии заложил русский учёный-физиолог И. М. Сеченов фундаментальными работами по физиологии дыхания и газообменной функции крови. Большое значение имеют также исследования русского физиолога Б. Ф. Вериго по физиологии газообмена в лёгких и тканях. Опираясь на идеи Сеченова о сложных формах взаимодействия между диоксидом углерода и кислородом в крови (Вериго работал в лабораториях Сеченова, И. Р. Тарханова и И. И. Мечникова), он впервые установил зависимость степени диссоциации оксигемоглобина от величины парциального давления углекислоты в крови.
Биохимический механизм[править | править код]
Эффект Вериго — Бора: влияние pH на кривую насыщения гемоглобина кислородом
В клетках периферических тканей органическое топливо окисляется в митохондриях с использованием кислорода (клеточное дыхание), доставляемого гемоглобином из лёгких; при этом в качестве продуктов образуются углекислый газ, вода и другие соединения. Образование углекислого газа в тканях одновременно приводит и к повышению концентрации ионов H+ (то есть к понижению pH), поскольку при гидратации CO2 образуется H2CO3 — слабая угольная кислота, диссоциирующая на ионы H+ и бикарбонат-ионы:
H2CO3 ⇄ H+ + HCO3-.
Гемоглобин переносит значительную долю (около 20 %) общего количества CO2 и ионов H+, образующихся в тканях и поступающих в лёгкие и почки, обеспечивающих выделение этих продуктов.
За много лет до открытия этого механизма было обнаружено, что на связывание кислорода гемоглобином очень сильное влияние оказывает pH и концентрация CO2: при присоединении CO2 и ионов H+ способность гемоглобина связывать O2 снижается. Действительно, в периферических тканях с относительно низким значением pH и высокой концентрацией CO2 сродство гемоглобина к кислороду падает. И наоборот, в лёгочных капиллярах выделение CO2 и сопутствующее ему повышение pH крови приводит к увеличению сродства гемоглобина к кислороду. Это влияние величины pH и концентрации CO2 на связывание и освобождение O2 гемоглобином и называют эффектом Вериго — Бора.
Реакция связывания кислорода гемоглобином в виде
Hb + O2 ⇄ HbO2
в действительности отражает неполную картину, поскольку не учитывает дополнительные лиганды H+ и CO2.
Чтобы объяснить влияние концентрации ионов H+ на связывание кислорода, следует записать эту реакцию в иной форме:
HHb+ + O2 ⇄ HbO2 + H+,
где HHb+ — протонированная форма гемоглобина. Из этого уравнения следует, что кривая насыщения гемоглобина кислородом зависит от концентрации ионов H+. Гемоглобин связывает и O2, и ионы H+, но между этими двумя процессами существует обратная зависимость. Если парциальное давление кислорода велико (что наблюдается, например, в лёгких), то гемоглобин связывает его, освобождая при этом ионы H+. При низком парциальном давлении кислорода (что имеет место в тканях) связываться с гемоглобином будут ионы H+.
Эффективность связывания гемоглобином углекислого газа (с образованием карбаминогемоглобина, чаще именуемого карбгемоглобином[3]) находится в обратной зависимости от связывания кислорода. В тканях часть избыточного CO2 связывается с гемоглобином, сродство последнего к O2 снижается, и происходит высвобождение кислорода. В лёгких же связывается избыток O2 воздуха, тем самым сродство гемоглобина к CO2 уменьшается, и CO2 выделяется в альвеолярный воздух, способствуя лёгкому закислению крови за счёт ионов H+, возникающих при диссоциации угольной кислоты (см. выше).
Описанные зависимости делают молекулу гемоглобина великолепно приспособленной к осуществлению совместного переноса эритроцитами кислорода, углекислого газа и ионов H+[4].
См. также[править | править код]
- Эффект Холдейна (открыт Джоном Скоттом Холдейном)
Примечания[править | править код]
- ↑ Verigo B. F. Zur Frage über die Wirkung des Sauerstoff auf die Kohlensäureausscheidung in den Lungen // Archiv für die gesammte Physiologie des Menschen und der Thiere : статья. — 1892. — № 51. — С. 321-361.
- ↑ Chr. Bohr, K. Hasselbalch, and August Krogh. Concerning a Biologically Important Relationship — The Influence of the Carbon Dioxide Content of Blood on its Oxygen Binding // Skand. Arch. Physiol. : статья. — 1904. — № 16. — С. 401-412.
- ↑ Карбгемоглобин // Биологический энциклопедический словарь.
- ↑ Ленинджер А. Основы биохимии: В 3-х томах. Том 1. — М.: Мир, 1985. — С. 208-210. — 367 с.
Литература[править | править код]
- Вериго эффект // Большой медицинский словарь. — 2000.
Источник
Связывание кислорода гемоглобином
Кислородная емкость крови. Большая часть кислорода переносится кровью в виде химического соединения с гемоглобином. Для того чтобы узнать, какое наибольшее количество О2; может быть связано гемоглобином, следует иметь в виду, что молекула последнего состоит из четырех субъединиц. Следовательно, реакцию оксигенации можно записать следующим образом Нb+4О2 Нb(О2)4.
Таким образом, 1 моль гемоглобина может связать до 4 моль О2. Поскольку объем 1 моль идеального газа составляет 22,4 л, 64 500 г гемоглобина связывают 4·22,4 л О2, а 1 г гемоглобина ―1,39 мл О2. При анализе газового состава крови получают несколько меньшую величину (1,34-1,36 мл О2 на 1 г Hb). Это обусловлено тем, что небольшая часть гемоглобина находится в неактивном состоянии. Таким образом, ориентировочно можно считать, что in vivo 1г Hb связывает 1,34 мл О2 (так называемое число Хюфнера).
Исходя из числа Хюфнера, можно, зная содержание гемоглобина, вычислить кислородную емкость крови: [О2] макс = (1,34 мл О2 на 1 г Hb)·(150 г Hb на 1 л крови) = 0,2 л О2 на 1 л крови. Однако такое содержание кислорода в крови может достигаться лишь в том случае, если кровь контактирует с газовой смесью, насыщенной кислородом (РО2 > 300 мм рт.ст.); при этом равновесие значительно сдвинуто вправо. В естественных условиях эта реакция протекает при меньшем значении парциального давления О2, поэтому гемоглобин оксигенируется не полностью.
Кривая диссоциации оксигемоглобина.
Реакция взаимодействия кислорода с гемоглобином подчиняется закону действующих масс. Это означает, что соотношение между количествами гемоглобина и оксигемоглобина зависит от содержания физически растворенного О2 в крови; последнее же, согласно закону Генри-Дальтона, пропорционально напряжению О2. Процент оксигемоглобина от общего содержания гемоглобина называют кислородным насыщением (SО2) гемоглобина. Если гемоглобин полностью дезоксигенирован, то SО2 = 0%; если же весь гемоглобин превратился в оксигемоглобин, то SО2 = 100%. В соответствии с законом действующих масс насыщение гемоглобина кислородом зависит от напряжения О2. Графически эту зависимость отражает так называемая кривая диссоциации оксигемоглобина. Эта кривая имеет S-образную форму. Расположение кривой диссоциации оксигемоглобина зависит от ряда факторов (см. ниже). Наиболее простым показателем, характеризующим расположение этой кривой, служит так называемое напряжение полунасыщения (50%), т.е. такое напряжение О2, при котором насыщение гемоглобина кислородом составляет 50%. В норме (при рН=7,4 и t=37°C) полунасыщение артериальной крови составляет около 26 мм рт.ст. (3,46 кПа).
Причины S-образной формы кривой диссоциации оксигемоглобина до конца не ясны. Если бы каждая молекула гемоглобина присоединяла только одну молекулу О2, то кинетика этой реакции графически описывалась бы гиперболой. Именно такая гиперболическая кривая диссоциации характерна, например, для реакции соединения кислорода с красным мышечным пигментом миоглобином, аналогичной реакции оксигенации гемоглобина. Строение миоглобина сходно со структурой одной из четырех субъединиц гемоглобина, поэтому молекулярные массы этих двух веществ соотносятся как 1:4. Поскольку в состав миоглобина входит лишь одна пигментная группа, одна молекула миоглобина может присоединить только одну молекулу О2. Исходя из вполне правдоподобного предположения о том, что S-образная форма кривой диссоциации НbО2 обусловлена связыванием одной молекулой гемоглобина четырех молекул О2, Эдер выдвинул так называемую гипотезу промежуточных соединений. Согласно этой гипотезе, присоединение четырех молекул О2 к гемоглобину происходит в несколько стадий, причем каждая из этих стадий влияет на равновесие следующей реакции. Таким образом, реакция соединения кислорода с гемоглобином описывается четырьмя константами равновесия, что и объясняет сигмоидную форму кривой диссоциации оксигемоглобина.
В то же время возможно и другое объяснение, согласно которому существуют две формы гемоглобина-оксигенированная и дезоксигенированная, переходящие одна в другую в результате конформационных перестроек. Если предположить, что параметры равновесия реакций оксигенации для этих двух форм гемоглобина различны, то с позиции данной гипотезы можно объяснить S-образную форму кривой диссоциации НbО2
Биологический смысл формы кривой диссоциации оксигемоглобина. Конфигурация кривой диссоциации оксигемоглобина имеет важное значение с точки зрения переноса кислорода кровью. В процессе поглощения кислорода в легких напряжение О2 в крови приближается к таковому в альвеолах. У молодых людей РО2 артериальной крови составляет около 95 мм рт.ст. (12,6 кПа). При таком напряжении насыщение гемоглобина кислородом составляет примерно 97%. С возрастом (и в еще большей степени при заболеваниях легких) напряжение О2 в артериальной крови может значительно снижаться, однако, поскольку кривая диссоциации оксигемоглобина в правой ее части почти горизонтальна, насыщение крови кислородом уменьшается ненамного. Так, даже при падении РО2 в артериальной крови до 60 мм рт.ст. (8,0 кПа) насыщение гемоглобина кислородом равно 90%. Таким образом, благодаря тому, что области высоких напряжений кислорода соответствует горизонтальный участок кривой диссоциации оксигемоглобина, предупреждается cyщественное снижение насыщения артериальной крови кислородом.
Крутой наклон среднего участка кривой диссоциации оксигемоглобина свидетельствует об очень благоприятных условиях для отдачи кислорода тканям. При изменении локальной потребности в кислороде он должен высвобождаться в достаточном количестве в отсутствие значительных сдвигов РО2 в артериальной крови. В состоянии покоя РО2 в области венозного конца капилляра равно приблизительно 40 мм рт.ст. (5,3 кПа), что соответствует примерно 73% насыщения. Если в результате увеличения потребления кислорода его напряжение в венозной крови падает лишь на 5 мм рт.ст. (0,7 кПа), то насыщение гемоглобина кислородом снижается не менее чем на 7%; высвобождающийся при этом О2 может быть сразу же использован для процессов метаболизма.
Количество химически связанного кислорода в крови зависит от насыщения им гемоглобина.
При прохождении крови через тканевые капилляры используется лишь 25% общей кислородной емкости. Разумеется, разные органы существенно различаются по степени извлечения кислорода. При интенсивной физической нагрузке артериовенозная разница по кислороду может превышать 0,1.
Соседние файлы в папке тексты лекций по физе
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
3. Связывание гемоглобина с о2 в лёгких и его диссоциация из комплекта в тканях
Основная функция гемоглобина — доставка О2 от лёгких к тканям. Олигомерная структура гемоглобина обеспечивает быстрое насыщение его кислородом в лёгких (образование оксигемоглобина — Нb(О2)4), возможность отщепления кислорода от гемоглобина в капиллярах тканей при относительно высоком парциальном давлении О2, а также возможность регуляции сродства гемоглобина к О2 в зависимости от потребностей тканей в кислороде.
Кооперативные изменения конформации протомеров
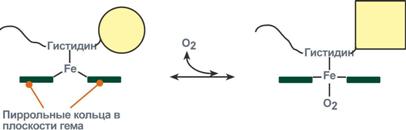
О2 связывается с протомерами гемоглобина через Fe2+ , который соединён с четырьмя атомами азота пиррольных колец тема и атомом азота
Рис. 1-32. Строение гемоглобина.
Гис F8 белковой части протомера. Связывание О2 с оставшейся свободной координационной связью Fe2+ происходит по другую сторону от плоскости гема в области Гис Е7 (аналогично тому, как это происходит у миоглобина). Гис Е7 не взаимодействует с О2, но обеспечивает оптимальные условия для его связывания (рис. 1-33).
В дезоксигемоглобине благодаря ковалентной связи с белковой частью атом Fe2+ выступает из плоскости гема в направлении Гис F8. Присоединение О2 к атому Fe2+ одного протомера вызывает его перемещение в плоскость гема, за ним перемещаются остаток Гис F8 и полипептидная цепь, в состав которой он входит. Так как протомер связан с остальными протомерами, а белки обладают конформационной лабильностью, происходит изменение конформации всего белка. Конформационные изменения, произошедшие в других протомерах, облегчают присоединение следующей молекулы О2, что вызывает новые конформационные изменения в белке и ускорение связывания следующей молекулы О2. Четвёртая молекула О2 присоединяется к гемоглобину в 300 раз легче, чем первая молекула (рис. 1-34).
Рис. 1-33. Изменение прложения Fe2+ и белковой части гемоглобина при присоединении О2.
Рис. 1-34. Кооперативные изменения конформации протомеров гемоглобина при присоединении О2.
Изменение конформации (а следовательно и функциональных свойств) всех протомеров олигомерного белка при присоединении лиганда только к одному из них носит название кооперативных изменений конформации протомеров.
Аналогичным образом в тканях диссоциация каждой молекулы О2 изменяет конформацию всех протомеров и облегчает отщепление последующих молекул О2.
Кривые диссоциации О2 для миоглобина и гемоглобина
Кооперативность в работе протомеров гемоглобина можно наблюдать и на кривых диссоциации О2 для миоглобина и гемоглобина (рис. 1-35).
Отношение занятых О2 участков связывания белка к общему числу таких участков, способных к связыванию, называется степенью насыщения этих белков кислородом. Кривые диссоциации показывают, насколько насыщены данные белки О2 при различных значениях парциального давления кислорода.
Кривая диссоциации О2 для миоглобина имеет вид простой гиперболы. Это указывает на то, что миоглобин обратимо связывается с лигандом, и на это не оказывают влияние никакие посторонние факторы (схема ниже).
Схема
Рис. 1-35. Кривые диссоциации кислорода для миоглобина и гемоглобина в зависимости от парциального давления кислорода.
Процессы образования и распада оксимиоглобина находятся в равновесии, и это равновесие смещается влево или вправо в зависимости от того, добавляется или удаляется кислород из системы. Миоглобин связывает кислород, который в капиллярах тканей высвобождает гемоглобин, и сам миоглобин может освобождать О2 в ответ на возрастание потребностей в нём мышечной ткани и при интенсивном использовании О2 в результате физической нагрузки.
Миоглобин имеет очень высокое сродство к О2. Даже при парциальном давлении О2, равном 1-2 мм рт. ст., миоглобин остаётся связанным с О2 на 50%.
Кривая диссоциации О2 для гемоглобина. Из графика на рис. 1-35 видно, что гемоглобин имеет значительно более низкое сродство к О2; полунасыщение гемоглобина О2 наступает при более высоком давлении О2 (около 26 мм рт. ст.).
Кривая диссоциации для гемоглобина имеет сигмоидную форму (S-образную). Это указывает на то, что протомеры гемоглобина работают кооперативно: чем больше О2 отдают протомеры, тем легче идёт отщепление последующих молекул О2.
В капиллярах покоящихся мышц, где давление О2 составляет около 40 мм рт. ст., большая часть кислорода возвращается в составе оксигемоглобина обратно в лёгкие. При физической работе давление О2 в капиллярах мышц падает до 10-20 мм рт. ст. Именно в этой области (от 10 до 40 мм рт. ст.) располагается «крутая часть» S-образной кривой, где в наибольшей степени проявляется свойство кооперативной работы протомеров.
Следовательно, благодаря уникальной структуре каждый из рассмотренных белков приспособлен выполнять свою функцию: миоглобин — присоединять О2, высвобождаемый гемоглобином, накапливать в клетке и отдавать в случае крайней необходимости; гемоглобин — присоединять О2 в лёгких, где его насыщение доходит до 100%, и отдавать О2 в капиллярах тканей в зависимости от изменения в них давления О2
4. Перенос Н+ и С02 из тканей в лёгкие с помощью гемоглобина. Эффект Бора
Окисление органических веществ с целью получения энергии происходит в митохондриях клеток с использованием О2, доставляемого гемоглобином из лёгких. В результате окисления веществ образуются конечные продукты распада — СО2 и Н2О, количество которых пропорционально интенсивности процессов окисления. СО2, образовавшийся в тканях, транспортируется в эритроциты. Там под действием фермента карбангидразы происходит увеличение скорости образования Н2СО3. Слабая угольная кислота может диссоциировать на Н+ и НСО3-
СО2 + Н2О — H2CO 3 — H+ + HCO3-.
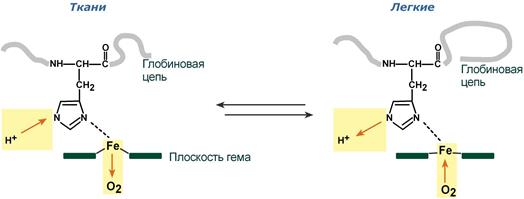
Равновесие реакции в эритроцитах, находящихся в капиллярах тканей, смещается вправо, так как образующиеся в результате диссоциации угольной кислоты протоны могут присоединяться к специфическим участкам молекулы гемоглобина: к радикалам Гис146 двух ?-цепей, радикалам Гис122 и концевым ?-аминогруппам двух ?-цепей. Все эти 6 участков при переходе гемоглобина от окси- к дезоксиформе приобретают большее сродство к Н+ в результате локального изменения аминокислотного окружения вокруг этих участков (приближения к ним отрицательно заряженных карбоксильных групп аминокислот).
Присоединение 3 пар протонов к гемоглобину уменьшает его сродство к О2 и усиливает транспорт О2 в ткани, нуждающиеся в нём (рис. 1-36, А). Увеличение освобождения О2 гемоглобином в зависимости от концентрации Н+ называют эффектом Бора (по имени датского физиолога Христиана Бора, впервые открывшего этот эффект).
В капиллярах лёгких высокое парциальное давление О2 приводит к оксигенированию гемоглобина и удалению 6 протонов. Реакция СО2 + Н2О — Н2СО3 — Н+ + НСО3- сдвигается влево и образующийся СО2 выделяется в альвеолярное пространство и удаляется с выдыхаемым воздухом (рис. 1-36, Б).
Следовательно, молекула гемоглобина в ходе эволюции приобрела способность воспринимать и реагировать на информацию, получаемую из окружающей среды. Увеличение концентрации протонов в среде снижает сродство О2 к гемоглобину и усиливает его транспорт в ткани (рис. 1-37).
Большая часть СО2 транспортируется кровью в виде бикарбоната НСО3-. Небольшое количество
Рис. 1-36. Перенос Н+ и СО2 с кровью. Эффект Бора. А — влияние концентрации СО2 и Н+ на высвобождение О2 из комплекса с гемоглобином в тканях (эффект Бора); Б — оксигенирование дезоксигемоглобина в лёгких, образование и выделение СО2.
Рис. 1-37. Влияние рН на кривую диссоциации О2 для гемоглобина.
СО2 (около 15-20%) может переноситься в лёгкие, обратимо присоединяясь к неионизированным концевым ?-аминогруппам. R-NH2+ СО2 = R-NH-COO + Н+, в результате образуется карбогемоглобин, где R — полипептидная цепь гемоглобина. Присоединение СО2 к гемоглобину также снижает его сродство к О2.
5. 2,3-Бифосфоглицерат — аллостертеский регулятор сродства гемоглобина к О2
2,3-Бифосфоглицерат (БФГ) — вещество, синтезируемое в эритроцитах из промежуточного продукта окисления глюкозы 1,3-бифосфоглицерата.
2,3-Бифосфоглицерат
Регуляция с помощью 2,3-бифосфоглицерата сродства гемоглобина к О2
В нормальньж условиях 2,3-бифосфоглицерат присутствует в эритроцитах примерно в той же концентрации, что и гемоглобин. БФГ, присоединяясь к гемоглобину, также может менять его сродство к О2.
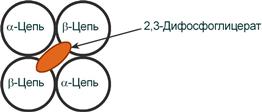
В центре тетрамерной молекулы гемоглобина есть полость, образованная аминокислотными остатками всех четырёх протомеров.
Центральная полость — место присоединения БФГ.
Размеры центральной полости могут меняться: отщепление О2 от оксигемоглобина вызывает его конформационные изменения, которые способствуют образованию дополнительных ионных связей между димерами ?1?1 и ?2?2. В результате пространственная структура дезоксигемоглобина становится более жёсткой, напряжённой, а центральная полость расширяется.
Поверхность полости ограничена остатками аминокислот, в числе которых имеются положительно заряженные радикалы Лиз82, Гис143 ?-цепей и положительно заряженные ?-аминогруппы N-концевого валина ?-цепей. В расширенную полость дезоксигемоглобина БФГ, имеющий сильный отрицательный заряд, присоединяется с помощью ионных связей, образующихся с положительно заряженными функциональными группами двух ?-цепей гемоглобина. Присоединение БФГ ещё сильнее стабилизирует жёсткую структуру дезоксигемоглобина и снижает сродство белка к О2 (рис. 1-38).
Присоединение БФГ к дезоксигемоглобину происходит в участке, ином по сравнению с ге-мом, где происходит связывание О2. Такой лиганд называется «аллостерический», а центр, где связывается аллостерический лиганд, -«аллостерический центр» (от греч. «аллос» — другой, иной, «стерос» — пространственный).
В лёгких высокое парциальное давление О2 приводит к оксигенированию гемоглобина. Разрыв
Рис. 1-38. Взаимодействие 2,3-бифосфоглицерата с аминокислотными остатками центральной полости дезоксигемоглобина.
ионных связей между димерами ?1?1 и ?2?2 приводит к «расслаблению» белковой молекулы, уменьшению центральной полости и вытеснению БФГ.
Изменение концентрации БФГ как механизм адаптации организма к гипоксии. Концентрация БФГ в эритроцитах людей, живущих в определённых климатических условиях, — величина постоянная. Однако в период адаптации к высокогорью, когда человек поднимается на высоту более 4000 м над уровнем моря, концентрация БФГ уже через 2 дня возрастает почти в 2 раза (от 4,5 до 7,0 мМ). Это снижает сродство гемоглобина к О2 и увеличивает количестве О2, транспортируемого в ткани (рис. 1-39).
Такую же адаптацию наблюдают у больных с заболеваниями лёгких, при которых развивается общая гипоксия тканей. Так, у больных с тяжёлой обструктивной эмфиземой лёгких парциальное давление в них снижается от 100 до 50 мм рт. ст. Но при этом в эритроцитах усиливается выработка БФГ, и его концентрация повышается с 4,5 до 7,0 мМ, что существенно увеличивает доставку О2 в ткани.
Рис. 1-39. Влияние различных концентраций 2,3-бифосфоглицерата на сродство гемоглобина к О2.
Клиническое значение концентрации БФГ в консервированной крови
В крови, консервированной в некоторых средах, например цитратдекстрозной, за 10 дней концентрация БФГ снижается с 4,5 до 0,5 мМ. Гемоглобин такой крови имеет очень высокое сродство к О2. Если кровь со сниженной концентрацией БФГ переливать тяжелобольным, возникает опасность развития гипоксии тканей. Введённые с кровью эритроциты за 24 ч могут восстановить лишь половину нормальной концентрации БФГ. Добавлением в кровь БФГ нельзя восстановить нормальную концентрацию его в эритроцитах, так как, имея высокий отрицательный заряд, БФГ не может проникать через мембраны эритроцитов. Поэтому в настоящее время в кровь добавляют вещества, способные проникать через мембрану эритроцитов и поддерживать в них нормальную концентрацию БФГ.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник