Роль гемоглобина у животных
Содержание статьи
Гемоглобин в крови животных. Как определить его количество, и зачем это нужно? — Светич
27 сентября 2018 г.
«Люди забыли эту истину, — сказал Лис. — Но ты не должен ее забывать. Мы всегда будем в ответе за тех, кого приручили». Эта фраза из произведения «Маленький принц», как нельзя лучше описывает отношения человека и животного. Братья наши меньшие всегда будут нуждаться в ежедневной заботе, и наш долг – ее обеспечить.
Одним из распространенных видов исследования состояния здоровья животного является анализ крови. Среди всех компонентов, входящих в ее состав, важнейшую функцию выполняет гемоглобин, а процентное содержание этого вещества – показатель благополучия или наличия патологии в организме. Своевременное обнаружение отклонений от нормы позволит назначить эффективное лечение.
Гемоглобин – это сложный железосодержащий белок, который обеспечивает перенос кислорода из органов дыхания в ткани. Он также обладает свойством частично связывать углекислый газ и выводить его из организма. У человека и позвоночных животных содержится в эритроцитах, а у беспозвоночных – в плазме крови и других тканях. Благодаря этому белку повышается тонус, активизируется обмен веществ организма и укрепляется иммунитет.
На уровень гемоглобина влияет множество факторов: пол, возраст, порода, кормление, условия содержания, физические нагрузки, инфекционные болезни и даже высота над уровнем моря.
Содержание этого белка в крови животных в лабораторных условиях контролируется с помощью применения тест-наборов. В основном это фотометрические методы, позволяющие точно определить его концентрацию. У здоровых животных она составляет (г/л): крупный рогатый скот – 99-129; лошади – 80-140; овцы – 90-133; козы – 100-150; свиньи – 90-110; кошки – 100-140; собаки – 110-170; кролики – 105-125; куры – 80-120; утки – 100-125. Отклонение от нормы в меньшую или большую сторону является патологией и свидетельствует о нарушениях в организме животного. Так, например:
– увеличение количества гемоглобина в крови – гиперхромемия –наблюдается при обезвоживании по причине рвоты, диареи, потливости, при образовании жидкостей (транссудат – отёчная жидкость, скапливающаяся в полостях тела; экссудат – жидкость, выделяющаяся в ткани или полости организма из мелких кровеносных сосудов при воспалении);
– снижение гемоглобина в крови – олигохромемия – возникает при анемиях, вследствие кровотечений, в том числе внутренних, ряда инфекционных болезней, истощения, гемолиза эритроцитов, дефицита железа, витаминов В12 и фолиевой кислоты.
Заподозрить изменение уровня гемоглобина в крови животного позволяет наблюдение за питомцем. Так, к симптомам, позволяющим предположить увеличение концентрации гемоглобина, относятся: потеря аппетита; повышенная утомляемость; вялость и апатия; бледность или покраснение кожных покровов; расстройства в работе ЖКТ. Кровь животного становится темной и густой. Незначительный рост уровня гемоглобина может быть вызван физиологическими причинами, если при повторном анализе наблюдается норма – причин для беспокойства нет.
В случае понижения уровня гемоглобина может наблюдаться: синюшность или бледность слизистых оболочек; слабость и сонливость; учащение пульса и частоты дыхания; озноб и понижение базовой температуры тела (как следствие замедления обменных процессов). В связи с тем, что разрушение эритроцитов происходит по причине нехватки в организме железа, у животных может отмечаться металлический запах из пасти.
Низкий уровень гемоглобина встречается чаще и вызывает большую озабоченность, так как пониженные показатели указывают на наличие серьезных нарушений в функционировании организма животного. Недостаток гемоглобина при беременности, способен привести к серьёзным неблагоприятным последствиям – плод может недополучить кислород, необходимый для нормального развития головного мозга; возникает риск преждевременных родов.
При проявлении у животного симптомов изменения уровня гемоглобина, необходимо незамедлительно обращаться в ветеринарную клинику для прохождения обследования.
В биохимическом отделе ФГБУ «Челябинская МВЛ», подведомственного Россельхознадзору, проводятся исследования по определению содержания гемоглобина в крови домашних и сельскохозяйственных животных.
При диагностике важное значение имеет то, насколько правильно материал был доставлен в лабораторию. Специалисты ветеринарных клиник рекомендуют производить забор крови с утра до приема воды и пищи, по возможности в одни и те же часы. При этом животное должно находиться в спокойном состоянии. При взятии крови в пробирку, для предупреждения свертывания крови, используются антикоагулянты (противосвертывающие вещества) на 10 мл крови:
— щавелевокислый натрий (калий или аммоний) – 0,01-0,02 г (оксалатная кровь);
— лимоннокислый натрий – 0,02 г (цитратная кровь);
— фтористый натрий – 0,01 г;
— гепарин – 1 капля раствора, содержащего в 1 мл 5000 ME гепарина (гепаринизированная кровь).
Антикоагулянты вносят в пробирку, затем в нее собирают кровь; пробирку плотно закрывают резиновой пробкой и несколько раз переворачивают в течение 1-2 минут для наилучшего смешивания содержимого.
Любите своих животных, и они ответят вам взаимностью!
Е.Е. Федорова, специалист по связям с общественностью,
Л.А. Морозова, и.о. директора
Источник
ветеринарная физиология — ГЕМОГЛОБИН
ГЕМОГЛОБИН
Гемоглобин
(Нв) – сложный белок (хромопротеид) —
окрашивает эритроциты в красный цвет, состоит из белка глобина и четырех
молекул гема. Гем является активной частью
и содержит двухвалентное железо, одна молекула гема способна
присоединять и отдавать одну молекулу кислорода. Глобин является белковым
носителем гема. Гемоглобин в легких присоединяет к себе кислород, образуя
непрочное, легко диссоциируемое соединение – оксигемоглобин (НвО2).
Кровь, насыщенная оксигемоглобином (артериальная), поступает в ткани организма,
где оксигемоглобин распадается на восстановленный гемоглобин и кислород.
Восстановленный гемоглобин (дезоксигемоглобин) в тканях соединяется с углекислым газом,
образуя также непрочное соединение карбгемоглобин (НвСО2). Кровь,
насыщенная восстановленным гемоглобином и карбгемоглобином (венозная) поступает
в малый круг кровообращения. В крови плода находится фетальный гемоглобин (НвF),
который может значительно больше насыщаться кислородом, чем гемоглобин матери.
Считается, что фетальный гемоглобин синтезируется в печени, а гемоглобин
взрослых животных – в красном костном мозге. Гемоглобин легко вступает в
соединение с угарным газом (окись углерода), образуя карбоксигемоглобин (НвСО),
который утрачивает способность к переносу кислорода. Уже при содержании во вдыхаемом
воздухе только 0,04% окиси углерода наступает тяжелое отравление, а при
концентрации 0,1% – гибель животного. При слабом отравлении окись углерода
постепенно отщепляется, и гемоглобин восстанавливает свою способность к
присоединению и переносу кислорода. При действии на гемоглобин сильных
окислителей (бертолетова соль, перекись водорода, анилин и др.) образуется
достаточно прочное соединение гемоглобина с кислородом — метгемоглобин (МtНв),
в котором двухвалентное железо переходит в трехвалентную форму. Это соединение
прочно удерживает кислород и не может отщеплять его тканям. При образовании
большого количества метгемоглобина наступает гибель животного от удушья. В
животноводческой практике метгемоглобин образуется при скармливании животных
кормов, содержащих большое количество нитратов от внесения в почву больших доз
азотистых удобрений. Качественное определение гемоглобина и его производных
можно провести при помощи спектрального анализа, а количественное – различными
калориметрическими методами (табл. 7.).
Таблица 7.
Соединение гемоглобина в крови животных г/л крови
Вид | Содержание | Вид | Содержание |
Лошади Крупный Свиньи Овцы | 80—130 90—120 90—110 70—110 | Кролики Пушные Птица Рыбы | 100—120 120—170 80—130 60—120 |
Низкое
содержание гемоглобина может наблюдаться при несбалансированном кормлении
животных, нарушении синтеза гемоглобина, что приводит к значительным нарушениям
многих функций организма.
Для установления насыщенности эритроцитов гемоглобином
определяют цветовой показатель или индекс g.
g= | «Нв» |
«Нв» |
В норме этот показатель равен 1 ± 0,15%
Миоглобин – это сложный белок, содержащийся в скелетных и
сердечной мышцах. Миоглобин может связывать 14—15% общего количества кислорода.
Кислород миоглобина используется мышцами
при их сокращении, когда приток крови в их капиллярах уменьшается. При
расслаблении мышц миоглобин снова присоединяет к себе кислород. В значительно
больших количествах миоглобин содержится в мышцах морских млекопитающих, что дает
им возможность длительное время находиться под водой.
При разрушении эритроцитов гемоглобин распадается на
гем и глобин, часть железа гема окисляется с образованием специфического
соединения—гемосидерина, используемого для синтеза нового гемоглобина.
Остальная часть гема превращается в желтые пигменты – билирубин и биливердин,
которые в дальнейшем в виде уробилина и урохрома выделяются с мочой или в виде
стеркобилина — с каловыми массами.
Источник
емоглобин. Роль гемоглобина в транспорте кислорода
Гемоглобин. Роль гемоглобина в транспорте кислородаОбычно из легких в ткани переносятся эритроцитами в химической связи с гемоглобином около 97% кислорода. Оставшиеся 3% кислорода транспортируются в физической растворенной форме плазмой крови. Таким образом, в нормальных условиях почти весь кислород переносится в ткани, будучи связанным с гемоглобином. а) Обратимая связь кислорода с гемоглобином. Химический состав гемоглобина представлен в отдельных статьях на сайте, где говорилось, что молекула кислорода легко и обратимо связывается с гемом гемоглобина. При высоком PO2, как это бывает в легочных капиллярах, кислород связывается с гемоглобином, а при низком PO2, как в капиллярах тканей, кислород освобождается от связи с гемоглобином. Такой механизм обеспечивает почти весь транспорт кислорода из легких в ткани.
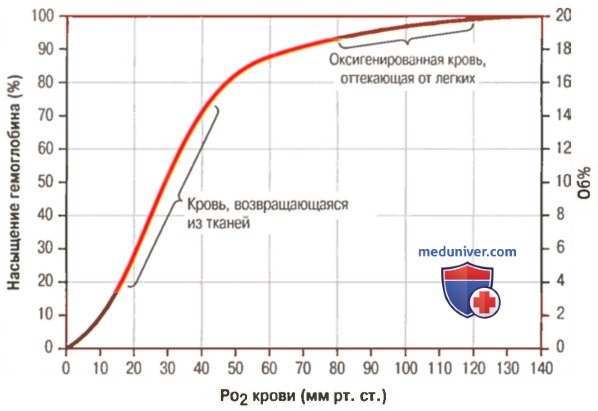
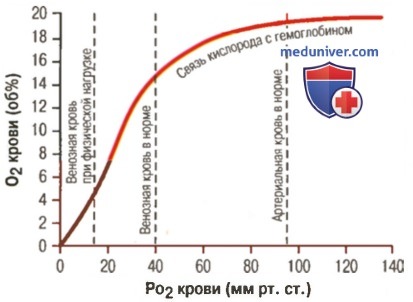
1. Кривая диссоциации оксигемоглобина. На рисунке выше приведена кривая диссоциации оксигемоглобина, демонстрирующая прогрессивный прирост процентной доли оксигемоглобина (процента насыщения гемоглобина кислородом) при увеличении PO2 в крови. В крови, покидающей легкие и входящей в системные артерии, напряжение О2 обычно составляет примерно 95 мм рт. ст., и на кривой диссоциации видно, что насыщение системной артериальной крови кислородом составляет 97%. В нормальной возвращающейся из периферических тканей венозной крови напряжение О2 составляет около 40 мм рт. ст. и 75% — насыщение гемоглобина кислородом. 2. Максимальное количество кислорода, которое может находиться в связи с гемоглобином крови. В 100 мл крови здорового человека содержится около 15 г гемоглобина, и каждый грамм гемоглобина может связать максимально 1,34 мл кислорода (химически чистый гемоглобин может связать 1,39 мл кислорода, но примеси типа метгемоглобина снижают это количество). Итак, 15×1,34 = 20,1, значит, в среднем содержащееся в 100 мл количество гемоглобина при 100% насыщении может связать около 20 мл кислорода. Обычно это обозначают как 20 об% (объемных процентов). Кривая диссоциации оксигемоглобина может строиться не от процентного насыщения гемоглобина кислородом, а от количества содержания объемных процентов кислорода. 3. Количество кислорода, высвобождаемого гемоглобином во время прохождения артериальной крови через ткани. В обычных условиях в системной артериальной крови, насыщенной кислородом на 97%, общее количество связанного с гемоглобином кислорода составляет около 19,4 мл на 100 мл крови (для облегчения понимания просим вас изучить рисунок ниже). При прохождении через капилляры ткани этот объем снижается до 14,4 мл (PO2 — 40 мм рт. ст., насыщение гемоглобина — 75%). Итак, в нормальных условиях каждые 100 мл крови доставляют от легких к тканям около 5 мл кислорода.
4. Транспорт кислорода при тяжелой физической нагрузке. При тяжелой физической работе мышечные клетки потребляют кислород с повышенной скоростью, что может привести к падению PO2 в интерстициальной жидкости мышцы от нормального уровня 40 мм рт. ст. до 15 мм рт. ст. При таком низком парциальном давлении в каждых 100 мл крови остается только 4,4 мл связанного с гемоглобином кислорода. В этом случае каждые 100 мл протекающей крови отдают тканям 19,4 — 4,4, или 15 мл кислорода, т.е. каждый объем крови отдает тканям в 3 раза больше кислорода, чем в покое. Вспомните, что у хорошо тренированных бегунов-марафонцев сердечный выброс может увеличиться в 6-7 раз, чем при покое. Если умножить это увеличение сердечного выброса (6-7 раз) на увеличение высвобождения кислорода в тканях каждым объемом крови (3 раза), получается, что к тканям было доставлено в 20 раз больше кислорода, чем в покое. Далее в этой главе Вы узнаете о существовании других факторов, улучшающих доставку кислорода в ткани во время физической нагрузки, поэтому даже при очень напряженной физической работе наблюдается только очень небольшое снижение PO2 в мышечной ткани. — Также рекомендуем «Коэффициент использования кислорода. Сохранение постоянства кислорода в тканях» Оглавление темы «Кислород и его доставка в организме»: |
Источник
ГЕМОГЛОБИН | Животноводство крс
Гемоглобин (Нв) – сложный белок (хромопротеид) — окрашивает эритроциты в красный цвет, состоит из белка глобина и четырех молекул гема. Гем является активной частью и содержит двухвалентное железо, одна молекула гема способна присоединять и отдавать одну молекулу кислорода. Глобин является белковым носителем гема. Гемоглобин в легких присоединяет к себе кислород, образуя непрочное, легко диссоциируемое соединение – оксигемоглобин (НвО2). Кровь, насыщенная оксигемоглобином (артериальная), поступает в ткани организма, где оксигемоглобин распадается на восстановленный гемоглобин и кислород. Восстановленный гемоглобин (дезоксигемоглобин) в тканях соединяется с углекислым газом, образуя также непрочное соединение карбгемоглобин (НвСО2). Кровь, насыщенная восстановленным гемоглобином и карбгемоглобином (венозная) поступает в малый круг кровообращения. В крови плода находится фетальный гемоглобин (НвF), который может значительно больше насыщаться кислородом, чем гемоглобин матери. Считается, что фетальный гемоглобин синтезируется в печени, а гемоглобин взрослых животных – в красном костном мозге. Гемоглобин легко вступает в соединение с угарным газом (окись углерода), образуя карбоксигемоглобин (НвСО), который утрачивает способность к переносу кислорода. Уже при содержании во вдыхаемом воздухе только 0,04% окиси углерода наступает тяжелое отравление, а при концентрации 0,1% – гибель животного. При слабом отравлении окись углерода постепенно отщепляется, и гемоглобин восстанавливает свою способность к присоединению и переносу кислорода. При действии на гемоглобин сильных окислителей (бертолетова соль, перекись водорода, анилин и др.) образуется достаточно прочное соединение гемоглобина с кислородом — метгемоглобин (МtНв), в котором двухвалентное железо переходит в трехвалентную форму. Это соединение прочно удерживает кислород и не может отщеплять его тканям. При образовании большого количества метгемоглобина наступает гибель животного от удушья. В животноводческой практике метгемоглобин образуется при скармливании животных кормов, содержащих большое количество нитратов от внесения в почву больших доз азотистых удобрений. Качественное определение гемоглобина и его производных можно провести при помощи спектрального анализа, а количественное – различными калориметрическими методами (табл. 7.).
| Вид животных | Содержание Нв | Вид животных | Содержание Нв |
| ЛошадиКрупный рогатый скот Свиньи Овцы | 80—13090—120 90—110 70—110 | КроликиПушные звери Птица Рыбы | 100—120120—170 80—130 60—120 |
Низкое содержание гемоглобина может наблюдаться при несбалансированном кормлении животных, нарушении синтеза гемоглобина, что приводит к значительным нарушениям многих функций организма.
Для установления насыщенности эритроцитов гемоглобином определяют цветовой показатель или индекс g.
g=
«Нв» у исследуемого животного х нормальное количество эритроцитов
«Нв» в норме х количество эритроцитов у исследуемого животного
В норме этот показатель равен 1 ± 0,15%
Миоглобин – это сложный белок, содержащийся в скелетных и сердечной мышцах. Миоглобин может связывать 14—15% общего количества кислорода. Кислород миоглобина используется мышцами при их сокращении, когда приток крови в их капиллярах уменьшается. При расслаблении мышц миоглобин снова присоединяет к себе кислород. В значительно больших количествах миоглобин содержится в мышцах морских млекопитающих, что дает им возможность длительное время находиться под водой.
При разрушении эритроцитов гемоглобин распадается на гем и глобин, часть железа гема окисляется с образованием специфического соединения—гемосидерина, используемого для синтеза нового гемоглобина. Остальная часть гема превращается в желтые пигменты – билирубин и биливердин, которые в дальнейшем в виде уробилина и урохрома выделяются с мочой или в виде стеркобилина — с каловыми массами.
Нравиться
6864
Источник