Роль железа в синтезе гемоглобина
Содержание статьи
Синтез гемоглобина, его строение и первичная структура молекулы, число генов, биохимия и роль железа в его синтезе

Синтез гемоглобина происходит в костном мозге. Он образуется из гема и глобина. Гем – это соединение порфирина и железа, а глобин представлен двумя цепочками аминокислот: 2 альфа и 2 бета.
Один гем и глобин называются субъединицей, в гемоглобине их 4. Каждая может присоединять из воздуха и отдавать клетке кислород, а в обратном направлении переносится углекислый газ. При недостатке железа развивается железодефицитная анемия, так как железо удерживает части гема, обеспечивает соединение гема и глобина.
При нарушении образования цепей глобина развивается талассемия со склонностью к тромбозу и серповидно-клеточная анемия с поражением печени, селезенки, накоплением железа. Если есть врожденный дефект синтеза порфирина, то возникают порфирии, их типичный признак – это красная моча. Печеночная порфирия также появляется при злоупотреблении снотворными группы барбитуратов.
Синтез гемоглобина: пояснение простыми словами
Синтез гемоглобина проходит в клетках-предшественниках эритроцитов – эритробластах и ретикулоцитах костного мозга. Для его образования нужны порфирины, глобин (белок) и ионы железа. Порфирин – это аморфное (некристаллическое) вещество, при пропускании через него света появляется красное окрашивание. Источниками для его синтеза является аминокислота, глицин и коэнзим А (производное янтарной кислоты).
Из порфирина и железа образуется гем. Биохимия этого процесса включает ряд последовательных реакций с появлением порфобилиногена. Потом требуется его 4 молекулы для формирования комплекса уропорфириногена, превращающегося в протопорфирин. Именно последний и соединяется с железом. Одновременно и в том же количестве образуется белок глобин из аминокислот. При соединении гема и глобина появляется гемоглобин.
Для нормального образования гема требуется витамин В6, В12, фолиевая кислота, ионы меди и кобальта. Поэтому при однообразном питании с дефицитом мяса, овощей, ягод и круп уменьшается синтез гемоглобина. Также причиной нарушений бывают и врожденные болезни с нарушением усвоения витаминов и минералов. Так развиваются дефицитные анемии. Наиболее известная и распространенная форма – это железодефицитная, но возможны и фолиеводефицитная, В12-дефицитная.
Какую структуру имеет молекула гемоглобина
Молекула гемоглобина в структуре содержит белковую часть – глобин и пигментный комплекс с железом (гем). У взрослого человека белок имеет 2 альфа и 2 бета цепи, они состоят из 141 и 146 аминокислот соответственно. Нормальный гемоглобин имеет обозначение HbA1. Следовые количества представлены HbA2, в нем вместо бета-цепей есть дельта-цепи. Такой комплекс прочно удерживает кислород и с трудом его отдает тканям.
В крови у плода есть два вида гемоглобина – эмбриональный и фетальный. Они имеют другую первичную структуру. У новорожденного 80% составляет фетальный, а к концу первого месяца молекула приобретает вид обычного, характерного для взрослого.
Число гемов в составе молекулы
Молекула гемоглобина состоит из четырех гемов. Каждый гем внутри содержит железо и окружен глобином, образующим гемовый «карман». Такое расположение обеспечивает растворимость и возможность соединения с кислородом. Каждая субъединица может связывать одну молекулу кислорода.
Поэтому на каждый гемоглобин эритроцита приходится 4 молекулы кислорода. После того, как доставка кислородных молекул завершена, гемоглобин забирает из тканей углекислоту, и в легких она выделяется в воздух при выдохе.
Роль железа в синтезе гемоглобина
Железо является необходимым компонентом для синтеза гемоглобина, так как оно обеспечивает связи ядер порфирина, аминокислот глобина, то есть оно удерживает весь комплекс. Биологическая роль железа состоит также в:
- связывании кислорода в легких;
- транспортировке кислорода к тканям и внутриклеточном переносе к митохондриям;
- использовании кислородных ионов для образования энергии;
- обезвреживании токсичных соединений.
Источниками минерала является пища и ионы, образовавшиеся при распаде гемоглобина (повторное использование). Усиление всасывания железа из кишечника происходит при снижении его запасов. Хранится микроэлемент в виде ферритина.
Болезни с нарушением синтеза гемоглобина
Снижение синтеза гемоглобина происходит при дефицитных анемиях, но есть и более редкие формы нарушений – образование неправильных цепей глобина (гемоглобинозы) и дефекты порфирина (порфирии).
Гемоглобинозы
Гемоглобинозы делятся на гемоглобинопатии и талассемии.
Гемоглобинопатии характеризуются образованием гемоглобина неправильной структуры. Могут протекать бессимптомно при мелких изменениях или тяжело при существенных аномалиях. Примером опасной формы является серповидно-клеточная анемия. При ней образуется HbS. Глутаминовая кислота в нем заменена на валин в шестом положении бета-цепи. Это приводит к снижению растворимости гемоглобина внутри эритроцита, и он образует осадок в виде серпа. Для этого заболевания характерны:
- нарушение кровотока в мелких сосудах;
- склонность к тромбозам;
- высокий риск инсульта, инфаркта;
- ускоренное разрушение эритроцитов (гемолитическая анемия);
- одышка, особенно при физических нагрузках.
При талассемии нарушается синтез одной из цепей гемоглобина. Чаще всего изменяется бета-цепь. Фетальный гемоглобин из-за этого не превращается в полноценный HbA1, его в крови у взрослых содержится до 60%, а вторая форма с плохой отдачей кислорода HbA2 составляет около 15%. Эти формы гемоглобина нестойкие, поэтому эритроциты быстро разрушаются. Болезнь сопровождается:
- разрастанием и разрушением костного мозга;
- изменениями формы лица и черепа;
- поражением селезенки и печеночной ткани;
- увеличением количества железа в сыворотке крови и его отложением в тканях.
Причиной смерти больного чаще всего бывает сердечная недостаточность из-за накопления железа в миокарде.
Порфирии
Нарушение янтарно-глицинового пути образования порфирина приводит к порфирии. Это врожденные и приобретенные болезни, наиболее распространены эритроцитарная и печеночная. Первая характеризуется дефектом ферментов, участвующих в синтезе гема. В организме накапливается уропорфириноген, он не может включиться в гемовый остаток и выделяется с мочой, концентрируется в костном мозге. Типичные признаки:
- красная моча;
- ускоренное разрушение эритроцитов;
- красноватый оттенок зубов;
- высокая чувствительность к солнечным лучам.
Печеночная порфирия бывает врожденной и на фоне злоупотребления барбитуратами (снотворные). Моча имеет цвет красного вина, больные предъявляют жалобы на частую рвоту, запоры, нарушения работы сердца, боль в животе. Нередко возникают психические расстройства.
Для синтеза гемоглобина нужно железо, белок, витамины, немного меди и кобальта. Его образование происходит в костном мозге, а при нарушении возникает талассемия, порфирии, серповидно-клеточная и дефицитные анемии.
Источник
емоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина.
Оглавление темы «Функции клеток крови. Эритроциты. Нейтрофилы. Базофилы.»: Гемоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина.Гемоглобин — это гемопротеин, с молекулярной массой около 60 тыс., окрашивающий эритроцит в красный цвет после связывания молекулы O2 с ионом железа (Fe++). У мужчин в 1 л крови содержится 157 (140—175) г гемоглобина, у женщин — 138 (123—153) г. Молекула гемоглобина состоит из четырех субъединиц гема, связанных с белковой частью молекулы — глобином, сформированной из полипептидных цепей.
Синтез гема протекает в митохондриях эритробластов. Синтез цепей глобина осуществляется на полирибосомах и контролируется генами 11-й и 16-й хромосом. Схема синтеза гемоглобина у человека представлена на рис. 7.2. Гемоглобин, содержащий две а- и две В-цепи, называется А-тип (от adult — взрослый). 1 г гемоглобина А-типа связывает 1,34 мл O2. В первые три месяца жизни плода человека в крови содержатся эмбриональные гемоглобины типа Gower I (4 эпсилон цепи) и Gower II (2а и 25 цепи). Затем формируется гемоглобин F (от faetus — плод). Его глобин представлен двумя цепями а и двумя В. Гемоглобин F обладает на 20—30 % большим сродством к O2, чем гемоглобин А, что способствует лучшему снабжению плода кислородом. При рождении ребенка до 50—80 % гемоглобина у него представлены гемоглобином F и 15—40 % — типом А, а к 3 годам уровень гемоглобина F снижается до 2 %. Соединение гемоглобина с молекулой 02 называется оксигемоглобином. Сродство гемоглобина к кислороду и диссоциация оксигемоглобина (отсоединения молекул кислорода от оксигемоглобина) зависят от напряжения кислорода (Р02), углекислого газа (РС02) в крови, рН крови, ее температуры и концентрации 2,3-ДФГ в эритроцитах. Так, сродство повышают увеличение Р02 или снижение РС02 в крови, нарушение образования 2,3-ДФГ в эритроцитах. Напротив, повышение концентрации 2,3-ДФГ, снижение Р02 крови, сдвиг рН в кислую сторону, повышение РС02 и температуры крови — уменьшают сродство гемоглобина к кислороду, тем самым облегчая ее отдачу тканям. 2,3-ДФГ связывается с р-цепями гемоглобина, облегчая отсоединение 02 от молекулы гемоглобина. Увеличение концентрации 2,3-ДФГ наблюдается у людей, тренированных к длительной физической работе, адаптированных к длительному пребыванию в горах. Оксигемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином. В состоянии физиологического покоя у человека гемоглобин в артериальной крови на 97 % насыщен кислородом, в венозной — на 70 %. Чем выраженней потребление кислорода тканями, тем ниже насыщение венозной крови кислородом. Например, при интенсивной физической работе потребление кислорода мышечной тканью увеличивается в несколько десятков раз и насыщение кислородом оттекающей от мышц венозной крови снижается до 15 %. Содержание гемоглобина в отдельном эритроците составляет 27,5—33,2 пикограмма. Снижение этой величины свидетельствует о гипохромном (т. е. пониженном), увеличение — о гиперхромном (т. е. повышенном) содержании гемоглобина в эритроцитах. Этот показатель имеет диагностическое значение. Например, гиперхромия эритроцитов характерна для В|2-дефицитной анемии, гипохромия — для железодефицитной анемии. — Также рекомендуем «Старение эритроцитов. Разрушение эритроцитов. Длительность жизни эритроцита. Эхиноцит. Эхиноциты.» |
Источник
елезо. Железо в норме. Роль ионов железа в эритропоэзе. Трансферрин. Потребность организма в железе. Дефицит железа. ОЖСС.
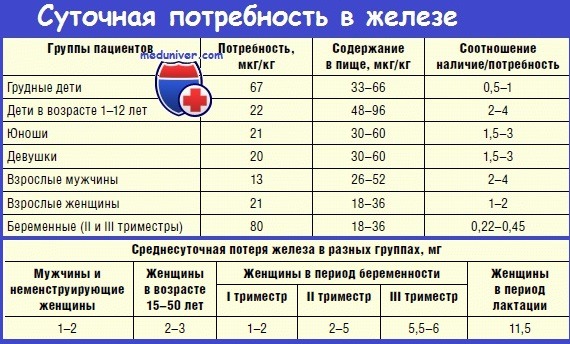
Оглавление темы «Функции клеток крови. Эритроциты. Нейтрофилы. Базофилы.»: Железо. Железо в норме. Роль ионов железа в эритропоэзе. Трансферрин. Потребность организма в железе. Дефицит железа.В организме содержится 4—5 г железа в виде резервного (1/4) и функционально-активного железа (3/4). 62—70 % железа находится в гемоглобине эритроцитов, 5—10 % — в миоглобине, остальное — в тканях, где оно участвует во многих метаболических процессах: в составе металсодержащих энзимов—цитохромов обеспечивают митохондриальный транспорт электронов, синтез ДНК и деление клеток, метаболизм гормонов мозгового вещества надпочечников, детоксикационные механизмы, снижающие активность токсичных веществ под влиянием цитохрома Р450, в состав которого входит железо; поддерживают активность глицерол-3-фосфатдегидрогеназы в поперечно-полосатых мышцах, что сохраняет физическую работоспособность человека. Резервное железо постоянно переходит в функциональное и обратно. Так, за счет повторного использования костный мозг получает ежесуточно 20—25 мг железа. Ионы железа (Fe++) ежедневно всасываются в кишечнике из пищи. Fe2+ в кишечном содержимом вначале связывается с белком-рецептором на поверхности эпителия слизистой оболочки кишки (b3-интегрином), что необходимо для перехода его через мембрану клетки слизистой в цитозоль. Далее, образовав комплекс с цитозольным транспортным белком- мобилферрином, Fe2+ пересекает клетку эпителия слизистой кишечника оставаясь в этом комплексе вплоть до поступления Fe2+ в капиллярную сеть кишечника. С выходом в кровоток двухвалентное железо окисляется до трехвалентного белком плазмы крови церрулоплазмином и присоединяется к трансферрину, гликопротеину плазмы крови. Трансферрином Fe3+ доставляется к тканям и используется в митохондриях эритроб-ластов для синтеза гема, депонируется в макрофагах в виде резерва. Плазма содержит от 1,8 до 2,6 мг/л трансферрина, 1 мг которого связывает 1,25 мкг Fe. В общем объеме плазмы содержится около 3 мг Fe2+. В норме лишь ‘/з трансферрина плазмы насыщена железом. Количество железа, которое может быть связано трансферрином, называется общей железосвязывающей способностью крови и в норме составляет 250—400 мкг % (45— 72 мкмоль/л). Концентрация железа в сыворотке крови у взрослых людей обоего пола колеблется от 50 до 160 мкг % (9—29 мкмоль/л). С мочой выводится за сутки 60—100 мкг железа. Комплекс трансферрин — железо фиксируется на рецепторах мембран эритробластов. Количество этих рецепторов уменьшается за счет торможения их синтеза в ходе созревания эритроидных клеток и исчезает после созревания ретикулоцитов, поэтому в зрелые эритроциты железо не включается. Освобождение железа из комплекса трансферрин — железо обеспечивается энергией молекул АТФ, образуемых в эритробластах. Молекула трансферрина, отдавшая железо, смещается с мембранного участка молекулами трансферрина, связанными с железом, поскольку их сродство к рецепторам более сильное. Железо, поступившее в эритробласт, используется в митохондриях для синтеза гема и депонируется в эритробласте в виде резерва. В макрофагах печени и костного мозга резервное железо депонируется в молекуле ферритина. Внутри лизосом молекулы ферритина образуют большие аморфные нерастворимые агрегаты — гемосидерин. Таким образом, ферритин и гемосидерин — это формы резервного железа в клетках. Из клеточного резерва железо освобождается в двухвалентном состоянии (благодаря энзиму ксантиноксидазе, аскорбиновой кислоте и др.), затем церулоплазмин окисляет Fe2+ до трехвалентного состояния, Fe3+ соединяется с трансферрином и транспортируется с плазмой крови к эритробластам.
Абсорбции железа эпителиальными клетками желудочно-кишечного тракта способствуют сниженное насыщение трансферрина железом и повышенная эритропоэтическая активность крови. Абсорбция снижается при увеличении концентрации железа в клетках слизистой оболочки кишечника. В кишечнике более эффективна абсорбция Fe2+, чем Fe3+. Поэтому аскорбиновая кислота, фруктоза, аминокислоты (цистеин, метионин) поддерживают двухвалентную форму железа и ускоряют его абсорбцию. В кишечнике лучше абсорбируется биодоступное железо, входящее в состав гема (мясные продукты, кровяная колбаса), чем железо из пищи растительного происхождения. Абсорбция Fe2+ в желудочно-кишечном тракте зависит от возраста человека, функционального сотояния его организма. Она наиболее высокая у детей первых месяцев жизни и достигает 57 %, у 7— 10-летних —7,75—17,75 %, у взрослых мужчин и женщин — 1,1—11,2 % и у беременных женщин — 20 % от поступившего в желудочно-кишечный тракт железа. Отсюда ежедневная потребность в железе, абсорбируемом из пищи в организме человека, составляет: у детей от 0 до 4 мес жизни — 0,5 мг/день, от 1 года до 12 лет— 1,0 мг/день, женщины детородного периода — 2,8 мг/день (во время менструации потери железа составляют от 5 до 45 мг), молодые мужчины — 1 мг/день, старики — 0,9 мг/день, беременные женщины — 3—3,5 мг/день. В организм последних за время беременности должно поступать до 1 г железа (500 мг железа используется для синтеза дополнительного количества гемоглобина в организме беременной, 300 мг Fe2+ необходимо формирующемуся плоду и 200 мг Fe2+ компенсируют естественные потери металла организмом беременной женщины). Дефицит железа в организме человека приводит к развитию гипохромной анемии. — Также рекомендуем «Эритропоэз. Эритробластические островки. Анемия. Эритроцитоз.» |
Источник
ернициозная анемия. Образование гемоглобина
Пернициозная анемия. Образование гемоглобинаНарушение созревания, связанное с недостаточным всасыванием витамина В12 из желудочно-кишечного тракта: а) Пернициозная анемия. Распространенной причиной нарушения созревания красных клеток крови является недостаточное всасывание витамина В12 из желудочно-кишечного тракта. Это часто происходит при заболевании пернициозной анемией, при которой основной патологией является атрофический гастрит, нарушающий нормальную секреторную функцию желудка. Париетальные клетки желудочных желез секретируют гликопротеин, называемый внутренним фактором, который соединяется с витамином В12 пищи и делает этот витамин доступным для всасывания в кишечнике. Это происходит следующим образом: (1) внутренний фактор прочно связывается с витамином B12. В таком связанном состоянии витамин В12 защищается от переваривания желудочно-кишечными секретами; (2) находясь в связанном состоянии, внутренний фактор связывается со специфическими рецепторами на мембранах клеток щеточной каемки слизистой подвздошной кишки; (3) затем в течение следующих нескольких часов витамин В12 транспортируется в кровь путем пиноцитоза; в результате внутренний фактор и витамин вместе переносятся через мембрану. Следовательно, недостаток внутреннего фактора ведет к уменьшению доступности витамина В12 из-за нарушения всасывания витамина. Сразу после всасывания из желудочно-кишечного тракта витамин B12 сначала накапливается в печени в большом количестве, затем медленно выделяется по мере потребности в нем костного мозга. Минимальное количество витамина B12, необходимое ежедневно для поддержания нормального созревания красных клеток крови, составляет всего 1-3 мкг, а нормальное накопление в печени и других тканях тела примерно в 1000 раз больше этого количества. Следовательно, обычно для развития анемии в связи с нарушением созревания эритроцитов недостаточность всасывания В12 должна продолжаться 3-4 года. б) Недостаточность созревания, связанная с дефицитом фолиевой кислоты (птероилглутаминовой кислоты). Фолиевая кислота является нормальным компонентом овощей, некоторых фруктов и мяса (особенно, печени). Однако она легко разрушается во время приготовления пищи. Кроме того, люди с нарушением всасывания в желудочно-кишечном тракте, например при часто встречающемся заболевании тонкого кишечника, которое называют спру, обычно имеют серьезные затруднения всасывания и фолиевой кислоты, и витамина B12. Следовательно, во многих случаях причиной нарушений созревания является недостаточность всасывания в кишечнике и фолиевой кислоты, и витамина B12. Формирование гемоглобинаСинтез гемоглобина начинается в проэритробластах и продолжается даже на стадии ретикулоцита красных клеток крови. Следовательно, когда ретикулоциты оставляют костный мозг и проходят в кровоток, они продолжают формировать минимальные количества гемоглобина в течение примерно следующего дня до тех пор, пока не станут зрелыми эритроцитами.
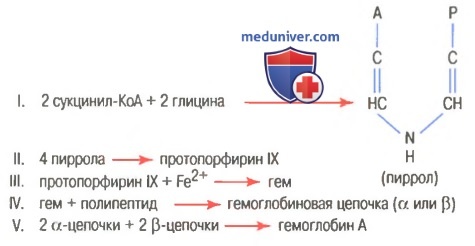
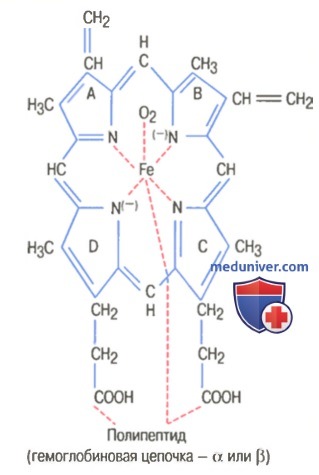
На рисунке выше показаны основные химические этапы формирования гемоглобина. Сначала сукцинил-КоА, формируемый в метаболическом цикле Кребса, связывается с глицином, образуя молекулу пиррола. В свою очередь, четыре молекулы пиррола объединяются, образуя протопорфирин IX, который затем соединяется с железом, формируя молекулу гема. Наконец, каждая молекула гема присоединяется к синтезируемому рибосомами длинному полипептиду глобину, формируя субъединицу гемоглобина, называемую гемоглобиновой цепочкой (для облегчения понимания просим вас изучить рисунок ниже). Каждая цепочка имеет молекулярную массу около 16000; в свою очередь, четыре такие цепочки свободно связываются вместе, формируя целую гемоглобиновую молекулу.
Существуют несколько легких вариаций гемоглобиновых цепочек в зависимости от аминокислотного состава полипептидной части субъединицы. Разные типы цепочек обозначают как альфа, бета, гамма и дельта. Наиболее распространенная форма гемоглобина взрослого человека — гемоглобин А. Он представляет собой комбинацию двух альфа-цепочек и двух бета-цепочек. Гемоглобин А имеет молекулярную массу 64458. Поскольку каждая гемоглобиновая цепочка имеет простетическую группу в виде гема, содержащего атом железа, ясно, что каждая молекула гемоглобина, состоящая из четырех таких цепочек, содержит четыре атома железа. Каждый из них может свободно связываться с одной молекулой кислорода, обеспечивая возможность транспортировки каждой молекулой гемоглобина четырех молекул (или восьми атомов) кислорода. Типы гемоглобиновых цепочек в молекуле гемоглобина определяют сродство гемоглобина к кислороду. Патологические изменения цепочек могут менять физические характеристики гемоглобиновой молекулы. Например, при серповидно-клеточной анемии в одном участке каждой из двух бета-цепочек аминокислота валин заменяется глутаминовой кислотой. При низком парциальном давлении кислорода этот тип гемоглобина формирует внутри эритроцитов вытянутые кристаллы, длина которых иногда достигает 15 мкм. Они делают практически невозможным прохождение эритроцитов через многие мелкие капилляры, и острые концы кристаллов, вероятно, разрывают клеточные мембраны, способствуя развитию серповидно-клеточной анемии. — Также рекомендуем «Связывание гемоглобина с кислородом. Обмен железа» Оглавление темы «Эритропоэз. Белые клетки крови»: |
Источник