Синтез гема и гемоглобина регуляция этих процессов
Содержание статьи
Гем необходим для многих ферментов
Гем является небелковой частью многих гемопротеинов:
- гемоглобин (до 85% общего количества гема организма), локализованный в эритроцитах и клетках костного мозга,
- миоглобин скелетных мышц и миокарда (до 17%),
- цитохромы дыхательной цепи,
- ферменты цитохромоксидаза, цитохром P450, гомогентизатоксидаза, миелопероксидаза, каталаза и глутатионпероксидаза, тиреопероксидаза и т.д. – менее 1%.
Строение и синтез гема
Гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями.
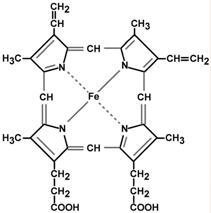
Строение гема
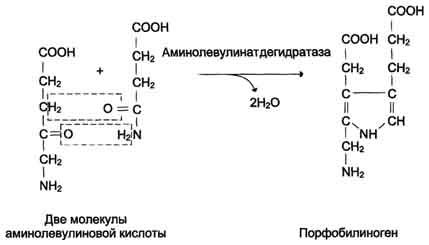
Синтез гема в основном идет в предшественниках эритроцитов, в клетках печени, почек, слизистой кишечника и в остальных тканях. Первая реакция синтеза с участием δ-аминолевулинат-синтазы (греч. δ — «дельта») происходит в митохондриях. Следующая реакция при участии аминолевулинатдегидратазы (порфобилиноген-синтазы) протекает в цитозоле, здесь из двух молекул δ‑аминолевулиновой кислоты образуется циклический порфобилиноген (монопиррол).
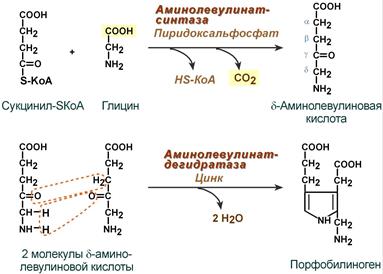
Синтез порфобилиногена
После синтеза порфобилиногена четыре его молекулы конденсируются в гидроксиметилбилан, который далее превращается в уропорфириноген типа I и уропорфириноген типа III. В синтезе обоих видов порфиринов принимает участие уропорфириноген I-синтаза, в образовании уропорфириногена III дополнительно принимает участие фермент уропорфириноген III-косинтаза.
Судьба обоих типов уропорфириногена двояка: они могут окисляться до уропорфирина (на рисунке не показано) или декарбоксилироваться до копропорфириногена соответствующего типа.
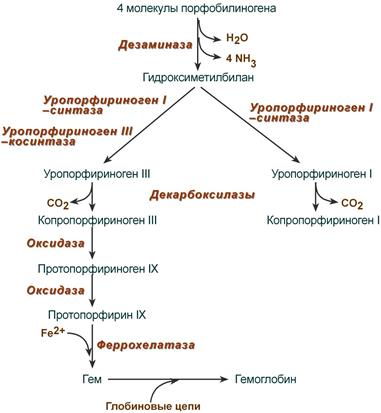
Синтез гема из порфобилиногена
Копропорфириноген III возвращается в митохондрии и окисляется в протопорфириноген IX и далее в протопорфирин IX. Последний после связывания с железом образует гем, реакцию катализирует феррохелатаза (гемсинтаза).
Скорость синтеза глобиновых цепей зависит от наличия гема, он ускоряет биосинтез «своих» белков.
Названия пигментов (уропорфирины и копропорфирины) были даны веществам по источнику их первоначального выделения, при этом восстановленные бесцветные формы называют порфириногенами. Для порфиринов характерно наличие изомерии вследствие различного расположения радикалов, что нашло отражение в порядковых номерах изомеров.
Регуляция синтеза гема
Основным регуляторным ферментом синтеза гема является аминолевулинатсинтаза.
1. Гем :
- напрямую оказывает отрицательный аллостерический эффект на фермент,
- влияет на транскрипцию фермента. После взаимодействия с молекулой белка-репрессора формирует активный репрессорный комплекс, связывается с ДНК и подавляет транскрипцию, мРНК для фермента не образуется и синтез фермента прекращается.
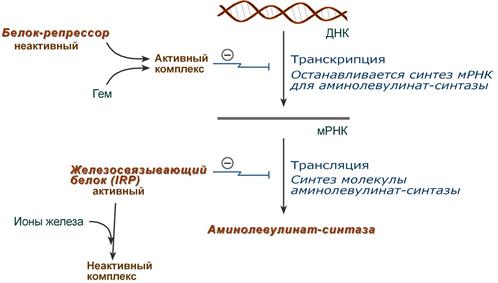
Регуляция синтеза аминолевулинатсинтазы
2. Ионы железа. Их достаточное количество оказывает положительный эффект при синтезе молекулы аминолевулинатсинтазы.
В клетке имеется железосвязывающий белок (англ. IRP, iron-responsive element-binding proteins – белок, связывающий железочувствительный элемент), который в отсутствии ионов железа обладает сродством к железочувствительному участку IRE (англ. iron-responsive element ) на матричной РНК фермента. Это связывание блокирует трансляцию мРНК в рибосоме, т.е. подавляет синтез белковой цепи.
При наличии ионов железа они связываются с железосвязывающим белком, образуя с ним неактивный комплекс, и это инициирует синтез фермента.
3. Положительным модулятором аминолевулинатсинтазы служит внутриклеточная гипоксия, которая в эритропоэтических тканях индуцирует синтез фермента.
4. В печени повышению активности аминолевулинатсинтазы способствуют различные соединения, усиливающие работу микросомальной системы окисления (жирорастворимые вещества, стероиды) – при этом возрастает потребление гема для образования цитохрома Р450, и снижается внутриклеточная концентрация свободного гема. В результате происходит усиление синтеза фермента.
Источник
94. Синтез гема и гемоглобина. Регуляция этих процессов. Вариации первичной структуры и свойств гемоглобина. Гемоглобинопатии.
Гем
синтезируется во всех тканях, но с
наибольшей скоростью в костном мозге
и печени (рис. 13-2). В костном мозге гем
необходим для синтеза гемоглобина в
ретикулоцитах, в гепатоцитах — для
образования цитохрома Р450.
Первая
реакция синтеза гема — образование
5-аминолевулиновой кислоты из глицина
и сук-цинил-КоА (рис. 13-3) идёт в матриксе
митохондрий, где в ЦТК образуется один
из субстратов этой реакции — сукцинил-КоА.
Эту реакцию катализирует пиридоксальзависимый
фермент аминолевулинатсинтаза.
Из
митохондрий 5-аминолевулиновая кислота
поступает в цитоплазму. В цитоплазме
проходят промежуточные этапы синтеза
гема: соединение 2 молекул 5-аминолевулиновой
кислоты молекулу порфобилиногена (рис.
13-4), дезаминированиепорфобилиногена с
образованием гидроксиметилбилана,
ферментативное превращение
гидроксиметилбилана в молекулу
уропор-фобилиногена III, декарбоксилирование
последнего с образованием копропорфириногена
III. Гидроксиметилбилан может также
нефермента-тивно превращаться в
уропорфириноген I, который декарбоксилируется
в копропорфирино-ген I. Из цитоплазмы
копропорфириноген III опять поступает
в митохондрии, где проходят заключительные
реакции синтеза гема. В результате двух
последовательных окислительных реакций
копропорфириноген III превращается в
протопорфириноген IX, а протопорфириноген
IX — в Протопорфирин IX. Фермент феррохела-таза,
присоединяя к протопорфирину IX
двухвалентноелентное железо, превращает
его в гем (рис. 13-2). Источником железа
для синтеза гема служит депонирующий
железо белок ферритин. Синтезированный
гем, соединяясь с α и β-полипепептидными
цепями глобина, образует гемоглобин.
Гем регулирует синтез глобина: при
снижении скорости синтеза гема синтез
глобина в ретикулоцитах тормозится.
Донором
железа служит депонирующий железо в
клетках белок ферритин.

Рис.
13-3. Реакция образования 5-аминолевулиновой
кислоты.
Регуляция
биосинтеза гема
Регуляторную
реакцию синтеза гема катализирует
пиридоксальзависимый фермент
аминолевулинатсинтаза. Скорость реакции
регулируется аллостерически и на уровне
трансляции фермента.
Аллостерическим
ингибитором и корепрессором синтеза
аминолевулинатсинтазы является гем
(рис. 13-5).
В
ретикулоцитах синтез этого фермента
на этапе трансляции регулирует железо.
На участке инициации мРНК, кодирующей
фермент, имеется последовательность
нуклеотидов, образующая шпилечную
петлю, которая называется железочувствительным
элементом (от англ, iron-responsiveelement, IRE)
(рис. 13-6).
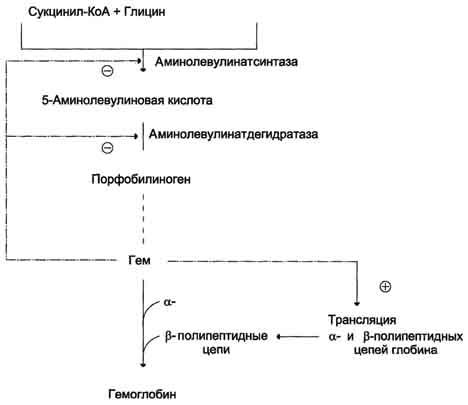
Рис.
13-5. Регуляция синтеза гема и гемоглобина. Гем
по принципу отрицательной обратной
связи ингибирует аминолевулинатсинтазу
и аминолевулинатдегидратазу и является
индуктором трансляции α- и β-цепей
гемоглобина.
При
высоких концентрациях железа в клетках
оно образует комплекс с остатками
цистеина регуляторного железосвязывающего
белка. Взаимодействие железа с регуляторным
железосвязывающим белком вызывает
снижение сродства этого белка к
IRE-элементу мРНК, кодирующей
аминолевулинатсинтазу, и продолжение
трансляции (рис. 13-6, А). При низких
концентрациях железа железосвязывающий
белок присоединяется к железо-чувствительному
элементу, находящемуся на 5′-нетранслируемом
конце мРНК, и трансляция аминолевулинатсинтазы
тормозится (рис. 13-6, Б).
Аминолевулинатдегидратаза
также аллостерически ингибируется
гемом, но так как активность этого
фермента почти в 80 раз превышает
активность аминолевулинатсинтазы, то
это не имеет большого физиологического
значения.
Дефицит
пиридоксальфосфата и лекарственные
препараты, которые являются его
структурными аналогами, снижают
активность аминолевулинатсинтазы.
Альфа-полипептидная
цепь заканчивается комбинацией
аминокислот валина-лейцина, а
бета-полипептидная цепь — комбинацией
валина-гистидина-лейцина. Альфа- и
бета-полипептидные цепи в гемоглобиновой
молекуле не размещены линейно, как это
выглядит на первый взгляд из данных,это
первичная структура .
Гемоглобинопатии
группа наследственных гемолитических
анемий, обусловленных нарушениями
первичной структуры гемоглобина
(качественные гемоглобинопатии) или
синтеза глобиновых цепей (количественные
гемоглобинопатии).
Соседние файлы в папке экз
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Синтез гемоглобина. Регуляция биосинтеза гемоглобина.


Мы поможем в написании ваших работ!

Мы поможем в написании ваших работ!

Мы поможем в написании ваших работ!
ЗНАЕТЕ ЛИ ВЫ?
Гем является небелковой частью многих гемопротеинов:
· гемоглобин (до 85% общего количества гема организма), локализованный в эритроцитах и клетках костного мозга,
· миоглобин скелетных мышц и миокарда (17%),
· цитохромы дыхательной цепи,
· ферменты цитохромоксидаза, цитохром P450, гомогентизатоксидаза, пероксидаза, миелопероксидаза, каталаза, тиреопероксидаза и т.д. – менее 1%.
Синтез гема в основном идет в предшественниках эритроцитов, клетках печени, почек, слизистой кишечника, и в остальных тканях. Первая реакция синтеза с участием δ-аминолевулинат-синтазы (греч. δ — «дельта») происходит в митохондриях. Следующая реакция при участии аминолевулинатдегидратазы (порфобилиноген-синтазы) протекает в цитозоле. Здесь из двух молекул δ‑аминолевулиновой кислоты образуется циклический порфобилиноген (монопиррол).
После синтеза порфобилиногена четыре его молекулы конденсируются с образованием уропорфириногена (тетрапиррол). Их различают два вида — уропорфириноген типа I и уропорфириноген типа III. В синтезе обоих видов порфиринов принимает участие уропорфириноген I-синтаза, в образования уропорфириногена III дополнительно принимает участие фермент уропорфириноген III-косинтаза. Судьба обоих типов уропорфириногена двояка: они могут окисляться до уропорфирина или декарбоксилироваться до копропорфириногена соответствующего типа. Копропорфириноген III превращается либо в копропорфирин III, либо идет на синтез протопорфирина IX.
Копропорфириноген III окисляется в протопорфириноген IX и далее в протопорфирин IX. Последний после связывания с железом образует гем, реакцию катализирует феррохелатаза (гемсинтаза). Названия пигментов (уропорфирины и копропорфирины) были даны веществам по источнику их первоначального выделения, при этом восстановленные бесцветные формы называют порфириногенами. Для порфиринов характерно наличие изомерии вследствие различного расположения радикалов.
Регуляция синтеза гема.
1. Скорость синтеза глобиновых цепей зависит от наличия гема, он ускоряет биосинтез «своих» белков.
2. Основным регуляторным ферментом синтеза гема является аминолевулинатсинтаза.
· гем после взаимодействия с молекулой белка-репрессора формирует активный репрессорный комплекс, связывается с ДНК и подавляет транскрипцию, мРНК для фермента не образуется и синтез фермента прекращается. Также имеется отрицательный аллостерический эффект гема на фермент.
· с другой стороны, достаточное количество ионов железа оказывает положительный эффект при синтезе молекулы аминолевулинатсинтазы. В клетке имеется особый железосвязывающий белок, который в отсутствии ионов железа обладает сродством к мРНК фермента и блокирует ее трансляцию в рибосоме, т.е. синтез белковой цепи. Ионы железа связываются с этим железосвязывающим белком, образуя с ним неактивный комплекс, что инициирует синтез фермента.
3. Положительным модулятором аминолевулинатсинтазы служит гипоксия тканей, которая в эритропоэтических тканях индуцирует синтез фермента.
4. В печени повышение активности аминолевулинатсинтазы вызывают соединения, усиливающие работу микросомальной системы окисления (жирорастворимые токсины, стероиды) – при этом возрастает потребление гема для образования цитохрома Р450, что снижает внутриклеточную концентрацию свободного гема. В результате происходит дерепрессия синтеза фермента.
70. Схема распада гемоглобина.Основная часть желчных пигментов образуется при распаде гема и гемоглобина в клетках ретикулоэндотелиальной системы (РЭС) и представляет собой многоступенчатый процесс: при окислении гемоглобина образуется вердоглобин; после отщепления глобина и железа образуется биливердин, который далее восстанавливается до билирубина. Билирубин — желто-красный пигмент, представляющий собой линейный тетрапиррол, токсичное, жирорастворимое вещество, способное нарушать окислительное фосфорилирование в клетках, в первую очередь в нервной ткани. В крови билирубин либо находится в свободном состоянии, либо в комплексе с альбумином (частично в виде альбумин-фосфатидного комплекса), в меньшем количестве — в комплексах с металлами, аминокислотами, пептидами и другими малыми молекулами. Образование таких комплексов предотвращает выделение билирубина с мочой. Такая форма билирубина называется свободной (неконъюгированной, несвязанной, непрямой). Она не дает прямой реакции с диазореактивом Эрлиха.
Из сосудистого русла в гепатоциты билирубин попадает с помощью белка-переносчика (лигандина). В печени, при участии фермента УДФ‑глюкуронилтрансферазы, происходит реакция этерификации — взаимодействие OH‑группы глюкуроновой кислоты с карбоксильными группами билирубина и образование конъюгированного (связанного, прямого) билирубина, представляющего собой парное соединение с одним или двумя остатками глюкуроновой кислоты (моно- или диглюкуронид). Кроме глюкуроновой кислоты в реакцию могут вступать сульфаты, фосфаты, глюкозиды. В норме конъюгированный билирубин активно секретируется в желчные капилляры, где при участии β‑глюкуронидазы, вновь превращается в свободный билирубин и с током желчи попадает в тонкий кишечник. Здесь ферментами бактериальной флоры он восстанавливается до мезобилирубина и мезобилиногена (уробилиногена). Часть последних всасывается и с током крови вновь попадает в печень, где окисляется до ди‑ и трипирролов. При этом в здоровом организме в общий круг кровообращения и в мочу мезобилирубин и уробилиноген не попадают, а полностью задерживаются гепатоцитами. Невсосавшаяся часть пигментов ферментами бактериальной флоры толстого кишечника восстанавливается до стеркобилиногена и выделяется из организма, окрашивая кал. Незначительное количество стеркобилиногена через геморроидальные вены попадает в большой круг кровообращения, отсюда –– в почки и выделяется с мочой. На воздухе стеркобилиноген и уробилиноген превращаются, соответственно, в стеркобилин и уробилин.
Источник
Биосинтез и распад гемоглобина
Тема 3 (вопрос 4 и 5).
Гем состоит из иона двухвалентного железа и порфирина. В основе структуры порфиринов находится порфин. Порфин представляет собой четыре пиррольных кольца, связанных между собой метеновыми мостиками. С наибольшей скоростью гем синтезируется в костном мозге (для синтеза гемоглобина ретикулоцитами) и в печени (для образования цитохрома Р-450).
Синтез гема происходит в несколько стадий:
1. На первой стадии в митохондриях сукцинил-КоА взаимодействует с глицином с образованием δ-аминолевулиновой кислоты. Эту реакцию катализирует специфический пиридоксальзависимый фермент δ-аминолевулинатсинтаза. Фермент активируется стероидами и ингибируется по типу обратной связи конечным продуктом — гемом. Продукт реакции из матрикса митохондрий переходит в цитозоль.
2. На второй стадии, в цитозоле, происходит конденсация 2-х молекул
δ-аминолевулиновой кислоты с образованием порфобилиногена. Фермент — порфобилиногенсинтаза — ингибируется конечным продуктом.
3. Из 4-х молекул порфобилиногена синтезируется протопорфирин IX, являющийся предшественником гема.
4. Протопорфирин IX присоединяет молекулу Fe при участии феррохелатазы (гемсинтаза) и образуется гем. Источником железа в этой реакции является белок ферритин, который депонирует железо.
Механизм регуляции синтеза тема в неэритроидных клетках имеет определенные отличия. Так, в клетках печени, где синтез гема происходит на высоком уровне, гем является отрицательным регулятором синтеза δ-аминолевулинатсинтазы по механизму репрессии-депрессии в процессе транскрипции. Главный регуляторный эффект гема состоит в том, что синтез фермента значительно ускоряется в отсутствии гема и замедляется в его присутствии.
Синтез белковой части гемоглобина происходит на рибосомах. Цепи α и β глобина синтезируются на полисомах, образованных, как правило, пятью рибосомами. Цепь α освобождается первой, присоединяется к β-цепи, еще связанной с рибосомой и отделяет ее, образуя димер αβ. Два димера соединяются в молекулу гемоглобина α2β2.
Соединение гема с глобином может происходить или в процессе синтеза полипептидных цепей, или после окончания синтеза глобина. Синтез полипептидных цепей происходит только в присутствии гема. При низкой концентрации гема синтез глобина замедляется. Отсюда следует, что синтез гема и глобина происходит координировано и ни один из этих компонентов не образуется в избыточном или недостаточном количестве.
Катаболизм гемоглобина
Эритроциты имеют короткое время жизни (примерно 120 дней). При физиологических условиях в организме взрослого человека разрушается около 1 — 2×1011 эритроцитов в сутки. Их катаболизм происходит, главным образом, в ретикулоэндотелиальных клетках селезёнки (РЭС), лимфатических узлов, костного мозга и печени. При распаде гемоглобина образуется билирубин. Билирубин является основным желчным пигментом у человека. При распаде 1 г гемоглобина образуется 35 мг билирубина, а в сутки у взрослого человека – примерно 250-350 мг. Дальнейший метаболизм билирубина происходит в печени.
Билирубин, образованный в клетках РЭС селезёнки и костного мозга, называется свободным (неконьюгированным)или непрямым, поскольку вследствие плохой растворимости в воде он легко адсорбируется на белках плазмы крови (альбуминах) и для его определения в крови необходимо предварительное осаждение белков спиртом. После этого билирубин определяют реакцией с диазореактивом Эрлиха. Свободный (непрямой) билирубин не проходит через почечный барьер и в мочу не попадает.
Каждая молекула альбумина связывает 2 (или 3) молекулы билирубина. При низком содержании альбумина в крови, а также при вытеснении билирубина из центров связывания на поверхности альбумина высокими концентрациями жирных кислот, лекарственных веществ (например, сульфаниламиды) увеличивается количество билирубина, не связанного с альбуминами. Он может проникать в клетки мозга и повреждать их.

Комплекс альбумин-билирубин с током крови попадает в печень, где происходит его превращение в прямой билирубин путем коньюгации с глюкуроновой кислотой. Реакцию катализирует УДФ-глюкуронилтрансфераза. Образующийся билирубиндиглюкуронид получил название прямого(коньюгированного) билирубина или связанного. Он растворим в воде и дает прямую реакцию с диазореактивом Эрлиха.
Прямой билирубин – это нормальный компонент желчи, попадающий в кровь в незначительном количестве. Он может проходить через почечный барьер, но в крови в норме его мало, поэтому в моче обычными лабораторными методами он не определяется.
Вместе с желчью прямой билирубин выводится в тонкий кишечник. В кишечнике билирубинглюкурониды гидролизуются специфическими бактериальными ферментами β-глюкуронидазами. Освободившийся билирубин под действием кишечной микрофлоры восстанавливается с образованием сначала мезобилирубина, а затем мезобилиногена(уробилиногена). Небольшая часть уробилиногенов, всасываясь в тонком кишечнике и верхнем отделе толстого, через систему воротной вены попадает в печень, где практически полностью разрушается до дипиррольных соединений. Уробилиноген при этом в общий кровоток не поступает и в моче не определяется.
Основная часть уробилиногена поступает в толстый кишечник, где под влиянием микрофлоры подвергается дальнейшему восстановлению с образованием стеркобилиногена. Образовавшийся стеркобилиноген почти полностью выделяется с калом. На воздухе он окисляется и превращается в стеркобилин, являющийся одним из пигментов кала. Небольшая часть стеркобилиногена попадает путем всасывания через слизистую толстого кишечника в систему нижней полой вены (через геморроидальные вены), доставляется в почки и выводится с мочой (4 мг/сутки).
Источник