Синтез гемоглобина в печени
Содержание статьи
Какую роль в организме играет гемоглобин и что значит, если он повышен или понижен?
Цифры напротив символа Hb, или гемоглобина, в бланке с результатами общего анализа крови могут раскрыть врачу причины низкого давления, головокружения, судорог ног пациента, а также оповестить о надвигающихся серьезных угрозах. Своевременное выявление отклонений и приведение концентрации гемоглобина в норму позволит избежать серьезных проблем со здоровьем. Речь идет о снижении рисков инфарктов и инсультов у людей в возрасте, патологий развития детей, ухудшения состояния матери и плода во время беременности.
Что такое гемоглобин и каковы его функции
Гемоглобин (Hb) — сложный железосодержащий белок, содержащийся в эритроцитах (красных кровяных тельцах) крови и частично присутствующий в свободном виде в плазме. Именно он осуществляет перенос кислорода от легких к клеткам и углекислого газа — в обратном направлении. Если говорить образно, то эритроцит — это своеобразное грузовое судно, курсирующее по кровяному руслу, а молекулы гемоглобина — контейнеры, в которых транспортируется кислород и углекислый газ. В норме один эритроцит вмещает порядка 400 млн молекул гемоглобина.
Участие в газообмене — важнейшая, но не единственная функция «кровяных шаров» (от греч. haima — «кровь» + лат. globus — «шар»). Благодаря своим уникальным химическим свойствам гемоглобин является ключевым элементом буферной системы крови, поддерживающим кислотно-щелочной баланс в организме. Hb связывает и выводит на клеточном уровне кислые соединения (препятствует ацидозу — закислению тканей и крови). А в легких, куда он поступает в форме карбгемоглобина (HbCO2), за счет синтеза углекислоты предотвращает противоположный процесс — защелачивание крови, или алкалоз[1].
Производная Hb — метгемоглобин (HbOH) — обладает еще одним полезным свойством: прочно связывать синильную кислоту и другие токсичные вещества. Таким образом, железосодержащий белок принимает удар на себя и снижает степень отравления организма[2].
Итак, гемоглобин крайне важный элемент жизнедеятельности и патологическое уменьшение его концентрации (анемия или малокровие) может спровоцировать в лучшем случае ломкость ногтей и волос, сухость и шелушение кожи, мышечные судороги, тошноту и рвоту, головокружение. Острая же форма анемии вызывает кислородное голодание клеток, приводящее к обморокам, галлюцинациям и фатальным последствиям — гипоксии мозга, атрофии нервных клеток, параличу дыхательной системы.
Как должно быть в норме
Уровень гемоглобина в нашей крови может несколько увеличиваться и уменьшаться по естественным причинам. Обновление гемоглобина связано с жизненным циклом эритроцита, к которому он прикреплен. Так, примерно каждые 120 дней часть молекул гемоглобина вместе с эритроцитами отправляется в печень — на расщепление и после вновь синтезируется, присоединяясь к свободному эритроциту[3].
Количество гемоглобина зависит от возраста и пола, меняется в процессе вынашивания и рождения ребенка[4].
На гемоглобин также оказывают влияние специфические условия труда или проживания (например, повышенные показатели бывают у пилотов и жителей гористой местности), приверженность вегетарианству и донорство (эти факторы, напротив, снижают гемоглобин)[5].
Согласно рекомендациям ВОЗ[6], нормой гемоглобина считается:
- для детей от полугода до 5 лет — 110 г/л и выше;
- для детей 5-11 лет — 115 г/л и больше;
- для детей 12-14 лет, а также девушек и женщин (15 лет и старше) — 120 г/л и выше;
- для мужчин (15 лет и старше) — 130-160 г/л.
Беременным женщинам, обеспечивающим минералами (в том числе железом) себя и малыша, важно следить, чтобы уровень гемоглобина не падал ниже 110 г/л. Отметим, что, по данным ВОЗ, железодефицитная анемия (ЖДА) диагностируется у 38,2% беременных на планете[7]. Дефицит молекул гемоглобина может возникнуть после 20-й недели «интересного положения»: из-за увеличения объема циркулирующей крови, растущих потребностей плода, уменьшения поступления и всасывания железа вследствие токсикоза и расстройств ЖКТ. В это время женщину может мучить слабость, головокружение, одышка даже при непродолжительной ходьбе, судороги нижних конечностей. Опасное следствие острых форм ЖДА — преждевременные роды, задержки в развитии плода.
Кстати, необычные вкусовые запросы беременных (вплоть до анекдотичных, таких как салат из жареной клубники и селедки) порой тоже связаны с потребностью в железе для синтеза гемоглобина. Роды, сопровождающиеся потерей крови, ведут к дополнительному понижению гемоглобина. В целом от зачатия до появления ребенка на свет организм женщины утрачивает порядка 700 мг железа, еще 200 мг — за период лактации[8]. На восстановление запасов требуется не менее трех лет.
Виды анализов на гемоглобин
Подсчет числа молекул гемоглобина производится при общем анализе крови. Помимо количества белка (строка Hb), в бланке анализа могут указать MCH/MCHC, что соответствует среднему содержанию/концентрации гемоглобина в эритроците. Это уточнение позволяет подсчитать полезный железопротеин и исключить из расчета аномальные, нестабильные формы гемоглобина, не способные переносить кислород.
Для измерения гемоглобина во внелабораторных условиях — в машинах скорой помощи или при проведении профилактических выездных осмотров — применяются специальные гемоглобинометры. Это портативные приборы, в которые помещается кровь с реагентом для фотометрического автоматического определения количества гемоглобина.
Для массового тестирования на анемию в странах третьего мира ВОЗ разработала малозатратный колорометрический метод исследования. При колориметрии каплю крови наносят на специальную хроматографическую бумагу и сопоставляют ее со шкалой цветов, соответствующих разным показателям гемоглобина с шагом 20 г/л[9].
Уровень гликированного гемоглобина определяется и при биохимическом анализе венозной крови. Цель исследования в данном случае — определение глюкозы в крови, которая образует прочное соединение с гемоглобином и лишает его возможности транспортировать кислород. Показатель важен для диагностики сахарного диабета и оценки эффективности его лечения.
Чем опасен повышенный гемоглобин в крови
Высокий гемоглобин может быть вызван объективной нехваткой кислорода, стимулирующей организм на увеличенное производство этого белка крови. Подобная патология часто фиксируется у экипажей воздушных судов и часто летающих пассажиров, жителей высокогорья, альпинистов, горнолыжников. В силу большей потребности в кислороде повышенный уровень гемоглобина свойственен профессиональным спортсменам, преимущественно лыжникам, легкоатлетам, борцам, тяжелоатлетам. Это физиологический механизм компенсации, не вызывающий никаких медицинских опасений (кавказское долголетие — яркий тому пример).
Повысить гемоглобин может и пагубная привычка: во время курения человек вдыхает меньше кислорода, чем требуется, и организм реагирует на это выработкой дополнительного гемоглобина.
К сожалению, повышенный гемоглобин может указывать и на патологии системы кроветворения: эритроцитоз, рак крови, обезвоживание организма, порок сердца и легочно-сердечную недостаточность, а также на непроходимость кишечника[10].
Увеличенное количество гликированного гемоглобина отмечается при сахарном диабете: часть молекул Hb «перетягивает» на себя глюкозу, и для нормального дыхания требуются добавочные кислородные «контейнеры»[11].
Повышенный свободный гемоглобин в плазме фиксируется и при ожоговых поражениях вследствие разрушения эритроцитов с высвобождением из них гемоглобина[12].
Опасность высокого гемоглобина (+20 г/л от нормы и более) заключается в сгущении и увеличении вязкости крови, приводящему к образованию тромбов. Тромбы, в свою очередь, могут вызвать инсульт, инфаркт, кровотечение в ЖКТ или венозный тромбоз[13].
Гемоглобин ниже нормы: что это значит и к чему приводит
Железо — один из самых распространенных и легко добываемых химических элементов на Земле. При этом, как ни парадоксально, от дефицита железа в организме страдает больше людей, чем от какого-либо другого нарушения здоровья[14]. В группе риска население из низких социальных слоев, не получающее достаточного количества железа из продуктов питания, женщины репродуктивного возраста и дети, то есть люди, у которых «приход» элемента меньше «расхода».
Причиной низкого уровня гемоглобина (минус 20 г/л от нормы и более) зачастую являются скудное или несбалансированное питание — недостаточное поступление железа и меди, витаминов A, С и группы B или употребление железосодержащей пищи совместно с цинком, магнием, хромом или кальцием, которые не позволяют Fe усваиваться[15].
Низкие показатели могут наблюдаться у вегетарианцев, т.к. негемовое железо из растительной пищи усваивается намного хуже, чем гемовое, источником которого служат продукты животного происхождения[16].
Смежная причина — наличие кишечных паразитов, которые перехватывают поступающие микроэлементы и витамины. Усвоению железа могут также мешать проблемы с желудочно-кишечным трактом.
Заметное снижение уровня гемоглобина сопровождает кровопотери, вызванные ранениями, оперативным вмешательством, менструацией, кровотечениями, возникающими во время родов и абортов, а также при донации крови и ее компонентов.
На уровень гемоглобина влияют и скрытые кровопотери при патологии ЖКТ (язвы желудка и ДКП), варикозе, миомах и кистах органов женской половой системы, кровоточивость десен.
Причины снижения гемоглобина, возникающие во время беременности и лактации, а также осложнения, к которым они могут привести, мы рассмотрели выше. Длительный железодефицит у мужчин, детей и небеременных женщин имеют сходную симптоматику: ухудшение состояния кожи, ногтей и волос, головокружение, обмороки, онемение рук и ног, беспричинная слабость.
Кислородное голодание вследствие недостатка гемоглобина может привести к ухудшению памяти, замедлению нервных реакций, в запущенной форме — к атрофии клеток мозга и других органов и систем организма.
Усиленное кровообращение (более частый прогон гемоглобина от легких к тканям и обратно) чревато проблемами с сердцем и сосудами: кардиомиопатией и развитием сердечной недостаточности.
Низкий гемоглобин негативно отражается на буферной функции: это значит, что закисление крови подрывает иммунную защиту организма, снижает сопротивляемость простудным и инфекционным заболеваниям.
Наиболее уязвимы перед анемией дети и подростки. Острый дефицит жизненно важного минерала может сказаться на их умственном и физическом развитии[17].
Гемоглобин — незаменимый участник жизнедеятельности, на который возложены важнейшие функции: перенос кислорода и углекислого газа, сохранение кислотно-щелочного баланса, противостояние ядам. Еще одна функция — сигнальная — помогает по отклонению уровня гемоглобина от нормы выявить риски развития патологий и принять контрмеры. Таким образом, контроль и оперативная коррекция уровня гемоглобина — не прихоть врачей, а действенный способ сохранить здоровье.
Источник
42. Гемоглобин. Строение. Синтез и распад гемоглобина. Формы билирубина. Пути выведения билирубина и других желчных пигментов. Желтухи.
Гемоглобин входит в состав группы белков гемопротеины, которые сами являются подвидом хромопротеинов и подразделяются на неферментативные белки (гемоглобин, миоглобин) и ферменты (цитохромы, каталаза, пероксидаза). Небелковой частью их является гем — структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями.
Строение гемоглобина. Гемоглобин представляет собой белок, включающий 4 гемсодержащие белковые субъединицы. Между собой протомеры соединяются гидрофобными, ионными, водородными связями по принципу комплементарности. При этом они взаимодействуют не произвольно, а определенным участком — контактной поверхностью. Этот процесс высокоспецифичен, контакт происходит одновременно в десятках точек по принципу комплементарности. Взаимодействие осуществляют разноименно заряженные группы, гидрофобные участки, неровности на поверхности белка. Белковые субъединицы в нормальном гемоглобине могут быть представлены различными типами полипептидных цепей: α, β, γ, δ, ε, ξ (соответственно, греч. — альфа, бета, гамма, дельта, эпсилон, кси). В состав молекулы гемоглобина входят по две цепи двух разных типов. Гем состоит из иона двухвалентного железа и порфирина. В основе структуры порфиринов находится порфин. Порфин представляет собой четыре пиррольных кольца, связанных между собой метеновыми мостикамиГем соединяется с белковой субъединицей, во-первых, через остаток гистидина координационной связью железа, во-вторых, через гидрофобные связи пиррольных колец и гидрофобных аминокислот. Гем располагается как бы «в кармане» своей цепи и формируется гемсодержащий протомер.
Существует несколько нормальных вариантов гемоглобина:
HbР — примитивный гемоглобин, содержит 2ξ- и 2ε-цепи, встречается в эмбрионе между 7-12 неделями жизни,
HbF — фетальный гемоглобин, содержит 2α- и 2γ-цепи, появляется через 12 недель внутриутробного развития и является основным после 3 месяцев,
HbA — гемоглобин взрослых, доля составляет 98%, содержит 2α- и 2β-цепи, у плода появляется через 3 месяца жизни и к рождению составляет 80% всего гемоглобина,
HbA2 — гемоглобин взрослых, доля составляет 2%, содержит 2α- и 2δ-цепи,
HbO2 — оксигемоглобин, образуется при связывании кислорода в легких, в легочных венах его 94-98% от всего количества гемоглобина,
HbCO2 — карбогемоглобин, образуется при связывании углекислого газа в тканях, в венозной крови составляет 15-20% от всего количества гемоглобина.
Патологические формы гемоглобина
HbS — гемоглобин серповидно-клеточной анемии.
MetHb — метгемоглобин, форма гемоглобина, включающая трехвалентный ион железа вместо двухвалентного. Такая форма обычно образуется спонтанно, в этом случае ферментативных мощностей клетки хватает на его восстановление. При использовании сульфаниламидов, употреблении нитрита натрия и нитратов пищевых продуктов, при недостаточности аскорбиновой кислоты ускоряется переход Fe2+ в Fe3+. Образующийся metHb не способен связывать кислород и возникает гипоксия тканей. Для восстановления ионов железа в клинике используют аскорбиновую кислоту и метиленовую синь.
Hb-CO — карбоксигемоглобин, образуется при наличии СО (угарный газ) во вдыхаемом воздухе. Он постоянно присутствует в крови в малых концентрациях, но его доля может колебаться от условий и образа жизни. Угарный газ является активным ингибитором гем-содержащих ферментов, в частности, цитохромоксидазы 4-го комплекса дыхательной цепи.
HbA1С — гликозилированный гемоглобин. Концентрация его нарастает при хронической гипергликемии и является хорошим скрининговым показателем уровня глюкозы крови за длительный период времени.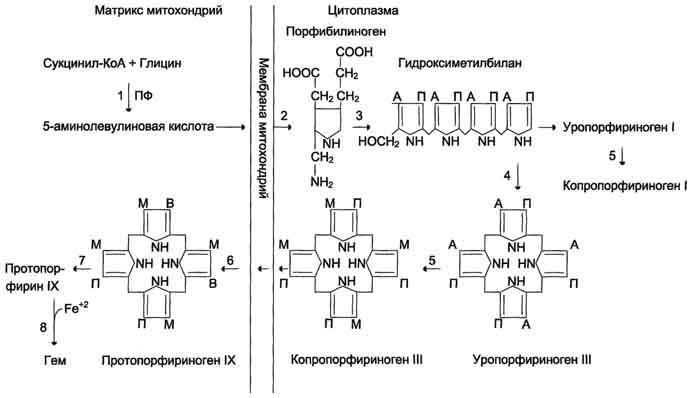
Биосинтез гема. Гем является небелковой частью многих гемопротеинов:
гемоглобин (до 85% общего количества гема организма), локализованный в эритроцитах и клетках костного мозга,
миоглобин скелетных мышц и миокарда (17%),
цитохромы дыхательной цепи и P450, цитохромоксидаза, гомогентизатоксидаза, пероксидаза, миелопероксидаза, каталаза, тиреопероксидаза и т.д. — менее 1%. Синтез гема в основном идет в предшественниках эритроцитов, клетках печени, почек, слизистой кишечника, и в остальных тканях. Первая реакция синтеза с участием δ-аминолевулинат-синтазы происходит в митохондриях. Следующая реакция при участии аминолевулинатдегидратазы (порфобилиноген-синтазы) протекает в цитозоле.Гем синтезируется во всех тканях, но с наибольшей скоростью в костном мозге и печени. В костном мозге гем необходим для синтеза гемоглобина в ретикулоцитах, в гепатоцитах — для образования цитохрома Р450.
Первая реакция синтеза гема — образование 5-аминолевулиновой кислоты из глицина и сук-цинил-КоА идёт в матриксе митохондрий, где в ЦТК образуется один из субстратов этой реакции — сукцинил-КоА. Эту реакцию катализирует пиридоксальзависимый фермент аминолевулинатсинтаза. Из митохондрий 5-аминолевулиновая кислота поступает в цитоплазму. В цитоплазме проходят промежуточные этапы синтеза гема: соединение 2 молекул 5-аминолевулиновой кислоты молекулу порфобилиногена, дезаминирование порфобилиногена с образованием гидроксиметилбилана, ферментативное превращение гидроксиметилбилана в молекулу уропор-фобилиногена III, декарбоксилирование последнего с образованием копропорфириногена III. Гидроксиметилбилан может также нефермента-тивно превращаться в уропорфириноген I, который декарбоксилируется в копропорфирино-ген I. Из цитоплазмы копропорфириноген III опять поступает в митохондрии, где проходят заключительные реакции синтеза гема. В результате двух последовательных окислительных реакций копропорфириноген III превращается в протопорфириноген IX, а протопорфириноген IX — в Протопорфирин IX. Фермент феррохела-таза, присоединяя к протопорфирину IX двухвалентное лентное железо, превращает его в гем. Источником железа для синтеза гема служит депонирующий железо белок ферритин. Синтезированный гем, соединяясь с α и β-полипепептидными цепями глобина, образует гемоглобин. Гем регулирует синтез глобина: при снижении скорости синтеза гема синтез глобина в ретикулоцитах тормозится. 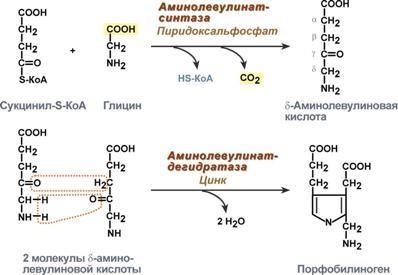
Регуляция синтеза гема
1. Скорость синтеза глобиновых цепей зависит от наличия гема, он ускоряет биосинтез «своих» белков.
2. Основным регуляторным ферментом синтеза гема является аминолевулинатсинтаза.
гем после взаимодействия с молекулой белка-репрессора формирует активный репрессорный комплекс, связывается с ДНК и подавляет транскрипцию, мРНК для фермента не образуется и синтез фермента прекращается. Также имеется отрицательный аллостерический эффект гема на фермент.
с другой стороны, достаточное количество ионов железа оказывает положительный эффект при синтезе молекулы аминолевулинатсинтазы. В клетке имеется особый железосвязывающий белок, который в отсутствии ионов железа обладает сродством к мРНК фермента и блокирует ее трансляцию в рибосоме, т.е. синтез белковой цепи. Ионы железа связываются с этим железосвязывающим белком, образуя с ним неактивный комплекс, что инициирует синтез фермента.
3. Положительным модулятором аминолевулинатсинтазы служит гипоксия тканей, которая в эритропоэтических тканях индуцирует синтез фермента.
4. В печени повышение активности аминолевулинатсинтазы вызывают соединения, усиливающие работу микросомальной системы окисления (жирорастворимые токсины, стероиды) — при этом возрастает потребление гема для образования цитохрома Р450, что снижает внутриклеточную концентрацию свободного гема. В результате происходит дерепрессия синтеза фермента.
Распад. За сутки у человека распадается около 9 г гемопротеинов, в основном это гемоглобин эритроцитов. Эритроциты живут 90-120 дней, после чего лизируются в кровеносном русле или в селезенке. При разрушении эритроцитов в кровяном русле высвобождаемый гемоглобин образует комплекс с белком-переносчиком гаптоглобином (фракция α2-глобулинов крови) и переносится в клетки ретикуло-эндотелиальной системы (РЭС) селезенки (гл образом), печени и костного мозга.
Первая реакция катаболизма гема происходит при участии NADPH-зависимого ферментативного комплекса гемоксигеназы. Ферментная сисгема локализована в мембране ЭР, в области электронтранспортных цепей микросомального окисления. Фермент катализирует расщепление связи между двумя пиррольными кольцами, содержащих винильные остатки, — таким образом, раскрывается структура кольца. В ходе реакции образуются линейный тетрапир-рол — биливердин (пигмент жёлтого цвета) и монооксид углерода (СО), который получается из углерода метениловой группы. Гем индуцирует транскрипцию гена гемоксигеназы, абсолютно специфичной по отношению к тему.
Ионы железа, освободившиеся при распаде гема, могут быть использованы для синтеза новых молекул гемоглобина или для синтеза других железосодержащих белков. Биливердин восстанавливается до билирубина NADPH-зависимым ферментом биливердинредуктазой. Билирубин образуется не только при распаде гемоглобина, не также при катаболизме других гемсодержащю белков, таких как цитохромы и миоглобин. При распаде 1 г гемоглобина образуется 35 мг билирубина, а в сутки у взрослого человека — примерно 250-350 мг билирубина. Дальнейший метаболизм билирубина происходит в печени.
В клетках РЭС гем в составе гемоглобина окисляется молекулярным кислородом. В реакциях последовательно происходит разрыв метинового мостика между 1-м и 2-м пиррольными кольцами гема с их восстановлением, отщеплением железа и белковой части и образованием оранжевого пигмента билирубина. Билирубин — токсичное, жирорастворимое вещество, способное нарушать окислительное фосфорилирование в клетках. Особенно чувствительны к нему клетки нервной ткани. Из клеток ретикуло-эндотелиальной системы билирубин попадает в кровь. Здесь он находится в комплексе с альбумином плазмы, в гораздо меньшем количестве — в комплексах с металлами, аминокислотами, пептидами и другими малыми молекулами. Образование таких комплексов не позволяет выделяться билирубину с мочой. Билирубин в комплексе с альбумином называется свободный (неконъюгированный) или непрямой билирубин. Из сосудистого русла в гепатоциты билирубин попадает с помощью белка-переносчика (лигандина). В клетке протекает реакция связывания билирубина с УДФ-глюкуроновой кислотой, при этом образуются моно- и диглюкурониды. Кроме глюкуроновой кислоты, в реакцию могут вступать сульфаты, фосфаты, глюкозиды. Билирубин-глюкуронид получил название связанный (конъюгированный) или прямой билирубин. После образования билирубин-глюкурониды АТФ-зависимым переносчиком секретируются в желчные протоки и далее в кишечник, где при участии бактериальной β-глюкуронидазы превращаются в свободный билирубин. Одновременно некоторое количество билирубин-глюкуронидов может попадать (особенно у взрослых) из желчи в кровь по межклеточным щелям. Таким образом, в крови в норме одновременно существуют две формы билирубина: свободный, попадающий сюда из клеток РЭС (около 80% всего количества), и связанный, попадающий из желчных протоков (до 20%). Превращение в кишечнике. В кишечнике билирубин подвергается восстановлению под действием микрофлоры до мезобилирубина и мезобилиногена (уробилиногена). Часть последних всасывается и с током крови вновь попадает в печень, где окисляется до ди- и трипирролов. При этом в здоровом организме в общий круг кровообращения и в мочу мезобилирубин и уробилиноген не попадают, а полностью задерживаются гепатоцитами. Оставшаяся в кишечнике часть пигментов ферментами бактериальной флоры толстого кишечника восстанавливается до стеркобилиногена и выделяется из организма, окрашивая кал. Незначительное количество стеркобилиногена через геморроидальные вены попадает в большой круг кровообращения, отсюда в почки и выделяется с мочой. На воздухе стеркобилиноген и уробилиноген превращаются, соответственно, в стеркобилин и уробилин. Ситуации, при которых в крови накапливается билирубин, в зависимости от причины делятся на три вида: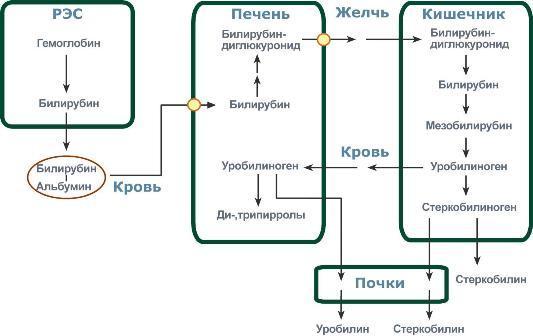
1.Гемолитические — в результате гемолиза при избыточном превращении гемоглобина в билирубин,
2.Печеночно-клеточные — когда печень не в состоянии обезвредить билирубин,
3.Механические — если билирубин не может попасть из печени в кишечник из-за механического перекрытия желчевыводящих путей.
Накопление билирубина в крови свыше 43 мкмоль/л ведет к связыванию его эластическими волокнами кожи и конъюнктивы, что проявляется в виде желтухи. Так как свободный билирубин липофилен, то он легко накапливается в подкожном жире и нервной ткани. Последнее особенно опасно для детей, особенно для новорожденнных.
Гемолитическая или надпеченочная желтуха — ускоренное образование билирубина в результате усиления внутрисосудистого гемолиза. К данному типу желтух относятся гемолитические анемии различного происхождения: врожденный сфероцитоз, серповидно-клеточная анемия, дефицит глюкозо-6-фосфатдегидрогеназы, отравление сульфаниламидами, талассемии, сепсис, лучевая болезнь, несовместимость крови. В данном случае гипербилирубинемия развивается за счет фракции непрямого билирубина. Гепатоциты усиленно переводят непрямой билирубин в связанную форму, секретируют его в желчь, в результате в кале увеличивается содержание стеркобилина, интенсивно его окрашивая. В моче возрастает содержание уробилина, билирубин отсутствует.У новорожденных гемолитическая желтуха может развиться как симптом гемолитической болезни новорожденного.
Механическая или подпеченочная желтуха развивается вследствие снижения оттока желчи при непроходимости желчного протока — желчные камни, новообразования поджелудочной железы, гельминтозы. В результате застоя желчи происходит растяжение желчных капилляров, увеличивается проницаемость их стенок. Не имеющий оттока в кишечник прямой билирубин поступает в кровь, в результате развивается гипербилирубинемия. В тяжелых случаях, вследствие переполнения гепатоцитов прямым билирубином, реакция конъюгации с глюкуроновой кислотой может нарушаться, присоединяется печеночно-клеточная желтуха (см ниже). В результате в крови увеличивается концентрация непрямого билирубина. В моче резко увеличен уровень билирубина (цвет темного пива) и снижено количество уробилина, практически отсутствует стеркобилин кала (серовато-белое окрашивание).
Паренхиматозная (печеночно-клеточная) желтуха — причиной может быть нарушение на всех трех стадиях превращения билирубина в печени: извлечение билирубина из крови печеночными клетками, его конъюгирование и секреция в желчь. Наблюдается при вирусных и других формах гепатитов, циррозе и опухолях печени, жировой дистрофии печени, при отравлении токсическими гепатотропными веществами, при врожденных патологиях. Так как нарушаются все процессы превращения билирубина в печени, гипербилирубинемия развивается за счет обеих фракций, преимущественно прямого билирубина. Концентрация его возрастает из-за нарушения секреции в желчь и увеличения проницаемости мембран клеток печени. Количество непрямого билирубина возрастает за счет функциональной недостаточности гепатоцитов и/или снижения их количества. В моче определяется билирубин (цвет крепкого черного чая), умеренно увеличена концентрация уробилина, уровень стеркобилина кала в норме или снижен.
Гемолитическая болезнь новорожденного.Причины: Несовместимость крови матери и плода по группе или по резус-фактору. Накопление гидрофобной формы билирубина в подкожном жире обуславливает желтушность кожи. Однако реальную опасность представляет накопление билирубина в сером веществе нервной ткани и ядрах ствола с развитием «ядерной желтухи» (билирубиновая энцефалопатия).
Клиническая диагностика: Проявляется сонливостью, плохим сосанием, умственной отсталостью, ригидностью затылочных мышц, тоническими судорогами, тремором конечностей, изменением рефлексов с возможным развитием глухоты и параличей.
Физиологическая (транзиторная) желтуха новорожденных. Причины:относительное снижение активности УДФ-глюкуронилтрансферазы в первые дни жизни, связанное с повышенным распадом фетального гемоглобина,абсолютное снижение активности УДФ-глюкуронилтрансферазы в первые дни жизни,дефицит лигандина,слабая активность желчевыводящих путей.Клиническая диагностика:окрашивание кожи на 3-4 день после рождения,гемолиза и анемии нет.Симптомы исчезают спустя 1-2 недели после рождения.
Желтуха недоношенных.Причины: относительное снижение активности УДФ-глюкуронилтрансферазы в первые дни жизни, связанное с повышенным распадом фетального гемоглобина,абсолютное снижение активности УДФ-глюкуронилтрансферазы в первые дни жизни,дефицит лигандина,слабая активность желчевыводящих путей.Клиническая диагностика:окрашивание кожи,гемолиза и анемии нет. Исчезает спустя 3-4 недели после рождения.
Источник