Синтез холестерина что это такое
Содержание статьи
Холестерол: что это такое и о чем говорит его повышенный уровень в крови?
Холестерол, или холестерин, — об этом веществе слышал, наверное, каждый современный человек. Многие рекламные ролики, транслируемые в СМИ, с гордостью сообщают о том, что предлагаемый ими продукт не содержит холестерина. Значит, это вещество опасно для человека? Или все-таки полезно? Давайте разбираться вместе.
Синтез холестерола и роль его фракций в организме человека
Холестерол, или холестерин , — это органическое соединение, очень важный компонент жирового обмена, необходимый для жизнедеятельности человека. Около 80% объемов этого вещества организм синтезирует самостоятельно. Происходит это в печени и в кишечнике. Остальное количество поступает с пищей, именно поэтому нам необходимы в разумных порциях продукты животного происхождения (жирное мясо, яйца, сливочное масло, печень и другие).
Роль холестерола в организме очень велика. Во-первых, он необходим для синтеза стероидов (к ним относятся и половые гормоны) и гормонов коры надпочечников. Во-вторых, с помощью холестерола вырабатывается витамин D. В-третьих, это вещество выстраивает основу всех клеточных мембран. Если холестерола в организме достаточно, клетки хорошо функционируют, а вот если его не хватает, начинаются различные расстройства. Кроме того, холестерол необходим для нормальной работы нервной и иммунной систем.
Это интересно
Дословно «холестерин» переводится так: «холе» — желчь, «стерин» — жирный. В 1859 году М. Бертло доказал, что холестерин принадлежит к классу спиртов, после чего соединение переименовали в холестерол. Однако в ряде языков, в том числе и в русском, сохранилось первое название — холестерин. В ХХ веке за изучение холестерина и его свойств было присуждено тринадцать Нобелевских премий.
Помимо общего холестерола выделяют его фракции, которые состоят из собственно холестерола и белка, обеспечивающего его транспортировку. Такое соединение называют липопротеином. Существует три класса липопротеинов. Они различаются составом компонентов и их пропорциями.
- ЛПВП — это липопротеины высокой плотности. Они хорошо растворимы в воде и не выпадают в осадок. ЛПВП доставляют холестерол от клеток разных органов в печень. Там он синтезируется в желчные кислоты и выводится из организма через кишечник. Таким образом ЛПВП выводит излишки холестерола из организма, поэтому данное соединение называют «хорошим холестеролом».
- ЛПНП — это сокращенное название главного «транспортного средства» холестерола: липопротеинов низкой плотности. Данное соединение доставляет общий холестерол в ткани и органы. Однако когда это вещество в организме скапливается в избыточном количестве, возникает риск появления сердечно-сосудистых заболеваний. Поэтому ЛПНП называют «плохим холестеролом».
- ЛПОНП , или липопротеины очень низкой плотности, — транспортируют триглицериды из печени в периферические ткани. Норма этой фракции холестерола в организме очень мала. Если ее количество превышается, возникает вероятность развития атеросклероза. Поэтому ЛПОНП по аналогии с ЛПНП также можно назвать «плохим холестеролом».
Уровень холестерина в норме
Узнать свой уровень общего холестерола и его фракций можно с помощью лабораторных анализов. Для исследования берется кровь из вены. Чтобы результаты анализов были точными, следует накануне сдачи крови исключить физические и эмоциональные перегрузки, воздержаться от алкоголя, соблюдать привычный режим питания, не принимать пищу за 12 часов до сдачи анализа.
Уровень общего холестерина у мужчин и женщин с возрастом меняется. Нормой его содержания в организме считаются следующие показатели:
Возраст | Пол | Уровень | Уровень | Уровень |
< 5 лет | Мужчина (М) | 2,95–5,25 | 0,78–1,68 | 1,63–3,34 |
Женщина (Ж) | 2,90–5,18 | 0,78–1,68 | 1,76–3,63 | |
5–10 лет | М | 3,13–5,25 | 0,8–2,8 | 1,63–3,34 |
Ж | 3,26–5,30 | 0,8–2,8 | 1,76–3,63 | |
10–15 лет | М | 3,08–5,23 | 0,73–1,93 | 1,66–3,44 |
Ж | 3,21–5,20 | 0,80–2,18 | 1,76–3,52 | |
15–40 лет | М | 3,57–6,58 | 0,70–1,73 | 2,02–4,79 |
Ж | 3,37–5,96 | 0,86–2,23 | 1,81–4,04 | |
40–60 лет | М | 4,09–7,17 | 0,78–1,81 | 2,51–5,23 |
Ж | 4,20–7,38 | 0,78–2,20 | 2,05–4,82 | |
> 60 лет | М | 4,09–7,10 | 0,78–2,28 | 2,54–5,44 |
Ж | 4,43–7,85 | 0,78–2,20 | 2,38–5,72 |
Что касается содержания ЛПОНП в крови, то мы уже говорили, что объем этого соединения в организме невелик. Пределами нормы считается показатель 0,26–1,04 ммоль/л для разных возрастных групп обоих полов. Более конкретно интерпретировать этот результат может только врач, исходя из клинической картины и индивидуальных особенностей пациента.
Причины повышенного холестерола
Повышение общего холестерола в крови может быть вызвано самыми разными причинами. Например, нарушением здорового питания и чрезмерным употреблением жирной пищи животного происхождения. Также повышение этого показателя наблюдается у курильщиков и алкоголиков. Выход концентрации холестерина за пределы нормы может быть обусловлен рядом наследственных заболеваний, таких как семейная гиперхолестеринемия и семейная дисбеталипопротеинемия. Кроме того, холестерин обычно повышается при атеросклерозе, ишемической болезни сердца, болезнях печени и почек, подагре, сахарном диабете, гипотиреозе и многих других патологиях. Увеличивается количество содержания общего холестерина и во время беременности.
Повышение ЛПВП и ЛПНП обычно наблюдается при перечисленных выше заболеваниях, а также при ожирении, почечной недостаточности, синдроме Кушинга, нервной анорексии.
Повышение ЛПОНП , как правило, возникает во время гиперлипидемии, гликогенозы, болезни Нимана-Пика, системной красной волчанке.
Чтобы понизить содержание холестерина в крови, следует ограничить потребление жирной пищи, отказаться от курения и алкоголя, избегать стрессов. Однако если увеличение концентрации этого вещества в организме связано не с нарушениями здорового образа жизни, а с заболеваниями, то помочь здесь может только врач, подобрав необходимый курс лечения.
Причины пониженного холестерола
Общий холестерин обычно снижается при голодании и несбалансированных диетах, при острых инфекциях, синдроме мальабсорбции, обширных ожогах, сепсисе, хронической сердечной недостаточности, мегалобластической анемии, туберкулезе легких, во время терминальной стадии цирроза печени, болезни Танжера и при ряде других заболеваний.
Понижение ЛПВП сопровождает такие болезни, как атеросклероз, гипо- и а-альфа-липопротеинемия, холестаз, хронические заболевания печени, нефротический синдром, хроническая почечная недостаточность.
Уменьшение содержания ЛПНП происходит, как правило, при следующих болезнях: гипо- и а-бета-липопротеинемия, дефицит ЛХАТ, синдром Рейе, хронические анемии, хронические заболевания легких, артриты, тяжелые стрессы.
Понижение ЛПОНП не имеет существенного клинического значения. Однако иногда может наблюдаться при острых инфекционных и воспалительных заболеваниях, наследственных патологиях.
Таким образом, выход за пределы нормы показателя общего холестерина и его фракций может быть вызван самыми разными причинами. Изменения в питании и образе жизни во многом способствуют нормализации этих показателей. Однако о необходимости терапии и причинах нарушения нормы может судить только врач. Чтобы контролировать уровень холестерина и его фракций, следует регулярно проходить тест на их содержание в крови.
Источник
Синтез холестерола должен быть согласован с его выведением
Синтез холестерола в организме составляет примерно 0,5-0,8 г/сут, примерно 50% образуется в печени, около 15% в кишечнике. Все клетки организма способны синтезировать холестерол. Поступление с пищей составляет около 0,4 г/сут.
Единственным реальным способом выведения холестерола является желчь – до 1 г/сут.
Биосинтез холестерола
Биосинтез холестерола происходит в эндоплазматическом ретикулуме. Источником всех атомов углерода в молекуле является ацетил-SКоА, поступающий сюда из митохондрий в составе цитрата, также как при синтезе жирных кислот. При биосинтезе холестерола затрачивается 18 молекул АТФ и 13 молекул НАДФН.
Образование холестерола идет более чем в 30 реакциях, которые можно сгруппировать в несколько этапов.
1. Синтез мевалоновой кислоты.
Первые две реакции синтеза совпадают с реакциями кетогенеза, но после синтеза 3-гидрокси-3-метилглутарил-SКоА вступает в действие фермент гидроксиметил-глутарил-SКоА-редуктаза (ГМГ-SКоА-редуктаза), образующая мевалоновую кислоту.
2. Синтез изопентенилдифосфата. На этом этапе при использовании АТФ мевалоновая кислота трижды фосфорилируется. Затем промежуточный продукт декарбоксилируется и дефосфорилируется с получением изопентенилдифосфата.
3. После объединения трех молекул изопентенилдифосфата (если не считать промежуточных превращений) синтезируется фарнезилдифосфат.
4. Синтез сквалена происходит при связывания двух остатков фарнезилдифосфата.
5. После сложных реакций линейный сквален циклизуется в ланостерол.
6. Удаление лишних метильных групп, восстановление и изомеризация молекулы приводит к появлению холестерола.
Регуляция синтеза
Регуляторным ферментом является гидроксиметилглутарил-SКоА-редуктаза, активность которой может изменяться в 100 и более раз.
1. Метаболическая регуляция – по принципу обратной отрицательной связи фермент аллостерически ингибируется конечным продуктом реакции – холестеролом. Это помогает поддерживать внутриклеточное содержание холестерола постоянным.
2. Регуляция транскрипции гена ГМГ-SКоА-редуктазы (в печени) – холестерол и желчные кислоты подавляют считывание гена и уменьшают количество фермента.
3. Ковалентная модификация при гормональной регуляции:
- Инсулин, активируя протеин-фосфатазу, способствует переходу фермента в активное состояние.
Важным следствием такой регуляции является активация кетогенеза при отсутствии инсулина.
- Глюкагон и адреналин посредством аденилатциклазного механизма активируют протеинкиназу А, которая фосфорилирует фермент и переводит его в неактивную форму.
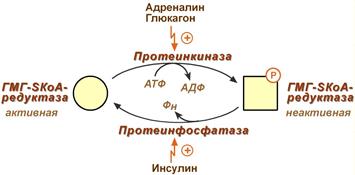
Регуляция активности гидроксиметилглутарил-S-КоА-редуктазы
Кроме указанных гормонов, на ГМГ-SКоА-редуктазу действуют эстрогены и тиреоидные гормоны (повышают активность) и глюкокортикоиды (снижают активность).
Изменение транскрипции гена ГМГ-КоА редуктазы (генетическая регуляция) осуществляется стерол-регулируемым элементом в ДНК (SREBP, sterol regulatory element-binding protein) с которым способны связываться белки — факторы SREBP. Эти факторы при достаточном количестве холестерина в клетке закреплены в мембране ЭПР. Когда уровень холестерина падает, факторы SREBP активируются под действием специфичных протеаз комплекса Гольджи, передвигаются в ядро, взаимодействуют на ДНК с участком SREBP и стимулируют биосинтез холестерина.
Скорость биосинтеза холестерола также зависит от концентрации специфического белка-переносчика, обеспечивающего связывание и транспорт гидрофобных промежуточных метаболитов синтеза.
Источник
Биосинтез холестерина
Биосинтез холестерина — образование в живом организме органического спирта холестерина стероидной природы. Синтез холестерина происходит в клетках печени (50 %), кишечнике и коже. В клетке он идёт в гладком эндоплазматическом ретикулуме и цитозоле. Биосинтез холестерина служит основой синтеза других стероидных соединений.
Начальные этапы синтеза являются общими с этапами синтеза других изопреноидов.
Нумерация атомов в молекуле холестерина
В 1940-е годы Блох с сотр. установил, что все атомы углерода холестерина происходят из ацетата, причём оба атома включаются в одинаковых количествах. В настоящее время установлена следующая цепь биосинтеза холестерина, включающая в себя несколько ступеней. (Образование промежуточных соединений этого пути может происходить и другими способами).
- Превращение трёх молекул активного ацетата в пятиуглеродный мевалонат.
- Превращение мевалоната в активный изопреноид — изопентенилпирофосфат.
- Образование тридцатиуглеродного изопреноида сквалена из шести молекул изопентенилдифосфата.
- Циклизация сквалена в ланостерин.
- Последующее превращение ланостерина в холестерин.
Синтез мевалоната
Синтез мевалоната протекает в три этапа.
- Образование ацетоацетил-КоА из двух молекул ацетил-КоА с помощью тиолазного фермента ацетоацетилтрансферазы. Реакция обратима. Происходит в цитозоле.
- Образование β-гидрокси-β-метилглутарил-КоА из ацетоацетил-коА с третьей молекулой ацетил-КоА с помощью гидроксиметилглутарил-КоА-синтазы (ГМГ-КоА-синтазы). Реакция также обратима. Происходит в цитозоле.
- Образование мевалоната восстановлением ГМГ и отщеплением HS-KoA с помощью НАДФ-зависимой гидроксиметилглутарил-КоА-редуктазы (ГМГ-КоА-редуктаза). Происходит в гЭПР. Это первая практически необратимая реакция в цепи биосинтеза холестерина, а также она лимитирует скорость биосинтеза холестерина. Отмечены суточные колебания синтеза этого фермента. Активность его увеличивается при введении инсулина и тиреоидных гормонов, снижается при голодании, введении глюкагона, глюкокортикоидов.
Схема этапа:
Существуют и другие пути синтеза мевалоната.
Синтез изопентенилпирофосфата
1, 2. Вначале мевалоновая кислота дважды фосфорилируется с помощью АТФ: до 5-фосфомевалоната, а затем до 5-пирофосфомевалоната.
3. 5-пирофосфомевалонат фосфорилируется по 3 атому углерода, образуя нестабильный промежуточный продукт — 3-фосфо-5-пирофосфомевалонат.
4. Последний декарбоксилируется и дефосфорилируется, образуется изопентенилпирофосфат.
Синтез сквалена
- Изопентенилпирофосфат изомеризуется в диметилаллилпирофосфат.
- Конденсация изопентенилпирофосфата (С5) с диметилаллилпирофосфатом (С5) и образование геранилпирофосфата (С10). При этом высвобождается молекула пирофосфата.
- Конденсация изопентенилпирофосфата (С5) с геранилпирофосфатом (С10). Образуется фарнезилпирофосфат (С15) и высвобождается ещё одна молекула пирофосфата.
- Конденсация двух молекул фарнезилпирофосфата (С15) «голова-к-голове» и образование сквалена (С30). Реакция проходит с затратой НАДФН, и высвобождаются две молекулы пирофосфата. Молекулы фарнезилпирофосфата конденсируются концами, несущими пирофосфатные группы. Сначала отщепляется одна пирофосфатная группа и образуется промежуточный прескваленпирофосфат. Он, в свою очередь, восстанавливается с помощью НАДФН. Второй пирофосфат уходит. Образуется сквален.
Начиная со сквалена, продукты пути биосинтеза холестерина нерастворимы в водной среде и участвуют в дальнейших реакциях, будучи связанными со стеринпереносящими белками (СПБ).
Синтез ланостерина
1. Под действием скваленэпоксидазы образуется эпоксид сквалена.
2. Затем эпоксид сквалена циклизуется в ланостерин. При этом метильная группа у С14 переносится на С13, а метильная группа у С8 — на С14.
Синтез холестерина
Ланостерин превращается в мембранах гладкого эндоплазматического ретикулума в холестерин.
- Метильная группа при С14 окисляется, и образуется 14-десметилланостерин.
2. Затем удаляются ещё два метила при С4, и образуется зимостерол.
3. Далее двойная связь C8=С9 перемещается в положение С8=С7 и образуется Δ7,24-холестадиенол.
4. Двойная связь далее перемещается в положение С5=С6,образуется десмостерол.
5. После чего в боковой цепи восстанавливается двойная связь, и образуется холестерин.
(Восстановление двойной связи в боковой цепи может, однако, происходить и на предшествующих стадиях биосинтеза холестерола.)
Другие пути синтеза
У некоторых организмов при синтезе стероидов могут встречаться другие варианты реакций (например, немевалонатный путь образования пятиуглеродных молекул).
Литература
- Химическая энциклопедия сайта www.humuk.ru. Скан учебника «Биологическая химия», Берёзов Т. Т., Коровкин Б. Ф.
- Кольман Я., Рём К.-Г., «Наглядная биохимия», пер. с нем., М., «Мир», 2009.
- Марри Р., Греннер Д., Мейес П., Родуэлл В., «Биохимия человека». М., «Мир», 1993.
Эта страница в последний раз была отредактирована 4 мая 2020 в 10:27.
Источник
ХОЛЕСТЕРИНОВЫЙ ОБМЕН
ХОЛЕСТЕРИНОВЫЙ ОБМЕН (греческий chole желчь + stereos твердый) — совокупность реакций биосинтеза холестерина (см.) и его распада в организме человека и животных. В организме человека за сутки около 500 мг холестерина окисляется в желчные кислоты, примерно такое же количество стеринов экскретируется с фекалиями, около 100 мг выделяется с кожным салом, небольшое количество холестерина (около 40 мг) используется для образования кортикоидных и половых гормонов, а также витамина D3, 1—2 мг холестерина выводится с мочой. У кормящих женщин с грудным молоком выделяется 100— 200 мг холестерина в сутки. Эти потери восполняются за счет синтеза холестерина в организме (у взрослого человека в сутки около 700—1000 мг) и поступления его с пищей (300— 500 мг). Холестерин, а также часть холестерина, поступившего в просвет кишечника с желчью, всасывается в тонкой кишке в форме жировых мицелл (см. Жировой обмен). Эфиры холестерина предварительно гидролизуются при действии холестеринэстеразы (см.) панкреатического и кишечного соков. В стенке тонкой кишки холестерин используется для образования хиломикронов (см. Липопротеиды), в составе которых он поступает сначала в лимфатическую систему, а затем в кровяное русло.
В капиллярах жировой и некоторых других тканей в результате воздействия на хиломикроны липопротеид-липазы образуются частицы, обогащенные эфирами холестерина и фосфолипидами, получившие название ремнантных (остаточных) частиц. Эти частицы задерживаются в печени, где подвергаются распаду. Освободившийся при этом холестерин наряду с холестерином, синтезированным в печени, образует так называемый общий пул печеночного холестерина, который используется по мере необходимости для образования липопротеидов (см.).
Установлено, что у человека и некоторых животных липопротеиды низкой плотности транспортируют холестерин в органы и ткани, причем захват липоиротеидных частиц клетками этих органов и тканей осуществляется при участии специфических рецепторов. Холестерин, доставленный в клетку в составе липопротеидных частиц, идет на покрытие потребностей клетки (образование мембран при делении клетки, синтез стероидных гормонов и др.). Избыточная часть неэтерифицированного (свободного) холестерина превращается в его эфиры при действии содержащегося в клетке фермента — холестеролацилтрансферазы (КФ 2.3.1.26). Обратный транспорт неэтерифицированного холестерина из различных органов и тканей в печень осуществляется липопротеидами высокой плотности, причем в кровяном русле происходит этерификация захваченного холестерина при участии лецитина и фермента холестерин-лецитин — ацилтрансферазы (КФ 2.3.1.43). Доставленный таким путем в печень холестерин идет на образование желчных кислот (см.).
Синтез холестерина

Общая схема биосинтеза холестерина
Синтез холестерина осуществляется в клетках почти всех органов и тканей, однако в значительных количествах он образуется в печени (80%), стенке тонкой кишки (10%) и коже (5%). К. Блох, Ф. Линен и др. показали основные реакции биосинтеза холестерина (их не менее 30). Сложный процесс биосинтеза холестерина можно разделить на три стадии: 1) биосинтез мевалоновой кислоты; 2) образование сквалена из мевалоновой кислоты; 3) циклизация сквалена и образование холестерина (см. схему).
Считают, что главным источником образования мевалоновой кислоты в печени является ацетил-КоА, а в мышечной ткани — лейцин. И то и другое соединения в результате ряда энзиматических реакций образуют бета-гидрокси-бета-метилглутарил-КоА (ГМГ-КоА), который затем восстанавливается в мевалоновую кислоту. В последнее время показано, что в синтез мевалоновой кислоты в печени может включаться и малонил-КоА.
Реакцией, определяющей скорость биосинтеза холестерина в целом, является восстановление ГМГ-КоА в мевалоновую кислоту; этот процесс катализирует фермент НАДФ-Н2-зависимая ГМГ-КоА-редуктаза (КФ 1.1.1.34). Именно этот фермент подвержен воздействиям со стороны ряда факторов. Так, активность ГМГ-КоА-редуктазы повышается (или содержание ее в печени возрастает) и скорость синтеза холестерина в целом увеличивается при действии ионизирующего излучения, введении тиреоидных гормонов, поверхностно-активных веществ, холестирамина, а также при гипофизэктомии. Угнетение синтеза холестерина отмечается при голодании, тиреоидэктомии и при поступлении в организм пищевого холестерина. Последний угнетает активность (или синтез) фермента ГМГ-КоА-редуктазы.
Синтез холестерина в стенке тонкой кишки регулируется исключительно концентрацией желчных кислот. Так, отсутствие их в кишечнике при наличии наружного желчного свища ведет к повышению синтеза холестерина в тонкой кишке в 5—10 раз.
На второй стадии синтеза происходит фосфорилирование мевалоновой кислоты при участии АТФ и образование нескольких фосфорилированные промежуточных продуктов (см. Фосфорилирование). При декарбоксилировании одного из них образуется изопентенил-пирофосфат, часть которого превращается в диметилаллил-пирофосфат. Взаимодействие этих двух соединений приводит к образованию димера — геранил-пирофосфата, содержащего 10 атомов углерода. Геранил-пирофосфат конденсируется с новой молекулой изопентенил-пирофосфата и образует тример — фарнезил-пирофосфат, содержащий 15 атомов углерода. Эта реакция идет с отщеплением молекулы пирофосфата. Затем две молекулы фарнезил-пирофосфата конденсируются, теряя каждая свой пирофосфат, и образуют гексамер сквален, содержащий 30 атомов углерода.
Третья стадия синтеза включает окислительную циклизацию сквалена, сопровождающуюся миграцией двойных связей и образованием первого циклического соединения — ланостерина. Ланостерин уже имеет гидроксильную группу в положении 3 и три лишние (по сравнению с холестерином) метильные группы. Дальнейшее превращение ланосте-рина может совершаться двумя путями, причем и в том и в другом случае промежуточными продуктами являются соединения стериновой природы. Более доказанным считается путь через 24, 25-дигидроланостерин и ряд других стеринов, включая 7-дигидрохолестерин, служащий непосредственным предшественником холестерина. Другой возможный путь — превращение ланостерина в зимостерин, а затем в десмостерин, из которого при восстановлении образуется холестерин.
Если суммировать общий итог всех реакций биосинтеза холестерина, то он может быть представлен в следующем виде:
18CH3CO-S-KoA + 10(H+) + 1/2O2 —> C27H46O + 9CO2 + 18KoA-SH. Источником углерода холестерина является ацетил-КоА (им может быть также малонил-КоА и лейцин), источником водорода — вода и никотин-амида дениндинуклеотидфосфат, а источником кислорода — молекулярный кислород.
Начиная со сквалена и кончая холестерином все промежуточные продукты биосинтеза нерастворимы в водной среде, поэтому они участвуют в конечных реакциях биосинтеза холестерина в связанном со сквален или стеринпереносящими белками состоянии. Это позволяет им растворяться в цитоплазме клетки и создает условия для протекания соответствующих реакций. Холестерин-переносящий белок обеспечивает также перемещение стеринов внутри клетки, что имеет важное значение для вхождения его в мембрану клетки, а также для транспорта в клеточные системы, осуществляющие катаболизм холестерина.
Катаболизм холестерина протекает в печени (окисление его в желчные кислоты), в надпочечниках и плаценте (образование из холестерина стероидных гормонов), в тестикулярной ткани и яичниках (образование половых гормонов). При биосинтезе холестерина в коже на завершающей стадии образуется небольшое количество 7-дегидрохолестерина. Под влиянием УФ-лучей он превращается в витамин D3.
Своеобразные превращения претерпевает холестерин в толстой кишке. Речь идет о той части пищевого холестерина или холестерина, поступившего в кишечник с желчью, которая не подверглась всасыванию. Под влиянием микробной флоры толстой кишки происходит восстановление холестерина и образование так наз. нейтральных стеринов. Главным их представителем является копростерин. Экспериментальные исследования, проведенные с использованием радиоизотопных и других методов, показали, что скорость обновления холестерина в различных органах и тканях неодинакова; наиболее высока она в надпочечниках и печени и чрезвычайно низка в мозге взрослых животных.
Патология холестеринового обмена
Нарушения холестеринового обмена обычно связаны с дисбалансом между количеством синтезируемого в организме и поступающего с пищей холестерина, с одной стороны, и количеством холестерина, подвергающегося катаболизму,— с другой. Эти нарушения проявляются в изменении уровня холестерина в плазме крови, которые классифицируются как гиперхолестеринемия или гипохолестеринемия (для взрослого населения высокоразвитых стран величины выше 270 мг/100 мл и ниже 150 мг/100 мл соответственно).
Гиперхолестеринемия может быть первичной (наследственной или алиментарной) и вторичной, обусловленной различными заболеваниями. Наследственная (семейная) гиперхолестеринемия характеризуется высоким уровнем холестерина и липопротеидов низкой плотности (ЛПНГЛ в плазме крови. При гомозиготной гиперхолестеринемии уровень холестеринемии может достигать 700— 800 мг/100 мл, а при гетерозиготной — 300—500 мг/100 мл. В основе наследственной гиперхолестеринемии лежит генетически обусловленное отсутствие (у гомозигот) или недостаток (у гетерозигот) специфических рецепторов к липопротеидам низкой плотности у клеток, вследствие чего резко снижается захват и последующий катаболизм этих богатых холестерином липопротеидов клетками паренхиматозных органов и тканей. В результате пониженного захвата и снижения катаболизма липопротеидов низкой плотности развивается гиперхолестеринемия (см.). Последняя приводит к раннему развитию атеросклероза (см.) и его клинических проявлений — ишемической болезни сердца (см.), преходящей ишемии мозга (см. Инсульт) и др. Особенно тяжело протекает атеросклероз при гомозиготной форме; у таких больных часто наблюдается ксантоматоз (см.), липоидная дуга роговицы (отложение холестерина в роговицу глаз), инфаркт миокарда в юношеском возрасте.
Распространенность гомозиготной формы гиперхолестеринемии невелика (примерно один случай на 1 млн. жителей). Чаще встречается гетерозиготная форма — один случай на 500 жителей.
Алиментарная гиперхолестеринемия характеризуется повышенным уровнем холестерина в плазме крови вследствие длительного потребления больших количеств пищи, богатой холестерином (куриные желтки, икра, печень, животные жиры и др.). Алиментарная гиперхолестеринемия той или иной степени выраженности характерна для жителей высокоразвитых индустриальных стран. Согласно популяционным исследованиям имеется прямая зависимость между уровнем холестерина в крови и распространенностью ишемической болезни сердца.
В эксперименте на различных животных (кролики, морские свинки, обезьяны) показано, что введение массивных доз холестерина с пищей приводит к резко выраженной гиперхолестеринемии и быстрому развитию атеросклероза. Экспериментальные модели гиперхолестеринемии и атеросклероза, впервые предложенные H. Н. Аничковым и С. С. Халатовым (1913), широко используются в научных исследованиях.
Вторичная гиперхолестеринемия встречается при гипотиреозе (см.), сахарном диабете (см. Диабет сахарный), нефротическом синдроме (см.), подагре (см.) и др. и нередко сопровождается развитием атеросклероза (см. Гиперхолестеринемия).
Выделяют первичную и вторичную гипохолестеринемию. Первичная гипохолестеринемия характерна для наследственного заболевания — абеталипопротеинемии (см.). При этой болезни отмечается почти полное отсутствие в плазме крови липопротеидов низкой плотности (у гомозигот) или значительное их снижение (у гетерозигот). Уровень общего холестерина не превышает 75 мг/ 100 мл. Гомозиготная форма болезни протекает исключительно тяжело. В основе абеталипопротеинемии лежит генетически обусловленное нарушение синтеза апопротеина В — главного белка липопротеидов низкой плотности.
Вторичные гипохолестеринемии наблюдаются при кахексии, гипертиреоидизме, аддисоновой болезни и паренхиматозных заболеваниях печени, при ряде инфекционных болезней и интоксикациях (см. Гипохолестеринемия). При недостаточной активности в плазме крови фермента лецитин — холестерин -ацилтрансферазы, или ЛХАТ (наследственная ЛXАТ-недостаточность), ответственного за этерификацию холестерина плазмы, наблюдается накопление неэтерифицированного холестерина в мембранах эритроцитов и клетках почек, печени, селезенки, костного мозга, роговицы глаза. Резко снижается доля этерифицированного холестерина в плазме крови и одновременно повышается уровень неэтерифицированного холестерина и лецитина. У больных с наследственной ЛXAT-недостаточностыо стенки артерий и капилляров подвержены деструктивным изменениям, что связано с отложением в них липидов. Наиболее тяжелые изменения происходят в сосудах почечных клубочков, что приводит к развитию почечной недостаточности (см.).
Одним из распространенных нарушений холестериновый обмен. является образование желчных камней, основной составной частью которых является холестерин (см. Желчнокаменная болезнь). Образование желчных камней происходит вследствие выкристаллизовывания холестерина при относительно высокой его концентрации в желчи и относительно низкой концентрации в ней желчных кислот и фосфолипидов, обладающих способностью растворять холестерин. Исследования показали, что имеется прямая связь между уровнем холестерина в плазме крови и распространенностью холестероза (см.) и желчнокаменной болезни.
Библиогр.: Климов А. Н, и Н икульчева Н. Г. Липопротеиды, дислипопротеидемии и атеросклероз, Л., 1984; Полякова Э. Д. Пути биосинтеза холестерина в печени и их регуляция, в кн.: Липиды, структура,биосинтез, превращения и функции, под ред. С. Е. Северина, с. 131, М., 1977;она же, Регуляция содержания холестерина в клетке, в кн.: Биохимия липидов и их роль в обмене веществ, под ред.С. Е. Северина, с. 120, М., 1981; Финагин Л. К. Обмен холестерина и его регуляция, Киев, 1980; Lipids and lipidoses, ed. by G. Schettler, B.— Heidelberg, 1967; Sodhi H. S., Kudchod-k a r B. J. a. Mason D. T. Clinical methods in study of cholesterol metabolism, Basel a. o., 1979.
A. H. Климов
Источник