Синтез холестерина из ацетил коа
Содержание статьи
Синтез холестерола должен быть согласован с его выведением
Синтез холестерола в организме составляет примерно 0,5-0,8 г/сут, примерно 50% образуется в печени, около 15% в кишечнике. Все клетки организма способны синтезировать холестерол. Поступление с пищей составляет около 0,4 г/сут.
Единственным реальным способом выведения холестерола является желчь – до 1 г/сут.
Биосинтез холестерола
Биосинтез холестерола происходит в эндоплазматическом ретикулуме. Источником всех атомов углерода в молекуле является ацетил-SКоА, поступающий сюда из митохондрий в составе цитрата, также как при синтезе жирных кислот. При биосинтезе холестерола затрачивается 18 молекул АТФ и 13 молекул НАДФН.
Образование холестерола идет более чем в 30 реакциях, которые можно сгруппировать в несколько этапов.
1. Синтез мевалоновой кислоты.
Первые две реакции синтеза совпадают с реакциями кетогенеза, но после синтеза 3-гидрокси-3-метилглутарил-SКоА вступает в действие фермент гидроксиметил-глутарил-SКоА-редуктаза (ГМГ-SКоА-редуктаза), образующая мевалоновую кислоту.
2. Синтез изопентенилдифосфата. На этом этапе при использовании АТФ мевалоновая кислота трижды фосфорилируется. Затем промежуточный продукт декарбоксилируется и дефосфорилируется с получением изопентенилдифосфата.
3. После объединения трех молекул изопентенилдифосфата (если не считать промежуточных превращений) синтезируется фарнезилдифосфат.
4. Синтез сквалена происходит при связывания двух остатков фарнезилдифосфата.
5. После сложных реакций линейный сквален циклизуется в ланостерол.
6. Удаление лишних метильных групп, восстановление и изомеризация молекулы приводит к появлению холестерола.
Регуляция синтеза
Регуляторным ферментом является гидроксиметилглутарил-SКоА-редуктаза, активность которой может изменяться в 100 и более раз.
1. Метаболическая регуляция – по принципу обратной отрицательной связи фермент аллостерически ингибируется конечным продуктом реакции – холестеролом. Это помогает поддерживать внутриклеточное содержание холестерола постоянным.
2. Регуляция транскрипции гена ГМГ-SКоА-редуктазы (в печени) – холестерол и желчные кислоты подавляют считывание гена и уменьшают количество фермента.
3. Ковалентная модификация при гормональной регуляции:
- Инсулин, активируя протеин-фосфатазу, способствует переходу фермента в активное состояние.
Важным следствием такой регуляции является активация кетогенеза при отсутствии инсулина.
- Глюкагон и адреналин посредством аденилатциклазного механизма активируют протеинкиназу А, которая фосфорилирует фермент и переводит его в неактивную форму.
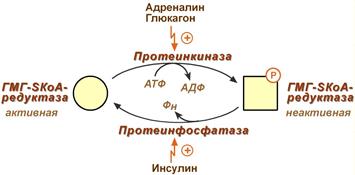
Регуляция активности гидроксиметилглутарил-S-КоА-редуктазы
Кроме указанных гормонов, на ГМГ-SКоА-редуктазу действуют эстрогены и тиреоидные гормоны (повышают активность) и глюкокортикоиды (снижают активность).
Изменение транскрипции гена ГМГ-КоА редуктазы (генетическая регуляция) осуществляется стерол-регулируемым элементом в ДНК (SREBP, sterol regulatory element-binding protein) с которым способны связываться белки — факторы SREBP. Эти факторы при достаточном количестве холестерина в клетке закреплены в мембране ЭПР. Когда уровень холестерина падает, факторы SREBP активируются под действием специфичных протеаз комплекса Гольджи, передвигаются в ядро, взаимодействуют на ДНК с участком SREBP и стимулируют биосинтез холестерина.
Скорость биосинтеза холестерола также зависит от концентрации специфического белка-переносчика, обеспечивающего связывание и транспорт гидрофобных промежуточных метаболитов синтеза.
Источник
ХОЛЕСТЕРИНОВЫЙ ОБМЕН — Большая Медицинская Энциклопедия
ХОЛЕСТЕРИНОВЫЙ ОБМЕН (греческий chole желчь + stereos твердый) — совокупность реакций биосинтеза холестерина (см.) и его распада в организме человека и животных. В организме человека за сутки около 500 мг холестерина окисляется в желчные кислоты, примерно такое же количество стеринов экскретируется с фекалиями, около 100 мг выделяется с кожным салом, небольшое количество холестерина (около 40 мг) используется для образования кортикоидных и половых гормонов, а также витамина D3, 1—2 мг холестерина выводится с мочой. У кормящих женщин с грудным молоком выделяется 100— 200 мг холестерина в сутки. Эти потери восполняются за счет синтеза холестерина в организме (у взрослого человека в сутки около 700—1000 мг) и поступления его с пищей (300— 500 мг). Холестерин, а также часть холестерина, поступившего в просвет кишечника с желчью, всасывается в тонкой кишке в форме жировых мицелл (см. Жировой обмен). Эфиры холестерина предварительно гидролизуются при действии холестеринэстеразы (см.) панкреатического и кишечного соков. В стенке тонкой кишки холестерин используется для образования хиломикронов (см. Липопротеиды), в составе которых он поступает сначала в лимфатическую систему, а затем в кровяное русло.
В капиллярах жировой и некоторых других тканей в результате воздействия на хиломикроны липопротеид-липазы образуются частицы, обогащенные эфирами холестерина и фосфолипидами, получившие название ремнантных (остаточных) частиц. Эти частицы задерживаются в печени, где подвергаются распаду. Освободившийся при этом холестерин наряду с холестерином, синтезированным в печени, образует так называемый общий пул печеночного холестерина, который используется по мере необходимости для образования липопротеидов (см.).
Установлено, что у человека и некоторых животных липопротеиды низкой плотности транспортируют холестерин в органы и ткани, причем захват липоиротеидных частиц клетками этих органов и тканей осуществляется при участии специфических рецепторов. Холестерин, доставленный в клетку в составе липопротеидных частиц, идет на покрытие потребностей клетки (образование мембран при делении клетки, синтез стероидных гормонов и др.). Избыточная часть неэтерифицированного (свободного) холестерина превращается в его эфиры при действии содержащегося в клетке фермента — холестеролацилтрансферазы (КФ 2.3.1.26). Обратный транспорт неэтерифицированного холестерина из различных органов и тканей в печень осуществляется липопротеидами высокой плотности, причем в кровяном русле происходит этерификация захваченного холестерина при участии лецитина и фермента холестерин-лецитин — ацилтрансферазы (КФ 2.3.1.43). Доставленный таким путем в печень холестерин идет на образование желчных кислот (см.).
Синтез холестерина

Общая схема биосинтеза холестерина
Синтез холестерина осуществляется в клетках почти всех органов и тканей, однако в значительных количествах он образуется в печени (80%), стенке тонкой кишки (10%) и коже (5%). К. Блох, Ф. Линен и др. показали основные реакции биосинтеза холестерина (их не менее 30). Сложный процесс биосинтеза холестерина можно разделить на три стадии: 1) биосинтез мевалоновой кислоты; 2) образование сквалена из мевалоновой кислоты; 3) циклизация сквалена и образование холестерина (см. схему).
Считают, что главным источником образования мевалоновой кислоты в печени является ацетил-КоА, а в мышечной ткани — лейцин. И то и другое соединения в результате ряда энзиматических реакций образуют бета-гидрокси-бета-метилглутарил-КоА (ГМГ-КоА), который затем восстанавливается в мевалоновую кислоту. В последнее время показано, что в синтез мевалоновой кислоты в печени может включаться и малонил-КоА.
Реакцией, определяющей скорость биосинтеза холестерина в целом, является восстановление ГМГ-КоА в мевалоновую кислоту; этот процесс катализирует фермент НАДФ-Н2-зависимая ГМГ-КоА-редуктаза (КФ 1.1.1.34). Именно этот фермент подвержен воздействиям со стороны ряда факторов. Так, активность ГМГ-КоА-редуктазы повышается (или содержание ее в печени возрастает) и скорость синтеза холестерина в целом увеличивается при действии ионизирующего излучения, введении тиреоидных гормонов, поверхностно-активных веществ, холестирамина, а также при гипофизэктомии. Угнетение синтеза холестерина отмечается при голодании, тиреоидэктомии и при поступлении в организм пищевого холестерина. Последний угнетает активность (или синтез) фермента ГМГ-КоА-редуктазы.
Синтез холестерина в стенке тонкой кишки регулируется исключительно концентрацией желчных кислот. Так, отсутствие их в кишечнике при наличии наружного желчного свища ведет к повышению синтеза холестерина в тонкой кишке в 5—10 раз.
На второй стадии синтеза происходит фосфорилирование мевалоновой кислоты при участии АТФ и образование нескольких фосфорилированные промежуточных продуктов (см. Фосфорилирование). При декарбоксилировании одного из них образуется изопентенил-пирофосфат, часть которого превращается в диметилаллил-пирофосфат. Взаимодействие этих двух соединений приводит к образованию димера — геранил-пирофосфата, содержащего 10 атомов углерода. Геранил-пирофосфат конденсируется с новой молекулой изопентенил-пирофосфата и образует тример — фарнезил-пирофосфат, содержащий 15 атомов углерода. Эта реакция идет с отщеплением молекулы пирофосфата. Затем две молекулы фарнезил-пирофосфата конденсируются, теряя каждая свой пирофосфат, и образуют гексамер сквален, содержащий 30 атомов углерода.
Третья стадия синтеза включает окислительную циклизацию сквалена, сопровождающуюся миграцией двойных связей и образованием первого циклического соединения — ланостерина. Ланостерин уже имеет гидроксильную группу в положении 3 и три лишние (по сравнению с холестерином) метильные группы. Дальнейшее превращение ланосте-рина может совершаться двумя путями, причем и в том и в другом случае промежуточными продуктами являются соединения стериновой природы. Более доказанным считается путь через 24, 25-дигидроланостерин и ряд других стеринов, включая 7-дигидрохолестерин, служащий непосредственным предшественником холестерина. Другой возможный путь — превращение ланостерина в зимостерин, а затем в десмостерин, из которого при восстановлении образуется холестерин.
Если суммировать общий итог всех реакций биосинтеза холестерина, то он может быть представлен в следующем виде:
18CH3CO-S-KoA + 10(H+) + 1/2O2 —> C27H46O + 9CO2 + 18KoA-SH. Источником углерода холестерина является ацетил-КоА (им может быть также малонил-КоА и лейцин), источником водорода — вода и никотин-амида дениндинуклеотидфосфат, а источником кислорода — молекулярный кислород.
Начиная со сквалена и кончая холестерином все промежуточные продукты биосинтеза нерастворимы в водной среде, поэтому они участвуют в конечных реакциях биосинтеза холестерина в связанном со сквален или стеринпереносящими белками состоянии. Это позволяет им растворяться в цитоплазме клетки и создает условия для протекания соответствующих реакций. Холестерин-переносящий белок обеспечивает также перемещение стеринов внутри клетки, что имеет важное значение для вхождения его в мембрану клетки, а также для транспорта в клеточные системы, осуществляющие катаболизм холестерина.
Катаболизм холестерина протекает в печени (окисление его в желчные кислоты), в надпочечниках и плаценте (образование из холестерина стероидных гормонов), в тестикулярной ткани и яичниках (образование половых гормонов). При биосинтезе холестерина в коже на завершающей стадии образуется небольшое количество 7-дегидрохолестерина. Под влиянием УФ-лучей он превращается в витамин D3.
Своеобразные превращения претерпевает холестерин в толстой кишке. Речь идет о той части пищевого холестерина или холестерина, поступившего в кишечник с желчью, которая не подверглась всасыванию. Под влиянием микробной флоры толстой кишки происходит восстановление холестерина и образование так наз. нейтральных стеринов. Главным их представителем является копростерин. Экспериментальные исследования, проведенные с использованием радиоизотопных и других методов, показали, что скорость обновления холестерина в различных органах и тканях неодинакова; наиболее высока она в надпочечниках и печени и чрезвычайно низка в мозге взрослых животных.
Патология холестеринового обмена
Нарушения холестеринового обмена обычно связаны с дисбалансом между количеством синтезируемого в организме и поступающего с пищей холестерина, с одной стороны, и количеством холестерина, подвергающегося катаболизму,— с другой. Эти нарушения проявляются в изменении уровня холестерина в плазме крови, которые классифицируются как гиперхолестеринемия или гипохолестеринемия (для взрослого населения высокоразвитых стран величины выше 270 мг/100 мл и ниже 150 мг/100 мл соответственно).
Гиперхолестеринемия может быть первичной (наследственной или алиментарной) и вторичной, обусловленной различными заболеваниями. Наследственная (семейная) гиперхолестеринемия характеризуется высоким уровнем холестерина и липопротеидов низкой плотности (ЛПНГЛ в плазме крови. При гомозиготной гиперхолестеринемии уровень холестеринемии может достигать 700— 800 мг/100 мл, а при гетерозиготной — 300—500 мг/100 мл. В основе наследственной гиперхолестеринемии лежит генетически обусловленное отсутствие (у гомозигот) или недостаток (у гетерозигот) специфических рецепторов к липопротеидам низкой плотности у клеток, вследствие чего резко снижается захват и последующий катаболизм этих богатых холестерином липопротеидов клетками паренхиматозных органов и тканей. В результате пониженного захвата и снижения катаболизма липопротеидов низкой плотности развивается гиперхолестеринемия (см.). Последняя приводит к раннему развитию атеросклероза (см.) и его клинических проявлений — ишемической болезни сердца (см.), преходящей ишемии мозга (см. Инсульт) и др. Особенно тяжело протекает атеросклероз при гомозиготной форме; у таких больных часто наблюдается ксантоматоз (см.), липоидная дуга роговицы (отложение холестерина в роговицу глаз), инфаркт миокарда в юношеском возрасте.
Распространенность гомозиготной формы гиперхолестеринемии невелика (примерно один случай на 1 млн. жителей). Чаще встречается гетерозиготная форма — один случай на 500 жителей.
Алиментарная гиперхолестеринемия характеризуется повышенным уровнем холестерина в плазме крови вследствие длительного потребления больших количеств пищи, богатой холестерином (куриные желтки, икра, печень, животные жиры и др.). Алиментарная гиперхолестеринемия той или иной степени выраженности характерна для жителей высокоразвитых индустриальных стран. Согласно популяционным исследованиям имеется прямая зависимость между уровнем холестерина в крови и распространенностью ишемической болезни сердца.
В эксперименте на различных животных (кролики, морские свинки, обезьяны) показано, что введение массивных доз холестерина с пищей приводит к резко выраженной гиперхолестеринемии и быстрому развитию атеросклероза. Экспериментальные модели гиперхолестеринемии и атеросклероза, впервые предложенные H. Н. Аничковым и С. С. Халатовым (1913), широко используются в научных исследованиях.
Вторичная гиперхолестеринемия встречается при гипотиреозе (см.), сахарном диабете (см. Диабет сахарный), нефротическом синдроме (см.), подагре (см.) и др. и нередко сопровождается развитием атеросклероза (см. Гиперхолестеринемия).
Выделяют первичную и вторичную гипохолестеринемию. Первичная гипохолестеринемия характерна для наследственного заболевания — абеталипопротеинемии (см.). При этой болезни отмечается почти полное отсутствие в плазме крови липопротеидов низкой плотности (у гомозигот) или значительное их снижение (у гетерозигот). Уровень общего холестерина не превышает 75 мг/ 100 мл. Гомозиготная форма болезни протекает исключительно тяжело. В основе абеталипопротеинемии лежит генетически обусловленное нарушение синтеза апопротеина В — главного белка липопротеидов низкой плотности.
Вторичные гипохолестеринемии наблюдаются при кахексии, гипертиреоидизме, аддисоновой болезни и паренхиматозных заболеваниях печени, при ряде инфекционных болезней и интоксикациях (см. Гипохолестеринемия). При недостаточной активности в плазме крови фермента лецитин — холестерин -ацилтрансферазы, или ЛХАТ (наследственная ЛXАТ-недостаточность), ответственного за этерификацию холестерина плазмы, наблюдается накопление неэтерифицированного холестерина в мембранах эритроцитов и клетках почек, печени, селезенки, костного мозга, роговицы глаза. Резко снижается доля этерифицированного холестерина в плазме крови и одновременно повышается уровень неэтерифицированного холестерина и лецитина. У больных с наследственной ЛXAT-недостаточностыо стенки артерий и капилляров подвержены деструктивным изменениям, что связано с отложением в них липидов. Наиболее тяжелые изменения происходят в сосудах почечных клубочков, что приводит к развитию почечной недостаточности (см.).
Одним из распространенных нарушений холестериновый обмен. является образование желчных камней, основной составной частью которых является холестерин (см. Желчнокаменная болезнь). Образование желчных камней происходит вследствие выкристаллизовывания холестерина при относительно высокой его концентрации в желчи и относительно низкой концентрации в ней желчных кислот и фосфолипидов, обладающих способностью растворять холестерин. Исследования показали, что имеется прямая связь между уровнем холестерина в плазме крови и распространенностью холестероза (см.) и желчнокаменной болезни.
Библиогр.: Климов А. Н, и Н икульчева Н. Г. Липопротеиды, дислипопротеидемии и атеросклероз, Л., 1984; Полякова Э. Д. Пути биосинтеза холестерина в печени и их регуляция, в кн.: Липиды, структура,биосинтез, превращения и функции, под ред. С. Е. Северина, с. 131, М., 1977;она же, Регуляция содержания холестерина в клетке, в кн.: Биохимия липидов и их роль в обмене веществ, под ред.С. Е. Северина, с. 120, М., 1981; Финагин Л. К. Обмен холестерина и его регуляция, Киев, 1980; Lipids and lipidoses, ed. by G. Schettler, B.— Heidelberg, 1967; Sodhi H. S., Kudchod-k a r B. J. a. Mason D. T. Clinical methods in study of cholesterol metabolism, Basel a. o., 1979.
A. H. Климов
Источник
Синтез холестерина из ацетил коа
Реакции синтеза мевалоновой кислоты
Схема реакций синтеза холестерола
2. Синтез изопентенилдифосфата . На этом этапе при использовании АТФ мевалоновая кислота трижды фосфорилируется. Затем промежуточный продукт декарбоксилируется и дефосфорилируется с получением изопентенилдифосфата.
3. После объединения трех молекул изопентенилдифосфата (если не считать промежуточных превращений) синтезируется фарнезилдифосфат .
4. Синтез сквалена происходит при связывания двух остатков фарнезилдифосфата.
5. После сложных реакций линейный сквален циклизуется в ланостерол .
6. Удаление лишних метильных групп, восстановление и изомеризация молекулы приводит к появлению холестерола .
Регуляция синтеза
Регуляторным ферментом является гидроксиметилглутарил-SКоА-редуктаза , активность которой может изменяться в 100 и более раз.
1. Метаболическая регуляция – по принципу обратной отрицательной связи фермент аллостерически ингибируется конечным продуктом реакции – холестеролом. Это помогает поддерживать внутриклеточное содержание холестерола постоянным.
2. Регуляция транскрипции гена ГМГ-SКоА-редуктазы (в печени) – холестерол и желчные кислоты подавляют считывание гена и уменьшают количество фермента.
3. Ковалентная модификация при гормональной регуляции:
- Инсулин, активируя протеин-фосфатазу, способствует переходу фермента в активное состояние.
- Глюкагон и адреналин посредством аденилатциклазного механизма активируют протеинкиназу А, которая фосфорилирует фермент и переводит его в неактивную форму.
Регуляция активности гидроксиметилглутарил-S-КоА-редуктазы
Кроме указанных гормонов, на ГМГ-SКоА-редуктазу действуют тиреоидные гормоны (повышают активность) и глюкокортикоиды (снижают активность).
Изменение транскрипции гена ГМГ-КоА редуктазы (генетическая регуляция) осуществляется стерол-регулируемым элементом в ДНК (SREBP, sterol regulatory element-binding protein) с которым способны связываться белки — факторы SREBP. Эти факторы при достаточном количестве холестерина в клетке закреплены в мембране ЭПР. Когда уровень холестерина падает, факторы SREBP активируются под действием специфичных протеаз комплекса Гольджи, передвигаются в ядро, взаимодействуют на ДНК с участком SREBP и стимулируют биосинтез холестерина.
Скорость биосинтеза холестерола также зависит от концентрации специфического белка-переносчика, обеспечивающего связывание и транспорт гидрофобных промежуточных метаболитов синтеза.
источник
5 циклов синтеза холестерола — от чего зависит и почему нарушается процесс холестеринового обмена?
Постоянный синтез холестерина в организме обеспечивает работа печени. Но, кроме этого, источником соединение выступает кишечник, где обрабатывается и синтезируется липид. Реакция также происходит в коже человека. Важная роль холестерина и его функции значительна. Он позволяет вырабатывать витамин Д и гормоны. Но избыток приводит к накоплению холестерола, что опасно для работы сердца.
Общая характеристика
Холестерин получил название в 1769 году от французского химика Пулетье де ла Саль. Первоначально слово обозначало выработку вещества, которую выделяли желчные камни. В буквальном смысле его стоит переводить как «твердая желчь». Но со временем ученые доказали, что вещество — это природный спирт, поэтому корректнее его называть холестерол. Экзогенный холестерин необходим организму для выработки витамина Д, он обеспечивает энтерогепатический оборот желчных кислот, для создания клеточных мембран и транспортировки эйкозаноидов. Схема создания липида сложная и включает несколько этапов.
Где синтезируется?
Синтез холестерина происходит в таких частях тела:
Биосинтез холестерина — один из важнейших процессов, который происходит в теле человека. Большую часть (выше 50%) экзогенного холестерина синтезирует печень, потому что это регуляторный источник цитозоли и эндоплазматического ретикулюма. В этом же органе начинается производство гликогена. Ресинтез происходит в кишечнике: жирные кислоты соединяются со спиртами и поступают в кровь, что позволяют уменьшить их дегенеративное влияние на мембраны. Активность выработки зависит от наличия в организме сериодов, витамина D и некоторых соединений, которые отвечают за транспортировку веществ. Основные этапы метаболизма и пути использования — это производство мевалоновой кислоты, изопентенилпирофосфата, сквалена, ланостерина, холестерина.
Цикл создания
Особенности обмена холестерина в организме человека заключаются в сложности его создания. Последовательность всегда строго одинакова. В этом процессе участвуют ферменты, которые проходят несколько биохимических действий. Нарушение цикла грозит недостатком или избытком липида, что приводит к серьезным заболеваниям.
Синтез мевалоновой кислоты
Обмен холестерина начинается с создания этого соединения с помощью ГМГ-КоА-редуктаза. На первом этапе ключевой фермент ацетил-CoA-ацетилтрасфераза при слиянии двух молекул влияет на производство коэнзима А. В этом процессе превращения также участвует гидроксиметил, который позволяет из ацетила и ацетоацетила получить 3-гидрокси-3-метилглутарил-CoA. После от этого соединения отходит кофермент А, чье молекулярная формула выглядит как HS-CoA. Это приводит к синтезу мевалоната.
Производство изопентенилпирофосфата
На этой стадии синтез протекает в 4 реакции. Сначала мевалонат вместе с мевалоткиназом путем фосфорилирования становится 5-фосфомевалонатом. Затем на второй операции в обмене веществ участвует формула фосфомевалоната, которая превращается в 5-пирофосфомевалонат. После на него влияет гормон кеназ, что позволяет синтезировать 3-фосфо-5-пирофосфомевалонатом. На последнем этапе происходит декарбоксирование и дефосфорилирование, в результате чего синтезируются изопентинилпирофосфат.
Выработка сквалена
Это коротки этап в формировании спирта. Регуляторным ферментов является гидроксиметилглутарил. Скваленовый путь начинается с того, что на выработанный фермент путем изомеризации влияет диметилаллилпирофосфат. После синтез липидов обеспечивает появление электрной свези между ферментами, что приводит к конденсированию и производству геранилпирофосфата. Но при этом от связи отходит часть пирофосфата, которая появилась при биосинтезе холестерина на втором этапе.
Производство ланостерина
На этом этапе образование эфиров в печени С5 изопентенилпирофосфата соединяется с 10 геранилпирофосфата. Затем происходит конденсация и образуется фарнезилпирофосфат. От него отходит часть, которая называется пирофосфата. На последней стадии этого этапа две молекулы фарнезилпирофосфатных соеднияются и конденсируются, что создает скавален, через распад пирофосфата в клетки.
Синтез липида
Это ключевой и завершающий момент, в котором процесс включает 5 реакций. Метаболизм холестерина начинается с окисления с участием С14 ланостерина. В результате это активирует производство14-десметилланостерина. Из соединения выпадают две С4 и органелла становится зимостеролом. Следующая операция приводит к образованию δ-7,24- холестадиенола. Затем меняются двойные связи и образуется демостерол. На последнем этапе восстанавливается взаимодействие и появляется сам холестерин.
От чего зависит?
По подсчетам ученых, в день производится от 0,5 до 0,8 грамм холестерола.
Цикл создания эндогенного соединения и обмен эфиров осуществляется при помощи приблизительно 30 реакций. Основные клетки, которые участвуют в этом действии — гепатоциты печени, в которых содержится ретикулин. Эта молекула является группой жиров и углеводов. Холестерин должен контролироваться, так как избыток или недостаток приводит к серьезным заболеваниям. Биохимия и синтез холестерола зависит от микрофлоры организма, в том числе кишечника. Этот орган влияет на всасывание жиров, образования эфиров и трансформации стиролов. Большую роль играет уровень фосфолипидов, которые транспортируют жиры. Важно поддерживать их количество, так как это контролирует содержание холестерола в крови.
Нарушения обмена холестерина
Избыток холестерина
Из-за недостатка физической активности, некачественного питания и переедания появляются проблемы с накоплением пищевого холестерина. Такое нарушение появляется у людей, имеющим вредные привычки. Из-за этого на сосудах начинают скапливаться холестериновые бляшки, которые мешают циркуляции крови. В результате развиваются заболевания сердца.
Нарушение холестеринового обмена происходит из-за таких болезней:
- желчные нарушения;
- патологии печени и почек;
- эндокринные заболевания.
Вернуться к оглавлению
Недостаток метаболитов
Регуляция синтеза холестерина происходит благодаря питанию и спорту. Высокая активность (занятие спортом, танцами) сильно влияет на биосинтез холестерола. Если при этом человек не употребляет алкоголь и не курит, то у него активно снижается количество природного спирта в тканях организма. Врачи рекомендуют для уменьшения уровня молекул соблюдать правильную диету, в которой превалирует углеводная пища. Синтез подавляется также при помощи лекарств. Но люди, у которых нарушен процесс синтеза, страдают от проблем с давлением и рискуют получить сердечный приступ.
источник
Синтез холестерина из ацетил коа
Холестерин — важная составная часть клеточных мембран животных клеток (см. с. 218). Суточная потребность в холестерине (1 г) может в принципе покрываться за счет биосинтеза. При смешанной диете примерно половина суточной нормы холестерина синтезируется в кишечнике, коже и главным образом в печени (примерно 50%), а остальной холестерин поступает с пищей. Значительная часть холестерина включена в липидный слой плазматических мембран. Большое количество холестерина расходуется в биосинтезе желчных кислот (см. с. 306), часть выделяется с желчью. Ежесуточно из организма выводится примерно 1 г холестерина. Очень небольшая часть холестерина используется для биосинтеза стероидных гормонов (см. с. 364).
Биосинтез холестерина, кап и всех изопреноидов, начинается с ацетил-КоА (см. с. 58). Углеродный скелет С 27 -стерина строится из С 2 -звеньев в длинной и сложной последовательности реакций. Биосинтез холестерина можно разделить на четыре этапа. На первом этапе ( 1 ) из трех молекул ацетил-КоА образуется мевалонат (С 6 ). На втором этапе ( 2 ) мевалонат превращается в «активный изопрен», изопентенилдифосфат . На третьем этапе ( 3 ) шесть молекул изопрена полимеризуются с образованием сквалена (С 30 ). Наконец, сквален циклизуется с отщеплением трех атомов углерода и превращается в холестерин ( 4 ). На схеме представлены только наиболее важные промежуточные продукты биосинтеза.
1. Образование мевалоната. Превращение ацетил-КоА в ацетоацетил-КоА и затем в З-гидрокси-З-метилглутарил-КоА (3-ГМГ-КоА) соответствует пути биосинтеза кетоновых тел (подробно см. рис. 305), однако этот процесс происходит не в митохондриях, а в эндоплазматическом ретикулуме (ЭР). 3-ГМГ-КоА восстанавливается с отщеплением кофермента А с участием 3-ГМГ-КоА-редуктазы, ключевого фермента биосинтеза холестерину (см. ниже). На этом важном этапе путем репрессии биосинтеза фермента (эффекторы: гидроксистерины), а также за счет взаимопревращения молекулы фермента (эффекторы: гормоны) осуществляется регуляция биосинтеза холестерина. Например, фосфорилированная редуктаза представляет собой неактивную форму фермента; инсулин и тироксин стимулируют фермент, глюкагон тормозит; холестерин, поступающий с пищей, также подавляет 3-ГМГ-КоА-редуктазу.
2. Образование изопентенилдифосфата. Мевалонат за счет декарбоксилирования с потреблением АТФ превращается в изопентенилдифосфат, который и является тем структурным элементом, из которого строятся все изопреноиды (см. рис. 59).
3. Образование сквалена. Изопентенилдифосфат подвергается изомеризации с образованием диметилаллилдифосфата. Обе С 5 -молекулы конденсируются в геранилдифосфат и в результате присоединения следующей молекулы изопентенилдифосфата образуют фарнезилдифосфат. При димеризации последнего по типу «голова к голове» образуется сквален. Фарнезилдифосфат является также исходным соединением для синтеза других полиизопреноидов, таких, как долихол и убихинон (см. с. 58).
4. Образование холестерина. Сквален, линейный изопреноид, циклизуется с потреблением кислорода в ланостерин, С 30 -стерин, от которого на последующих стадиях, катализируемых цитохромом Р450, отщепляются три метильные группы, вследствие чего образуется конечный продукт — холестерин.
Описанный путь биосинтеза локализован в гладком ЭР. Синтез идет за счет энергии, освобождающейся при расщеплении производных кофермента А и энергетически богатых фосфатов. Восстановителем при образовании мевалоната и сквалена, а также на последних стадиях биосинтеза холестерина является НАДФН + Η + . Для этого пути характерно то, что промежуточные метаболиты можно подразделить на три группы: производные кофермента А, дифосфаты и высоко липофильные соединения (от сквалена до холестерина), связанные с переносчиками стеринов.
источник
Adblock
detector
Источник