Синтез стероидных гормонов из холестерина
Содержание статьи
тероидогенез. Механизмы синтеза стероидов
Стероидогенез. Механизмы синтеза стероидов
Яичники, подобно надпочечникам, синтезируют из холестерина все три класса стероидных гормонов — эстрогены, прогестерон и андрогены. Однако в отличие от надпочечников яичники не способны продуцировать глюкокортикоиды и минералокортикоиды в связи с отсутствием ферментов 21-гидроксилазы и 11b-гидроксилазы.
Выработка стероидных гормонов в стероидпродуцирующих эндокринных железах происходит по одному и тому же базовому пути с использованием экзогенного холестерина (холестерина плазмы крови), за исключением печени и слизистой оболочки кишечника, способных синтезировать эндогенный холестерин из ацетилкоэнзима А. Основным источником холестерина для стероидогенеза в яичнике являются ЛПНП плазмы крови. Скоростьопределяющей стадией стероидогенеза является транспортировка холестерина из цитозоля к внутренней мембране митохондрий.
Этот процесс катализируется ЛГ-индуцируемым митохондриальным ферментом, называемым стероидогенным активным регуляторным протеином StAR (steroidogenic acute regulatory protein). Ген StAR локализован на хромосоме 8 (локус 8р11.2) и кодирует 285-аминокислотный белок-предшественник, от которого после транспортировки в митохондрию отщепляется 25 аминокислот.
Нонсенс-мутации гена StAR, приводящие к преждевременной остановке синтеза белка вследствие образования неполноценных стоп-кодонов, считаются причиной липоидной врожденной гиперплазии надпочечников, при которой происходит внутриклеточное накопление липидов, нарушающее стероидогенез.
Стероидные гормоны яичника синтезируются как в интерстициальных, так и в фолликулярных клетках. Структурный каркас холестерина состоит из трех шестиугольных углеродных колец и одного пятиугольного углеродного кольца, к которому крепится боковая цепь. Две метильные группы, играющие важную роль, присоединяются также в положениях 18 и 19. Прогестины и кортикостероиды (С21-стероиды группы прегнана) синтезируются посредством частичного расщепления боковой цепи (т.е. десмолазной реакции).
Андрогены (С19-стероиды группы андростана) синтезируются путем полного отщепления боковой цепи. Эстрогены (С18-стероиды группы эстрана) — путем ароматизации одного из трех шестиугольных углеродных колец с образованием фенольной группы и потери метильной группы в положении 19.
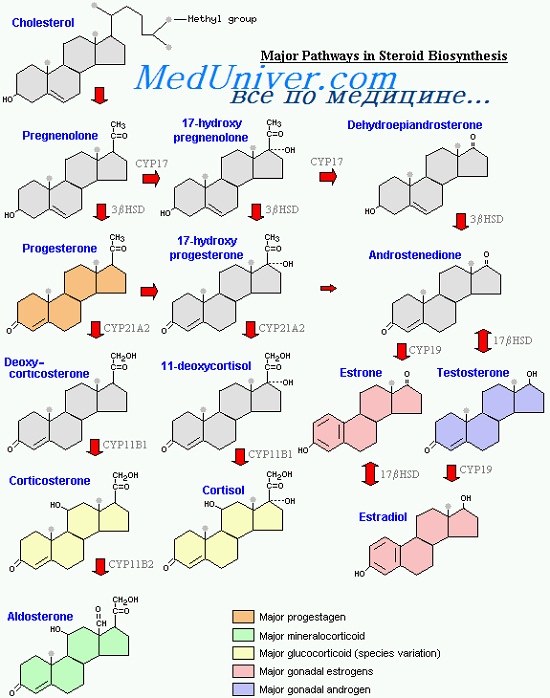
На первом этапе стероидогенеза происходит превращение холестерина в прегненолон посредством гидроксилирования углерода в положениях 20 и 22 с последующим расщеплением боковой цепи. Из прегненолона стероидные гормоны образуются по одному из двух главных путей. По прегненолоновому (d5) пути синтезируются андрогены и эстрогены (прегненолон -> 170Н-прегненолон -> дегидроэпиандростерон (ДГЭА) -> тестостерон -> эстроген). По прогестероновому (Д4) пути образуются андрогены и эстрогены (прегненолон -> прогестерон -> 170Н-прогестерон -> андроген -> эстроген). В надпочечниках по d4-пути синтезируются минералокортикоиды и глюкокортикоиды.
P.S. ЭР — эндоплазматический ретикулум
К ферментам, участвующим во внутриклеточном синтезе стероидных гормонов, относятся пять гидроксилаз, две дегидрогеназы, редуктаза и ароматаза. Гидроксила-зы и ароматаза принадлежат к группе генов семейства цитохрома Р450 (CYP). Эти ферменты существуют как в митохондриях, так и в эндоплазматическом ретикулуме.
Из девяти указанных выше ферментов четыре ключевых фермента регулируют основные этапы стероидогенеза: CYP11A (P450scc) — фермент, катализирующий превращение холестерина в прегненолон; 3b-HSD или 3ba-гидроксистероиддегидрогеназа (ГСД) превращает прегненолон в прогестерон; CYP17 (Р450с17) — гидроксилаза, превращающая прегненолон в андрогены; CYP19 (P450arom) — ароматаза, превращающая андрогены в эстрогены. Большинство реакций являются необратимыми. Некоторые обратимые реакции (обозначены на рисунке двунаправленной стрелкой) зависят от наличия кофактора (например, соотношения НАДФ/НАДФ-Н).
Спектр продуцируемых клеткой гормонов зависит от ее происхождения, а также от наличия или отсутствия присущих данной ткани стероидогенных ферментов. Так, поскольку в коре надпочечников отсутствует фермент 17b-ГСД, то синтез андрогенов здесь ограничивается ДГЭА и андростендионом. В яичках ЛГ контролирует активность 17b-ГСД и продукцию тестостерона.
Стероидпродуцирующие клетки яичника (гранулезные, текальные, желтое тело) содержат весь спектр ферментов для синтеза стероидных гормонов. В текальных клетках ЛГ также контролирует активность 17b-ГСД и синтез андростерона, в то время как активность CYP19 (P450arom) в гранулезных клетках контролирует ФСГ, а значит, и продукцию эстрадиола. Такие взаимосвязи являются основой функционирования системы двух клеток и двух гонадотропинов. Процесс ароматизации происходит в эндоплазматическом ретикулуме.
В каждом из двух типов клеток количество тех или иных ферментов зависит от стадии развития фолликула. Ферменты CYP11A и 3b-ГСД экспрессируются как в текальных, так и в гранулезных клетках антральных и преовуляторных фолликулов, а также в лютеинизиро-ванных гранулезных и текальных клетках желтого тела. В отличие от них, CYP17 (Р450с17) экспрессируется только в текальных клетках антральных и преовуляторных фолликулов и в желтом теле.
— Также рекомендуем «Значение эстрогенов. Функции»
Оглавление темы «Регуляция менструального цикла»:
- Регуляция менструального цикла. Гормоны фолликулиновой фазы
- Овуляторная фаза менструального цикла. Регуляция
- Лютеиновая фаза менструального цикла. Регуляция
- Переходная лютеиново-фолликулярная фаза менструального цикла. Регуляция
- Яичник как эндокринный орган. Двухклеточная теория
- Стероидогенез. Механизмы синтеза стероидов
- Значение эстрогенов. Функции
- Биоинтез и обмен эстрогенов. Продукция эстрадиола
- Значение и функции прогестерона. Биоинтез и обмен
- Значение и функции андрогенов. Биоинтез и обмен
Источник
Биосинтез гормонов. Биосинтез стероидных гормонов
Синтез стероидных гормонов осуществляется под ферментативным контролем в клетках стероидогенных желез главным образом мезодермального происхождения. У позвоночных животных к ним относятся кора надпочечников, клетки Лейдига семенников, фолликулы и желтое тело яичников, а также плацента млекопитающих. Гормональная форма витамина D3 достраивается из экзогенного витамина в печени и почках. Экдизоны насекомых образуются в большинстве случаев в проторакальных железах, а у представителей некоторых видов — в кольцевой железе личинок. Крустэкдизоны ракообразных синтезируются в Y-органах.
Биосинтез стероидных гормонов происходит из общего для них предшественника холестерина — С27-А5-стероида, который поступает в стероидогенные клетки из крови в составе липопротеидов разной плотности или синтезируется в них из ацетата. Большая часть холестерина в эндокринных клетках содержится в составе липидных капель, локализованных в цитоплазме, в форме эфиров с жирными кислотами. Липидные капли представляют собой депо холестерина, откуда он может быть мобилизован с помощью специфических эстераз.
Биогенез главных стероидных гормонов позвоночных (кортикостероидов;, прогестинов, андрогенов и эстрогенов) характеризуется множественностью путей, варьирующихся у животных разных видов (Юдаев и др., 1976). Схематически его можно представить в виде трех общих и начальных этапов: 1) освобождения холестерина из липидных капель и перехода его в митохондрии, где неэстерифицированный холестерин образует комплексы с белками внутренней митохондриальной мембраны; 2) укорочения боковой цепи холестерина на 6 углеродных атомов (С27 -С21) с образованием С21Д5-стероида прегненолона — ключевого предшественника гормонов, покидающего митохондрии; 3) переброски двойной связи из кольца В в кольцо А (Д5-»Д4) и отщепления водорода у С3 с обрзованием Д4-3-кетостероидов типа прогестерона, осуществляемых в микросомах клетки. Общие начальные этапы биосинтеза стероидных гормонов представлены далее.

Рис 27. Предшественники инсулина. А — превращения препроинсулина в проинеулин и проинсулина в инсулин; Б первичная структура проинсулина свиньи:
ам. ост. — аминокислотные остатки; заштихомны аминокислотные остатки, выщеплаемые из пептида
Все указанные этапы контролируются в основном соответствующими тройными гормонами гипофиза (АКТГ, ЛГ). Те же гормоны контролируют и проникновение в стероидогенные клетки из крови холестерина в составе липопротеидов.
Очевидно, указанные процессы — лимитирующие биосинтез стероидных гормонов.
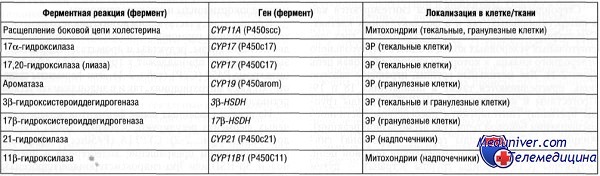
Уже на стадии прегненолона или вслед за 3 в-ол-дегидрогеназной реакцией происходит ветвление общего русла биосинтеза стероидных гормонов на основные две линии. Одна из них, начинающаяся с 17 а-гидроксилирования субстратов, приводит к образованию кортизола, андрогенов и эстрогенов. Прогестины (С21) могут быть одними из предшественников представителей всех других групп стероидов данной линии, а андрогены (С 19), в свою очередь, становятся обязательными предшественниками эстрогенов (С18).
Другая линия стероидного биосинтеза, начинающаяся с 21-гидроксилирования субстратов, приводит к образованию кортикостерона и альдостерона, причем кортикостерон может быть предшественником альдостерона. Наличие того или иного пути стероидогенеза в клетках стероидпродуцирующих желез, а следовательно, и структура конечного продукта определяются присутствием в этих клетках соответствующих ферментных систем. Следует отметить, что гидроксилирование в 21-м и 17-м положениях может осуществляться и на стадии холестерина
Характерная особенность биосинтеза стероидных гормонов — ряд последовательно протекающих процессов гидроксилирования молекул стероидов. Они происходят в митохондриях (20а- и 22в-гидроксилирование холестерина, 11в- и 18-гидроксилирование предшественников кортикостероидов) и микросомах (17 а- и 21-гидроксилирование прегненолона и прогестерона, 19-гидроксилирова-ние андрогенов). Эти процессы осуществляются специальными ферментными системами стероидогенных клеток, относящихся к гидррксилазам или оксидазам смешанного типа (Мэсон, 1957). Гидроксилазы обеспечивают недыхательный, гидроксилирующий транспорт электронов от восстановленного кофактора НАДФН к кислороду, который приводит в конечном счете к включению одного из его атомов в гидроксильную группу, присоединяемую к стероиду:

Гилроисилирующий транспорт электроиов

Ветвление путей биосинтеза стероидных гормонов

Общая схема биосинтеза кортикостероидов
Для 3в-ол-дегидрогеназной реакции в качестве кофактора необходим окисленный НАД, а кислород воздуха не нужен.
В.Б. Розен
Опубликовал Константин Моканов
Источник
Синтез стероидных гормонов — SportWiki энциклопедия
Синтез стероидных гормонов[править | править код]
Синтез стероидных гормонов
Выключателем, который ответственен за синтез стероидных гормонов, является клеточный регулятор цАМФ. Он и его связанный фермент (киназа белка А) активизируют синтез стероидных гормонов. Эти стимулирующие пептидные гормоны посылают половым железам (гонадам) и надпочечникам сигнал синтезировать стероидные гормоны.
Отметим, что синтез стероидных гормонов может подавляться высоким уровнем холестерина в крови. Производство стероидов зависит от синтеза холестерина в митохондриях клеток, которые производят стероидные гормоны. Как правило, это происходит в коре надпочечников, клетках семенников, фолликулах, желтом теле яичников, а также в плаценте. Высокий уровень холестерина, как сказано ранее, уменьшает синтез самого холестерина.
Преобразование холестерина под воздействием стероидных гормонов вызывает ограниченный распад остатков холестерина, способствующий росту стероидного гормона прегненолона — «матери всех стероидных гормонов», а также прогестерона, тестостерона (и других андрогенов), эстрогена, альдостерона и кортизола.
Влияние жира и холестерина на стероидные гормоны[править | править код]
Согласно последним исследованиям холестерин отрицательно влияет на синтез стероидных гормонов. Когда холестерин заканчивается в клетках, производящих стероиды, в организме запускается синтез этого самого холестерина, а также его преобразование в стероидный гормон — прегненолон. А когда существует высокий клеточный уровень холестерина, подавляется производство холестерина, что приводит к уменьшению синтеза стероидных гормонов.
Потреблением жиров и углеводов нужно разумно управлять, чтобы гарантировать полноценное использование их организмом. Избыточное накопление жиров способно ослабить синтез стероидных гормонов и замедлить рост мышечной массы. Избыток углеводов или холестерина может подавить синтез стероидных гормонов, это же происходит и при дефиците калорий или жира.
Длительные обезжиренные, низкокалорийные диеты могут привести к подавлению стероидов из-за нехватки диетического жира, холестерина и энергии, необходимой для производства стероидов. Фактически употребление продуктов с высоким содержанием жиров здоровыми людьми может способствовать производству стероидов, до тех пор пока количество потребляемых калорий достаточно для поддержания жизнедеятельности организма.
Отсюда напрашивается вывод: если существенные ограничения в еде (что, по мнению ортодоксальных диетологов, является наиболее здоровым и правильным способом снижения веса) приводят к подавлению синтеза стероидных гормонов в организме, то переедание может способствовать их производству. Хотя некоторым людям может показаться неправильным совет заняться обжорством.
Нужно понимать, что если переедание будет организовано должным образом, то оно может стать самым эффективным способом стимуляции стероидных процессов, усиления полового влечения и увеличения мышечной массы.
Циркуляция энергии[править | править код]
Синтез андрогенов зависит от скорости выработки энергии. Высокая циркуляция энергии — метаболическое состояние, которое вызывает высокое энергетическое потребление и высокие энергетические расходы.
Высокая циркуляция энергии вынуждает организм транспортировать накопленный жир с высокой концентрацией холестерина через кровь к мышцам и печени, где он преобразуется в энергию. Таким образом, использование холестерина на клеточном уровне приводит к увеличению синтеза стероидов.
Любой комплекс упражнений, который развивает мускулы, естественным образом увеличивает способность тела извлекать и расходовать энергию. И снова расщепление жира и использование холестерина за счет высокой циркуляции энергии помогает запустить выработку надпочечниками различных стероидных гормонов.
Читайте также[править | править код]
- Гормональные средства
- Адренокортикотропный гормон
- Кортикостероиды
Предупреждение[править код]
Анаболические препараты могут применяться только по назначению врача и противопоказаны детям. Представленная информация не призывает к применению или распространению сильнодействующих веществ и нацелена исключительно на снижение риска осложнений и побочных эффектов.
Источник
интез гормонов коры надпочечников. Стероиды
Синтез гормонов коры надпочечников. Стероиды — производные холестерола
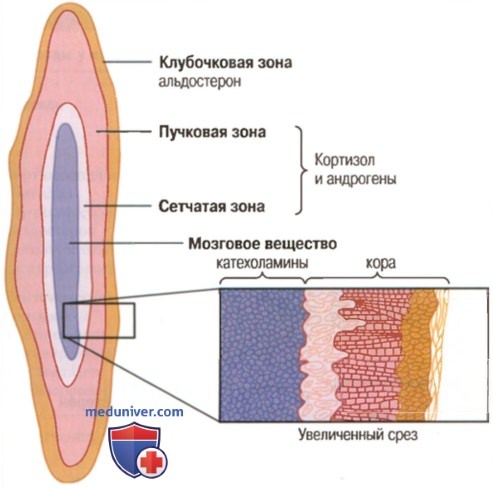
а) Синтез и секреция гормонов коры надпочечников. В коре надпочечников есть три отдельные зоны. На рисунке ниже показано, что кора надпочечников подразделяется на три относительно независимых слоя.
Секреция адренокортикальных гормонов различными зонами коры и секреция катехоламинов мозговым веществом
1. Клубочковая зона — тонкий слой клеток, расположенный непосредственно под капсулой надпочечника, составляющий 15% коры надпочечников. Только клетки этой зоны способны синтезировать существенное количество алъдостерона благодаря присутствию фермента алъдостеронсинтетазы, необходимого для образования альдостерона.
Секреторные процессы этой зоны контролируются главным образом концентрацией ангиотензина II и калия во внеклеточной жидкости, стимулирующих продукцию альдостерона.
2. Пучковая зона — средняя, наиболее широкая зона, которая составляет 75% коры надпочечников и продуцирует глюкокортикоиды, кортизол и кортикостерон наряду с небольшим количеством андрогенов и эстрогенов. Секреция этой зоны коры надпочечников регулируется гипоталамо-гипофизарной системой посредством адренокортикотропного гормона (АКТГ).
3. Сетчатая зона — глубинная зона коры надпочечников, продуцирующая андрогены дегидроэпиандростерон и андростендион наряду с небольшими количествами эстрогенов и некоторых глюкокортикоидов. Регулируют активность этих клеток также АКТГ и другие факторы, например гормон-стимулятор кортикальных андрогенов, выделяемый гипофизом. Механизмы, контролирующие продукцию андрогенов, не так понятны, как механизмы, ответственные за продукцию глюко- и минералокортикоидов.
Продукция альдостерона и кортизола регулируется независимо друг от друга. Так, ангиотензин II, особенно активно стимулирующий выброс альдостерона и благодаря которому наблюдается гипертрофия клубочковой зоны, неэффективен по отношению к двум другим зонам.
Сходным образом АКТГ, повышающий секрецию кортизола и андрогенов надпочечниками, вызывающий гипертрофию пучковой и сетчатой зон, оказался малоэффективным или даже не действенным по отношению к клубочковой зоне.
б) Гормоны коры надпочечников — стероиды, производные холестерола. Стероидные гормоны человека, включая гормоны коры надпочечников, синтезируются из холестерола. Приблизительно 80% холестерола, используемого для синтеза стероидов, обеспечиваются липопротеинами низкой плотности, циркулирующими в плазме крови, хотя клетки коры надпочечников могут заново синтезировать небольшое количество холестерола из ацетата.
ЛПНП, содержащие холестерол в высокой концентрации, диффундируют из плазмы в интерстициальное пространство и прикрепляются к рецепторам, содержащимся в структурах, названных окаймленными ямками, на мембранах адренокортикальных клеток. Затем окаймленные ямки погружаются внутрь путем эндоцитоза, образуя везикулы, сливающиеся в итоге с лизосомами клеток, и высвобождают холестерол, используемый для синтеза стероидных гормонов.
Транспорт холестерола в адреналовые клетки регулируется механизмом обратной связи, который может заметно менять количество имеющегося холестерола для синтеза гормонов. Например АКТГ, который стимулирует синтез стероидных гормонов надпочечников, увеличивает количество рецепторов для ЛПНП наряду с активацией ферментов, высвобождающих холестерол их ЛПНП.
Как только холестерол попадает в клетку, он доставляется в митохондрии, где расщепляется ферментом холестеролдесмолазой, образуя прегненолон; этот этап лимитирует скорость возможного образования стероидов (для облегчения понимания просим вас изучить рисунок ниже).
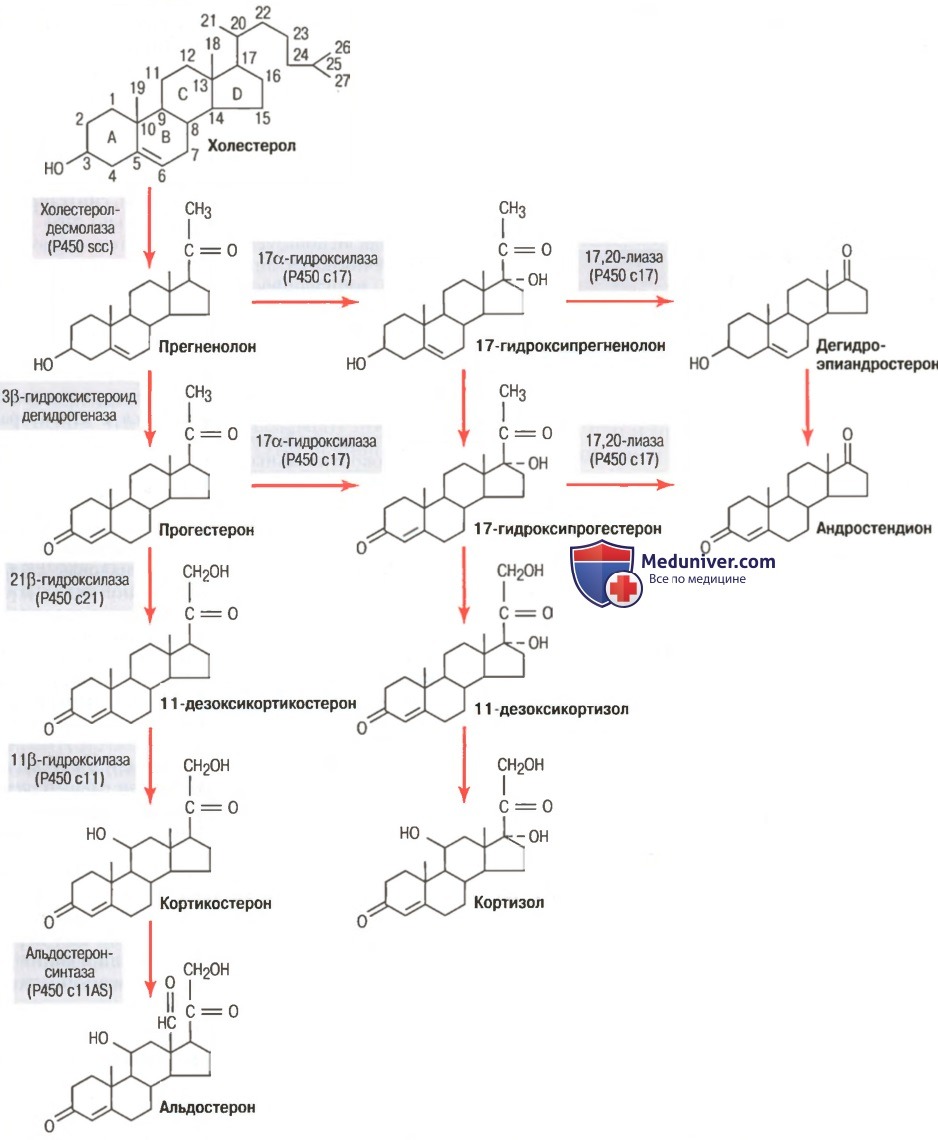
Пути синтеза стероидных гормонов коры надпочечников. Ферменты выделены серым фоном
Во всех трех зонах коры надпочечников этот начальный этап синтеза стероидов стимулируется разными факторами, что определяет в итоге, какие гормоны будут преобладать: альдостерон или кортизол.
Например, как АКТГ, стимулирующий секрецию кортизола, так и ангиотензин II, стимулирующий секрецию альдостерона, ускоряют превращение холестерола в прегненолон.
— Также рекомендуем «Синтез стероидов коры надпочечников. Минералокортикоиды и глюкокортикоиды»
Оглавление темы «Гормоны глюкокортикоидов»:
1. Диагностика гипертиреоидизма. Гипотиреоидизм при эндемическом коллоидном зобе
2. Идиопатический нетоксический коллоидный зоб. Микседема
3. Кретинизм. Гормоны надпочечников
4. Синтез гормонов коры надпочечников. Стероиды — производные холестерола
5. Синтез стероидов коры надпочечников. Минералокортикоиды и глюкокортикоиды
6. Адренокортикальные гормоны. Дефицит минералокортикоидов
7. Физиологические функции альдостерона. Влияние альдостерона на почки
8. Избыток альдостерона. Влияние альдостерона на железы
9. Регуляция секреции альдостерона. Обратная связь альдостерона
10. Функции глюкокортикоидов. Кортизол и обмен углеводов
Источник