Синтеза гемоглобина и его нарушение
Содержание статьи
Синтез гемоглобина. Нарушения синтеза гема. Порфирии. Гемоглобинопатии
Синтез гема протекает в митохондриях эритробластов. Синтез цепей глобина осуществляется на полирибосомах и контролируется генами 11-й и 16-й хромосом. Схема синтеза гемоглобина у человека представлена на рис
Нарушение синтеза гема может привести к снижению активности геминовых ферментов тканей и к гипотрофии..
Биосинтез порфиринов является одним из универсальных биологических процессов, так как порфирины в виде комплексов с металлами (металлопорфиринов), составляют основу гемоглобина и миоглобина, а также жизненно важных энергетических ферментов (цитохромов В и С, цитохромоксидаз, каталаз, пероксидаз). Синтез порфиринов происходит в эритробластах костного мозга, митохондриальпом аппарате печени и почек, в клетках центральной нервной системы. Основная часть порфиринов идет на синтез тема, который представляет сложный энзиматический процесс, (каждый этап которого регулируется определенным ключевым ферментом).
Участвующие в синтезе гема ферменты можно разделить на три группы. Первая группа связана с синтезом АЛК в янтарно-глициновом цикле. Ключевой фермент — синтетаза АЛК, коферментом этой реакции служит пиридоксальфосфат, производное витамина В6. Вторая группа ферментов осуществляет превращение АЛК в ПБГ. Ключевой фермент — дегидратаза АЛК. Третья группа ферментов связана с заключительным этапом синтеза гема. Ключевые «ферменты — копрогеназа и гемсинтетаза.
Ряд ферментов, регулирующих процесс биосинтеза гема, содержит высоко реактивные функциональные группы — сульфгидрильные, карбоксильные и аминные. Токсические вещества, и особенно тяжелые металлы, могут блокировать эти группировки в ферментах, замещая атомы водорода в них и тем самым нарушая активность ферментов. Наиболее активны в этом плане вещества из группы «тиоловых ядов», которые при попадании в организм вступают во взаимодействие с веществами, содержащими серу, и в частности SH-группами. Таким путем многие токсические вещества, независимо от тропности их действия, способны вызывать изменения в биосинтезе порфиринов. Нарушения порфиринового обмена установлены при интоксикации бензолом — повышение АЛК в эритроцитах, окисью углерода — повышение КП эритроцитов, небольшое увеличение КП и АЛК мочи, акрилатами — увеличение ПП эритроцитов, фосфором — некоторое увеличение мочевой экскреции АЛК и КП.
Однако среди всех промышленных ядов, способных вызывать те или иные расстройства синтеза порфиринов и гема, совершенно исключительное положение занимает свинец, при действии которого они носят первичный характер и являются определяющим патогенетическим механизмом интоксикации.
Гемоглобинопатия — наследственное или врождённое изменение или нарушение структуры белка гемоглобина, обычно приводящее к клинически или лабораторно наблюдаемым изменениям в его кислород-транспортирующей функции либо в строении и функции эритроцитов.
К наиболее часто встречающимся и известным гемоглобинопатиям относятся серповидно-клеточная анемия, бета-талассемия, персистенция фетального гемоглобина.
Гемоглобинопатии классифицируются на качественные и количественные. Качественные обусловлены заменой аминокислот в полипептидных цепях. Замена аминокислоты глутамина 6 на валин в β-цепи приводит к образованию аномального гемоглобина S, что лежит в основе развития серповидно-клеточной анемии. Аномальных гемоглобинов более 300, но не все аномалии проявляются. Первые аномальные гемоглобины назывались буквами латинского алфавита (М, С, Д, S и др.). Но, так как аномальных гемоглобинов много, их названия включают места открытия (Boston, Москва, Волга и др.) или названия госпиталей. Количественные гемоглобинопатии связаны со скоростью синтеза α- или β-полипептидных цепей глобина. Угнетение скорости синтеза α-цепи приводит к развитию α-талассемии, угнетение синтеза β-цепи лежит в основе заболевания β-талассемии. Гемоглобинопатии — наследственные заболевания. Диагностика гемоглобинопатий основывается, кроме клинических данных, на обязательном специальном исследовании электрофорезе гемоглобина. Это исследование проводится не только для больного, но и для ближайших родственников. Данные электрофореза гемоглобина позволяют поставить диагноз талассемии. Для альфа-талассемии характерно обнаружение гемоглобинов-гомотетрамеров Нв-Н и Нв-Bart.Для бета-талассемии характерно повышенное содержание гемоглобина Α2.
ОБМЕН ЖЕЛЕЗА
В гемсодержащих белках железо находится в составе гема. В негемовых железосодержащих белках железо непосредственно связывается с белком. К таким белкам относят трансферрин, ферритин, окислительные ферменты рибонук-леотидредуктазу и ксантиноксидазу, железофлавопротеины NADH-дегидрогеназа и сукцинат-дегидрогеназа.
В организме взрослого человека содержится 3 — 4 г железа, из которых только около 3,5 мг находится в плазме крови. Гемоглобин имеет примерно 68% железа всего организма, ферритин — 27%, миоглобин — 4%, трансферрин — 0,1%, На долю всех содержащих железо ферментов приходится всего 0,6% железа, имеющегося в организме. Источниками железа при биосинтезе железосодержащих белков служат железо пищи и железо, освобождающееся при постоянном распаде эритроцитов в клетках печени и селезёнки.
В нейтральной или щелочной среде железо находится в окисленном состоянии — Fe3+, образуя крупные, легко агрегирующие комплексы с ОН-, другими анионами и водой. При низких значениях рН железо восстанавливается и легко диссоциирует. Процесс восстановления и окисления железа обеспечивает его перераспределение между макромолекулами в организме. Ионы железа обладают высоким сродством ко многим соединениям и образуют с ними хелатные комплексы, изменяя свойства и функции этих соединений, поэтому транспорт и депонирование железа в организме осуществляют особые белки. В клетках железо депонирует белок ферритин, в крови его транспортирует белок трансферрин..
Железодефицитная анемия (ЖДА) — гематологический синдром, характеризующийся нарушением синтеза гемоглобина вследствие дефицита железа и проявляющийся анемией и сидеропенией. Основными причинами ЖДА являются кровопотери и недостаток богатой гемом пищи. ЖДА является последней стадией дефицита железа в организме. Клинических признаков дефицита железа на начальных стадиях нет, и диагностика предклинических стадий железодефицитного состояния стала возможной лишь благодаря развитию методов лабораторной диагностики. В зависимости от выраженности дефицита железа в организме различают три стадии:
прелатентный дефицит железа в организме;
латентный дефицит железа в организме;
железодефицитная анемия. Биохимический анализ крови
При развитии ЖДА в биохимическом анализе крови будут регистрироваться:
уменьшение концентрации сывороточного ферритина;
уменьшение концентрации сывороточного железа;
повышение ОЖСС;
уменьшение насыщения трансферрина железом.
Распад гемоглобина. Образование пигментов желчи, кала и мочи
Распад гемоглобина протекает в клетках макрофагов, в частности в звездчатых ретикулоэндотелиоцитах, а также в гистиоцитах соединительной ткани любого органа.
Как отмечалось (см. главу 13), начальным этапом распада гемоглобина является разрыв одного метинового мостика с образованием вердоглобина. В дальнейшем от молекулы вердоглобина отщепляются атом железа и белок глобин. В результате образуется биливердин, который представляет собой цепочку из четырех пиррольных колец, связанных метановыми мостиками. Затем биливердин, восстанавливаясь, превращается в билирубин – пигмент, выделяемый с желчью и поэтому называемый желчным пигментом. Образовавшийся билирубин называется непрямым (неконъю-гированным) билирубином. Он нерастворим в воде, дает непрямую реакцию с диазореактивом, т.е. реакция протекает только после предварительной обработки спиртом.
Весь ход образования Ж. п. из гемоглобина можно представить в виде следующей схемы:
Гемоглобин -> Холеглобин -> Вердогемоглобин
↓ — Глобин
— Fe
Биливердин
↓ + H2O
Билирубин
↓ + 2H2
Мезобилирубин
↓ +2Н2
Стеркобилиноген
(Уробилиноген)
↓ — H2
Стеркобилин
(Уробилин).
Ж. п. обладают свойствами кислот и дают соли с металлами (иногда нерастворимые), с чем и связано их участие в образовании жёлчных камней (см. Желчнокаменная болезнь). Повышенное содержание Ж. п. в кожных покровах, крови, моче имеет диагностическое значение при разных формах желтух.
8. Диагностическое значение определения желчных пигментов в крови и моче
Методы определения билирубина и его метаболитов
Определение билирубина в сыворотке крови
В клинической практике используются различные методы определения билирубина и его фракций в сыворотке крови.
Наиболее распространенным из них является биохимический метод Ендрассика-Грофа. Он основан на взаимодействии билирубина с диазотированной сульфаниловой кислотой с образованием азопигментов. При этом связанный билирубин (билирубин-глюкуронид) дает быструю («прямую») реакцию с диазореактивом, тогда как реакция свободного (не связанного с глюкуронидом) билирубина протекает значтельно медленнее. Для ее ускорения применяют различные вещества–акселераторы, например кофеин (метод Ендрассика-Клеггорна-Грофа), которые освобождают билирубин из белковых комплексов («непрямая» реакция). В результате взаимодействия с диазотированной сульфаниловой кислотой билирубин образует окрашенные соединения. Измерения проводят на фотометре.
Нарушения обмена билирубина
Гипербилирубинемия – это нарушение равновесия между образованием и выделением билирубина. Основным клиническим признаком является желтуха (иктеричность) – желтая пигментация кожи или оболочек глаз, обусловленная повышением содержания билирубина в крови.
Нормальный уровень билирубина в крови – 8,5–20,5 мкмоль / л. Желтуха обнаруживается при уровне билирубина выше 34,2 мкмоль / л. Однако точный уровень билирубина в крови, при котором можно выявить желтуху, варьирует.
Билирубин — конечный продукт катаболизма порфиринового кольца молекулы гемоглобина, он не содержит ни железа, ни белка.
Нарушение обмена билирубина связано с расстройством его образования и выделения.
Симптомокомплекс, характеризующийся увеличением количества билирубина в крови с накоплением его в тканях и желтушным окрашиванием кожи, склер, слизистых, серозных оболочек и внутренних органов, называется желтухой.
Желтуха может возникать при наличии следующих условий:
увеличенное образование билирубина;
уменьшенная экскреция печенью;
обструкция желчного протока.
По механизмам развития желтухи различают три ее вида:
надпеченочную (гемолитическую) — характеризуется повышенным образованием билирубина в связи с увеличенным распадом (гемолизом) эритроцитов;
печеночную (паренхиматозную) — возникает при повреждении гепатоцитов (дистрофии и некрозе их), в результате чего нарушается захват, связывание и экскреция билирубина, что приводит к увеличению его содержания в крови;
подпеченочную (механическую) — происходит обтурация желчных путей, что приводит к накоплению связанного билирубина проксимальнее преграды в желчных путях и печени (холестаз).
Источник
У гемоглобина есть молекулярные болезни
Серповидно-клеточная анемия
HbS – гемоглобин серповидно-клеточной анемии. При этом нарушении в ДНК в результате точковой мутации триплет ЦТТ заменен на триплет ЦАТ, что влечет за собой включение в 6-м положении β-цепи вместо глутамата аминокислоты валина. Изменение свойств β-цепи влечет изменение свойств всей молекулы и формирование на поверхности гемоглобина «липкого» участка. При дезоксигенации гемоглобина участок «раскрывается» и связывает одну молекулу дезоксигемоглобина S с другими подобными. Результатом является полимеризация гемоглобиновых молекул и образование крупных белковых тяжей, вызывающих деформацию эритроцитов и, при прохождении ими капилляров, гемолиз.
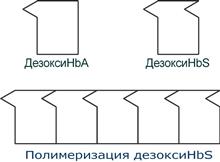
Схема отличия гемоглобина S от гемоглобина А и его полимеризация
Нарушение синтеза гемоглобина
Порфирии
Порфирии – это группа гетерогенных наследственных заболеваний, возникающих в результате нарушения синтеза гема и повышения содержания порфиринов и их предшественников в организме. Выделяют наследственные и приобретенные формы порфирии.
Приобретенные формы порфирий носят токсический характер и вызываются действием гексахлорбензола, солей свинца и других тяжелых металлов (ингибирование порфобилиногенсинтазы, феррохелатазы и др.), лекарственными препаратами (антигрибковый антибиотик гризеофульфин).
При наследственных формах дефект фермента имеется во всех клетках организма, но проявляется только в одном типе клеток. Можно выделить две большие группы порфирий:
1. Печеночные – группа заболеваний с аутосомно-доминантными нарушениями ферментов различных этапов синтеза протопорфирина IX.
Наиболее ярким заболеванием этой группы является перемежающаяся острая порфирия, при которой у гетерозигот активность уропорфириноген-I-синтазы снижена на 50%. В результате больные экскретируют с мочой большие количества порфобилиногена и аминолевулиновой кислоты. На свету порфобилиноген окисляется в окрашенные соединения и моча темнеет. Симптомами заболевания являются острые боли в животе, нервно-психические расстройства (полиневриты, тетрапарез, галлюцинации), сердечно-сосудистые нарушения.
Заболевание проявляется после достижения половой зрелости из-за повышенной потребности гепатоцитов в цитохроме Р450 для обезвреживания половых стероидов, обострение состояния также часто бывает после приема лекарственных препаратов, метаболизм которых требует участия цитохрома Р450. Снижение концентрации гема, используемого для синтеза цитохрома Р450, активирует аминолевулинат синтазу.
2. Эритропоэтические – аутосомно-рецессивные нарушения некоторых ферментов синтеза протопорфирина IX в эритроидных клетках. При этом при синтезе уропорфириногенов баланс реакций смещается в сторону синтеза уропорфириногена I. Примером может служить болезнь Гюнтера (частота<1:1000000), при которой развиваются высокая фоточувствительность кожи (ожоги под солнечным светом) и ее поражение, гемолиз, эритродонтия (окрашивание зубов в красный цвет), разрушение хрящей, в том числе носа и ушей.
Талассемии
Для талассемий характерно снижение синтеза α-цепей гемоглобина (α-талассемия) или β-цепей (β-талассемия). Это приводит к нарушению эритропоэза, гемолизу и тяжелым анемиям.
Источник
гнетение синтеза гемоглобина. Нарушение синтеза гема при интоксикации
Угнетение синтеза гемоглобина. Нарушение синтеза гема при интоксикацииПоражение крови, обусловленное первичным нарушением синтеза гема, вызывают свинец и его соединения. Механизм токсического действия свинца на кровь характеризуется вмешательством его в порфириновый обмен, в частности в процесс синтеза гема, представляющего собой железопорфирин. Биосинтез гема осуществляется в основном в митохондриях эритробластов костного мозга и представляет собой сложный многоступенчатый ферментативный процесс. Как известно, исходным продуктом синтеза гема является глицин вместе с сукцинил КоА. Последний образуется из янтарной кислоты и коэнзима А. При взаимодействии глицина с сукцинил КоА вначале образуется а-амино-кетоадипиновая кислота. Фактически первый этап синтеза гема — это синтез дельтааминолевулиновой кислоты (АЛК) в янтарно-глициновом цикле при участии фермента синтетазы АЛК при условии, что коферментом этой реакции служит производное витамина В6-пиридоксальфосфат. Следующая ступень синтеза — превращение АЛК в порфобилиноген под влиянием дегидратазы АЛК. Далее через промежуточные продукты синтеза уро- и копропорфирин, после воздействия на последний фермента декарбоксилазы (копрогеназы) образуется непосредственный предшественник гема протопорфирин. Превращение протопорфирина в гем осуществляется благодаря включению в его молекулу двухвалентного железа, причем катализатором этого процесса является фермент гемосинтетаза. Угнетающее действие свинца на биосинтез гема обусловлено его ингибирующим влиянием на ферменты, катализирующие синтез гема. Сущность такого ингибирующего влияния заключается в том, что свинец блокирует функционально активные центры ферментов: сульфгидрильные (SH), карбоксильные и аминные группы. Особенно характерной является блокада SH-rpyrm ферментов, участвующих в синтезе гема, что, впрочем, свойственно всем «тиоловым» ядам, к которым принадлежит и свинец.
В результате падения активности фермента дегидратазы АЛК образуется ток АЛК, которая в повышенных количествах выделяется с мочой. Одновременно с тормозящим действием свинца на дегидратазу АЛК аналологичное воздействие оказывается и на ферменты декарбоксилазу и гемсинтетазу. Вследствие этого в эритроцитах накапливается избыток уро- и протопофирина. Причем по мере усугубления свинцовой интоксикации соотношение между количеством избыточного количества копро- и протопорфирина смещается в сторону последнего. Такое изменение первоначальной пропорции между копро- и протопорфирином, по-видимому, обусловлено двояким влиянием свинца на порфириногенез. С одной стороны, уровень протопорфирина возрастает за счет стимулирования на первом этапе декарбоксилирования копропорфирина (фермент копрогеназа) с превращением его в протопорфирин, а с другой стороны, уровень последнего возрастает благодаря торможению процесса включения железа в протопорфириновое кольцо. По мере развития интоксикации стимулирующее влияние на декарбоксилирование копропорфирина снижается, однако дисбаланс в содержании копро- и протопорфирина в крови с преобладанием последнего сохраняется. Это объясняется усиленным выведением копропорфиринов с мочой, тогда как для протопорфирина почечный барьер непреодолим. Следовательно, в целом сдвиг соотношения копропорфирин/протопорфирин объясняется опять-таки двумя механизмами: гиперпродукцией протопорфирина с нарушением его утилизации, а также усиленным выведением копропорфирина с мочой. Помимо традиционного пути образования протопорфирина из копропорфирина, возможно его образование непосредственно из АЛК. Особенности вмешательства свинца в обмен порфиринов определяет появление ранних признаков его воздействия на организм. Так, самыми ранними диагностическими показателями влияния свинца на систему крови служит появление в моче дельтааминолевулиновои кислоты в сочетании с копропорфиринурией, а также протопорфиринемия. Угнетение биосинтеза гема как такового приводит к дефициту гемоглобина. Поскольку при этом нарушается включение железа в молекулу протопорфирина, в эритробластах и эритроцитах появляется избыток неутилизированного железа (в виде гранул), вследствие чего они превращаются в сидеробласты и сидероциты. Нарушение синтеза гемоглобина приводит к стимуляции красного ростка костного мозга, что сопровождается ретикулоцитозом и появлением базофильно-зернистых эритроцитов, что свидетельствует об омоложении красной крови. При этом ретикулоцитоз и базофильная пунктация эритроцитов обычно регистрируются параллельно. Существует точка зрения, согласно которой базофильная зернистость имеет протоплазматическую природу и появление ее обусловлено усилением регенераторной активности в сфере эритропоэза. По мнению И.А.Кассирского (1970), базофильная зернистость в эритробластах и эритроцитах является следствием дезинтеграции кислого коллоида, т.е. рибонуклеиновой кислоты, содержащейся в ретикулуме, что служит достоверным доказательством ее костномозгового происхождения. Примечательно, что увеличение числа базофильно-зернистых эритроцитов не всегда сопровождается анемией так же, как и ретикулоцитоз. Поэтому оба эти симптома являются наиболее ранними признаками изменений в системе красной крови. При этом базофильная зернистость не является строго специфичной для токсического воздействия свинца, появляясь и под влиянием других ядов крови (бензол, мышьяковистый водород, оксид углерода, анилиз), а также нейротоксических веществ (сероводород, сероуглерод, бензин и т.д.), однако наиболее закономерно ее появление при поступлении в организм свинца. Все же чрезвычайная лабильность этого признака — быстрое появление и столь же быстрое исчезновение базофильно-зернистых эритроцитов даже при непрерывном контакте со свинцом отсутствие корреляции с признаками анемии снижает диагностическую ценность базофильной зернистости, если она регистрируется изолированно в отсутствие других показателей свинцовой интоксикации. — Также рекомендуем «Нарушение обмена железа. Нарушение порфиринового обмена» Оглавление темы «Интоксикация бензолом. Раздражающие токсины»: |
Источник