Сколько кислорода переносит 1 г гемоглобина
Содержание статьи
Гемоглобин
Гемоглобин (Hb) — сложный белок, обеспечивающий транспорт кислорода из легких к тканям. Гемоглобин состоит из белковых цепей и гема — порфиринового кольца, которое содержит железо.
Физиологически, основной функцией гемоглобина является перенос кислорода из легких к органам и тканям, но не меньшей важностью является перенос гемоглобином оксида азота (NO) и регуляция тонуса сосудов (вазомоторного тонуса).
Низкий уровень гемоглобина является одним из проявлений анемии, повышенный уровень гемоглобина также является признаком ряда заболеваний и патологических состояний.
Гемоглобин. Цифры и факты
- Одна молекула гемоглобина переносит четыре молекулы кислорода
- Во всем гемоглобине в организме содержит 2,5 грамма железа у мужчин и 1,9 грамма у женщин
- Паразит, вызывающий малярию, малярийный плазмодий, питается гемоглобином. Подробнее о малярии
ЭТО ИНТЕРЕСНО: физиологический процесс распада гемоглобина в организме называется гемоглобинолизом
Виды гемоглобинов
В организме здорового взрослого человека присутствует несколько типов гемоглобина:
- Гемоглобин А (HbA)
- Гемоглобин A2 (HbA2)
- Фетальный гемоглобин (HbF)
- Гликированный гемоглобин (HbA1C)
Гликированный гемоглобин имеет важнейшее значение в диагностике и лечении сахарного диабета
Нормы гемоглобина
Казалось бы, все знают, что норма гемоглобина для женщин составляет 120-140 г/л (грамм на литр), а для мужчин 140-160 г/л. Но как и с нормальными показателями уровня сывороточного железа, с нормами гемоглобина не все так просто.
ЭТО ИНТЕРЕСНО: Методы определения концентрации гемоглобин в крови называются гемоглобинометрией
Сначала интересные факты о том, откуда взялись вышеуказанные нормы. Эти нормы разработаны ВОЗ, но разработаны они не для оценки нормального уровня гемоглобина как такового, а для оценки питания. Т.е. проще говоря, эти уровни гемоглобина соответствующие указанному диапазону, с точки зрения экспертов ВОЗ, говорят о том, что человек, в общем то, неплохо питается, не более того.
Ассоциация гематологов США предлагает рассматривать нижнюю границу нормы гемоглобина, на следующем уровне:
Популяция* | Нижняя граница нормы гемоглобина |
Мужчины в возрасте от 20 до 59 лет | 137 г/л |
Мужчины в возрасте старше 60 лет | 132 г/л |
Женщины 20 лет и старше | 122 г/л |
* Нормы гемоглобин для представителей европеоидной расы
Как следует из приведенной таблицы, на уровень гемоглобина влияют пол и возраст, другие факторы, влияющие на уровень гемоглобина:
- Проживание на большой высоте
- Занятия спортом
- Курение
- Раса
- Сопутствующие заболевания
У курящих, живущих на большой высоте, спортсменов — уровень гемоглобина будет выше, т.е. то, что для других норма, для других будет уже анемией. Как и наоборот, то, что для людей живущих примерно на уровне моря будет повышенным уровнем гемоглобина, для курящих, спортсменов и живущих на большой высоте будет нормой.
Норма гемоглобина у беременных женщин*
Первый триместр | Второй триместр | Третий триместр | |
Гемоглобин (г/л) | 116-139 | 97-148 | 9.5-150 |
Гематокрит (в процентах) | 31.0-41.0 | 30.0-39.0 | 28.0-40.0 |
*Данные показатели получены в результате клинических исследований, но не являются нормативными. Подробнее о некоторых лабораторных нормах у беременных женщин.
Итак, после того, как мы рассказали о сложностях в оценке того, какой уровень является нормальным для гемоглобина, а какой нет, мы расскажем на какие нормативные показатели обычно ориентируются врачи.
Показатель | Мужчины | Женщины |
Гемоглобин г/л | 157 ± 17 | 138 ± 15 |
Гематокрит % | 46.0 ± 4.0 | 40.0 ± 4.0 |
Эритроцитов в мкл | 5.2 ± 0.7 | 4.6 ± 0.5 |
Ретикулоциты % | 1.6 ± 0.5 | 1.4 ± 0.5 |
Средний объем эритроцита, fL | 88.0 ± 8.0 | |
Среднее содержание гемоглобина в эритроците | 30.4 ± 2.8 | |
Средняя концентрация гемоглобина в эритроците | 34.4 ± 1.1 | |
Ширина распределения эритроцитов | 13.1 ± 1.4 | |
Напомним, что нормальные показатели гемоглобина у взрослых отличаются от показателей у детей.
Гемоглобин у детей
Возраст | Гемоглобин, г/л | Гематокрит, % | Средний эритроцитарный объем, мкм3 |
Новорожденные | 165 ± 30 | 51 ± 9 | 108 ± 10 |
1 мес | 140 ± 40 | 43 ± 12 | 104 ± 19 |
6 мес | 115 ± 20 | 35 ± 6 | 91 ± 17 |
1 год | 120 ± 15 | 36 ± 3 | 78 ± 8 |
2—6 лет | 125 ± 10 | 37 ± 3 | 81 ± 6 |
6—12 лет | 135 ± 20 | 40 ± 5 | 86 ± 9 |
12—18 лет | 140 ± 20 | 42 ± 6 | 89 ± 11 |
Подготовка к анализу на гемоглобин
Подготовка к анализу на гемоглобин обычно не требуется. Перед анализом необходимо пить достаточное количество жидкости, чтобы не допустить обезвоживания. Анализ на гемоглобин может быть сдан отдельно, но чаще всего, исследование гемоглобина проводится в рамках проведения общего анализа крови. В некоторых случаях общий анализ крови может потребовать подготовки в виде 12 часового голодания.
Симптомы пониженного гемоглобина
Пониженный гемоглобин приводит к недостаточному обеспечению органов и тканей кислородом. ОБычно симптомы низкого гемоглобина включают:
- слабость
- одышку
- головокружение
- учащенное сердцебиение
- шум в ушах
- головную боль
- похолодание конечностей
- побледнение или желтизну кожи
- боль в груди
Подробно симптомы связанные с пониженным гемоглобином обсуждаются в статье об анемиях.
Источник
22
Ζ
.
22.1.
,
.
.
,
. ,
,
, .
.
.
,
.
64 500, 16 000 [2, 7, 18].
.
. ,
.
,
, (.
22.1). ,
.
,
, .
. O2
, .
, ()
(O2). ,
,
, ; .
, ,
.
,
.
(. 22.2). (),
.
,
.
,
.

. 22.1.

. 22.2. , ( )
( ).
( . 22.3)
.
, 10000 ,
. ,
140 .
.
[26, 27]. .
22.3 ,
. ,
.
. ,
, .
()

. 22.3. (
[26, 27])
, 141
, a,
( 146 )b.
(HbF) b g,
. HbF [2].
.
, ,
. ,
,
.
.
(,
, ) ,
, . . ,
() .
,
,
( ),
( )
577 541 [II].
, ,
.
.
555 .
.
.
, (
) .
.
(I0) (I)
. I/I0 ,
(I0 I)/I0 .
.

. 22.4. (bO2) (b).
,
. . 22.4
. ,
,
.
, , .
, ,
.
,
, ,
b bO2
.
,
. ,
,
(. ).
, , ,
,
, . . 600, 577, 470 .
. (. . 22.4).
.
()
( . 22.4 ):
E=lgI/I, (1)
I ,
I . ,
:
E=lgIo/I= e× C ×d,
(2)
d , e (,
). ,
.
.
;
.
158 / (15,8 /) 140 / (14
/) . ,
.
(. 22.5).
. 200 /,
(. 22.5). 115 /,
, .
, , .
,
.
. ,
, 130 / 120
/ .
.
, :
1) O2 (1
1,36 O2);
2) (
0,34%);
3) (
);
4) ().
,

. 22.5.
(♂), (♀) .
,
; μ (),
(, ;
,
)
, .
.
.
,
, .
.
, (K3[Fe(CN)6]),
(KCN) (N3).
, HbCN (
), .
546
. e d,
, [ (2)],
. , ,
.
[32].
.
,
, . ()
( mean corpuscular hemoglobin,
MCH). ,
.
.
. 1
158 b 5,1 106
(1 = 106 ). :
= 158
/5 ,1·1012=
31 1012 = 31
:
= 140
/4,6·1012=
31 1012 = 31
( ;
= 29 ( ).
(2636 ) . ,
, .
. ,
,
,
. (, )
,
.
.
( ),
( ).
.
,
,
(), (/)
(). , (), ()
( mean corpuscular hemoglobin concentration, MCHC) ().
.
:
, = 5· 1061,
[] = 150 /, = 0,45, : = 30 ,
=/, =0,09106 = 90 () = 90 3
22.2.
() .
.
.
( ,
),
, .
.
, , .
( ),
1 , 1 (1 = 760 . . =
101 ).
:
[] = a/760 Pr (3)
760,
, r
.
, . . 22.1
. [ (3)],
,
. , ( O2 = 95 . . CO2 = 40 . .)
O2 0,003 O2 1 , O20,026 O2, 1
. O2 , O2,
O2, 9 . ,
O2 20 , O2.
22.1.
a ( ·
1· 1)
O2, O2 N2
a2 | aCO2 | a N2 | |
, 20 | 0,031 | 0,88 | 0,016 |
, 37 | 0,024 | 0,57 | 0,012 |
, 37 | 0,024 | 0,49 | 0,012 |
O2 O2
,
.
,
. , O2 O2
.
.
. , O2
, ,
(. 22.3). ,
:
+4O2
↔(O2)4. (4)
, 1 4
O2. 1
22,4 , 64 500 4 22,4 O2,
1 1,39 O2.
(1,341,36 O2
1 ). ,
[25]. , , invivo 1 Hb 1,34 2 (
).
. 1 Hb (=
16 100 Hb) 1 O2 (= 22,4 O2).
, .
, ,
, : [O2]max =
(1,34 O2 1 )·(150 Hb 1 ) =
0,2 O2 1 .
,
, (PO2 > 300 . .);
(4) .
O2,
.
.
(4) . ,
O2 ;
, , O2.
(SO2 ) :
SO2=[O2]/
[Hb] + [O2]·
100% (5)
, SO2 =0%;
, SO2 = 100%. O2.
. . 22.6, S .
(.
). , ,
2, ..
O2,
50%. ( 7,4 t=37C) 50
26 . . (3,46 ) [9, 29].
.
S
.
O2,

. 22.6. (Hb)
(Mb) 7,4 t 37
[11]. ,
,
(Mb), [1].
, 1:4.
,
O2:
Mb + O2 ↔ bO2. (6)
. 22.6. ,
S bO2
O2,
. ,
O2 ,
. ,
, .
,
,
. ,
,
S bO2 [11,14].
.
.
O2
(PO2)
. O2
95 . ,. (12,6 ). . 22.6 ,
97%. (
) O2
, ,
,
. , O2
60 . . (8,0 )
90%. ,
,
.
.
PO2 .
PO2
40 . . (5,3 ), 73% .
5 . . (0,7 ),
7%; O2
.
O2
.
(SO2 ). SO2 , ,
, O2 ( O2
1 ):
[O2]= 1,34·[Hb]·SO2·105 (7)
SO2 , a [Hb]
.
, , (SO2 = 97%)
0,20, (SO2 = 73%) 0,15.
, (O2
) 0,05 (. 22.2). ,
25% .
,
(. . 23.2), ,
. 22.2, ,
.
0,1.
,
b2
,
[2, 12, 14], ,
S . , ,
O2 ,
.
.
( )
.
, (. 22.7, ).
22.2.
O2 | SO2% | [O2], / | PCO2 | [CO2], / | |||
.. | .. | ||||||
95 | 12,6 | 97 | 0,20 | 40 | 5,3 | 0,48 | 7,40 |
40 | 5,3 | 73 | 0,15 | 46 | 6,1 | 0,52 | 7,37 |
0,05 | 0,04 | ||||||
. 22.7.
[9, 29]. . . . ( ). .
O2. . 2,3 (2,3)
. , ( )
( ),
,
.
PO2.
+ (
. 22.7, , +
). , . . ,
. . 22.7,
, +
. ,
.
(. . 22.7, ) .
O2 (O2 ): O2
, . . 22.7,
O2· ,
O2
bO2.
,
, O2
. ,
[14].
.
,
(
). , .
O2 O2,
.
. 22.7, ,
bO2.
( ; pO2 = 40 . ., CO2 = 46 . .),
, ( ;PO2 = 95 . ., CO2 = 40 . .),
. ,
,
. ,
. O2
.
O2,
.
( . 22.7, ).
,
2
. ,
.
.
. ,
(, ),
( ).
. ,
,
.
2,32,3 (. 22.7, )
[16. 22].
. :
()
, , ()
. ,
.
. ,
, .
.
, , in vivo
( , ).
.
, , [7, 21].
. 22.8

. 22.8.
[O2] (PO2)
.
O2 (
) ( ), ‘
( ), ‘ ( )
.
.
(120 180 / ),
, O2 .
() ‘ ‘ (). ,
O2 , .
, PO2= 25 . . (3,3 ) O2
0,08, 0,11.
.
O2 ,
( . 22.8 ). .
( , )
, .
:
+ ↔
b. (8)
,
.
,
b , O2 [3].
O2
30 ppm ( ),
FCO2 3·105 (0,003 .%).
,
, b 5%
. O2,
b bO2
5%, 1 : 350. ,
b 350
, O2.
. ,
.
; ,
.
, O2.
b 1 %
; 20%. ,
, ,
3·104.
.
, .
b, (
, ) [3]
.
O2 .
,
,
,
.
, O2 .
,
, .
22.3. 2
O2
(O2, )
. ,
, .
O2 .
, , O2,
.
O2 [15]. O2 ,
, 40 . . (5,3 ).
, , O2 ,
.
O2
.
, O2
(. 22.9). O2
, :
O2 + 2
↔ 23+ + H+
(9)
;
10 . .
[6, 24].
, O2,
, .

. 22.9.
, ()
()
3
,
. 3
,
. 3
, .
,
, 3 1.
(
).
O2 3«, +.
, , ,
. , ,
. ,
, ,
+.
O2
.
():
HbNH2 + O2 ↔ HbNHCOOH + +)
, O2, ( ).
. 22.9. ,
O2 .
, O2 ;
, .
O2 . ,
, ; 40 .. ,
,
46 .. 1 1,8
O2. 12%
(bO2),
11% , 27%
, 50%
3 . ;
.
O2 (
O2, .
O2
( , ),
O2 .
O2;
, (saturatio),
. . (.:
, 1988).
,
, O2 )
O2 .
O2
O2 , . O2
. CO2 O2 .
O2 ,
. . 22.11
.
,
, ,
+ . ,
,
, O2. ,
, , O2
[6, 20]. O2
.
O2
. bO2
, O2 .
O2 O2 ,
.
O2 ,
( O2/ /).
O2 (. 22.10)
.
(. 22.16).
. O2
,
O2.
O2 .
( . 22.10).
,
O2 .
, O2 .
.

.
22.10. O2
. ( O2),
( ) ( ),
, ,
, O2 .
(. 22.10). , O2 ,
O2. , ,
O2 ,
.
22.4. ,
. ,
, (
), , (
).
.
↔
H+ + .
(11)
( ) .
,
(
).
.
, .
, l, (11)
. ,
.
(. 22.11).
.
.
.
+:
p=lg[+]. (12)
, 7 ( ),
H+ [+] 107
/. .
, , .
,
, . ,
,
,
H+, . .

.
22.11. .
‘ ‘.
+
. ,
.
,
.
( ͖)
.
, +.
.
,
.
.
͖ ,
.
.
.
.
( 37 ) 7,37 7,43,
7.40. ,
( , ,
). . ,
7,27,3, . .
. , .
,
.
,
, , .
,
. (. .
) .
, .
.
,
+
.
[H+] ·[]/[HA]= K (13)
,
, , ; ‘ ,
( ‘ ,
, ). H+ ,
. ,
,
H+, .
, ,
H+.
[H+].
+ +
.
(13) :
lg[H+]= IgK‘lg[]/ []’
(14)
= ‘ + lg[]/[] (15)
,
, .
‘, ‘,,
(‘ = IgK’). (15)
:
= ‘ +
lg a/1a (16)
a = []/
[]+[]
a,
, []
([] + []). ,
. 22.11, a .
,
, ‘ + 2.
.
,
, , H+
, , .
= ‘ (. 20.11).
,
‘ .
.
.
, O2,
:
O2
+ 2 ↔ 2↔ H+ + 3 (17)
:
= ‘ +
lg [3]/[2]
(18)
[O2] O2 (PCO2)
= ‘ +
lg [3]/0,03·P2](19)
0,03 ·
1 ..1,
, [3] /, a PCO2 ..
‘ 6,1.
, ‘ (7,4)
.
,
.
, O2 (40
. .), 3
(24 /). , O2 ,
.
,
, O2 ( , )
.
.
, ,
24 ,
42. ‘
(6,8) ,
.
.
.
,
‘ .
, , .
(
, ), .
,
,
.
, ,
O2.
[3],
O2,
[
(19)]. O2;
O3- ,
,
O2 (.
22.12). ,
,
,
O2.

.
22.12. O2
. ,
. O2.
,

. 22.13.
( 2,3) ( [19] ).
Pi- ;
. HbO2 Hb .
b
bO2, 1
b
0,45 H+
. . 22.13,
( )
. ,
, .
, , +
. ,
,
+ O2.
. , O2
.
.
;
().
, ,
( buffer bases, BB) [10].
. 22.14
, ( ).
. ,
, ( ),
( 1),
, S042
( ). ,
3
, . 1/3
.
48 /. ,
O2. .
, , O2 . H+
3 . +
, .
,
(. 22.15).

.
22.14. , .
(
); , .
, , CI; Kt+

.
22.15. CO2.
( 48
/)
,
, . , CO2 40 50
.., 0,06, 0,1.
, H+ 105 /.
, . 22.15.
PCO2,
,
.
(48 /) (
baseexcess, BE).
, BE .
BE
, .
, .
.
O2 ,
. 230
O2/, 15 .
.
H+.
,
.
. ,
,
H+ (),
O2, 3 + +→ 2
→ 2 + O2, ,
. ,
; O2 H+
,
.
.
. ,
. 4060
+, .
,
H+ .
. ,
H+ ,
.
H+
,
. H+ 4 NH3,
.
3
.
.
,
( ,
) .
, ,
.
( < 7,37) , (
> 7,43) .
.
(
2 ,
).
()
.
(, ) ;
, l ( )
. .
, ,
, .
. ,
,
2(PCO2)
(BE).
PCO2
(BE = 0). ,
PCO2 ,
BE .
( ),
( );

.
22.16. O2
(BE).
()
O2 .
O2
BE =
( )
( BE).
O2 , [3].
O2
(BE) (. 22.16).
( )
O2,
. ,
O2.
. 22.17.
, .
O2. , BE CO2
. ,
, .
(
).
, , BE .
,

.
22.17.
. BE, PCO2.
;
;
( ) BE = 0 /, CO2 = 60 .., ; BE = 15
/, CO2 =40 ..,
(, ) .
.
, . .
,
( ).
:
1.
. ,
,
.
2.
, H+
3 .
. 22.17.
( 1).
, . ,
O2 .
( 1).
CO2 ,
.
, CO2 , ,
()
.
( 2)
PCO2, ( 2).
, . ( ), , ,
, O2 .
.
,
( 36). , (
4), O2,
( 4).
.
.
,
,
.
[4, 5, 8, 10].
.
1. . ,
+ ( 7,377,43)
.
,
.
2. O2. O2
(3545 ..)
.
3. (BE). BE
. ( 2,5 +2,5 /)
.
4. .
.
,
(O2 = = 40 . .)
37 . 24 /.
, .
. 22.3
,
.
.
,
O2 [10].
22.3.
. ;
(↑ ;
↓)
BE | O2 | |
↓↓ | ↓↓ | ↓ |
↑↑ | ↑↑ | ↑ |
↓↓ | ↑ | ↑↑ |
↑↑ | ↓ | ↓↓ |
,
O2. .
O2
(. 22.18). ,
( ),
.
.
22.18. O2
[10].
, ,
O2 . ,
, , .
O2.
BE
. 1
( ): O2 44 . ., 7,37, BE = 0 /;
. 2 ( ): O2= 32 . ., 7,28, BE = 11 /;
, ().
O2 .
. , . 22.18
,
(BE =11 /),
O2 (CO2= 32 ..;
).
O2
. , CO2 , BE
( ),
[28]. .
22.19 BE CO2.
. CO2 ,

.
22.19. BE
C2
. ,
.
; BE .
. ( ): C2=32
. ., 7,28; BE = 11
/. [29]
.
BE . , , .
22.19, CO2 =32 .. 7,28; BE =11
/. ,
( 2 . 22.18).
22.5.
1. Antonini
E., Brunori M. Hemoglobin and myoglobin in their reactions with ligands.
Amsterdam. North Holland, 1971.
2. Baumann
R., Barlels H., Bauer C. Blood oxygen transport. In: Fahri L. E., Tenney
S. M. (eds.). Handbook of Physiology, Sect. 3: The Respiratory System, Vol.
IV. Bethesda. Amer. Physiol. Soc., 1987.
3. Coburn
R.F., Forman H.J. Carbon monoxide toxicity. In: Fahri L. E., Tenney S.
M. (eds.). Handbook of Physiolofy, Sect. 3: The Respiratory System, Vol.
IV. Bethesda. Amer Physiol. Soc., 1987.
4. Hills
A. G. Acidbase balance: chemistry, physiology, pathophysiology. Baltimore.
Wiiliams and Wilkens, 1973.
5. Kildberg
P. Clinical acidbase physiology. Baltimore. Williams and Wilkens, 1968.
6. Klocke
R.A. Carbon dioxide transport. In: Fahri L.E., Tenney S. M. (eds.).
Handbook of Physiology, Sect. 3. The Respiratory System, Vol. IV. Bethesda.
Amer. Physiol. Soc., 1987.
7. Lungo
L. 0. Respiratory gas exchange in the placenta. In: Fahri L. E., Tenney
S. M. (eds.). Handbook of Physiology, Sect. 3. The Respiratory System, Vol.
IV. Betehesda, Amer Physiol. Soc., 1987,
8. Masoro
E. J., Siegel P. D. Acidbase regulation. Its physiology and pathophysiology.
PhiladelphiaLondonToronto. Saunders, 1971.
9. Severinghaus
J. W. Blood gas concentrations. In: Handbook of Physiology, Respiration II.
Washington, Amer. Physiol. Soc., 1965.
10. SiggaardAndersen
0. The acidbase status of the blood. Copenhagen. Munksgaard, 1974.
11. Weissbluth
M. Hemoglobin: Cooperativity and electronic properties. BerlinHeidelberg
New York. Springer, 1974.
12. Wood
S. C., Lenfant C. Phylogeny of the gasexchange system: red cell function.
In: Fahri L. E., Tenney S. M. (eds.). Handbook of Physiology, Sect. 3.
The Respiratory System, Vol. IV, Bethesda. Amer Physiol. Soc., 1987.
13. Adair
G.S. The hemoglobin system. VI. The oxygen dissociation curve of
hemoglobin. J. Biol. Chem., 63, 529 (1925).
14. Bauer
C. On the respiratory function of haemoglobin. Rev. Physiol. Biochem.
Pharmacol., 70, 1 (1974).
15. Bauer
C., Gros G., Bartels H. (eds.). Biophysics and physiology of carbon
dioxide. BerlinHeidelbergNew York. Springer, 1980.
16. Benesch
R. E., Benesch R. Yu, C.I. The oxygenation of hemoglobin in the presence of
2,3diphosphoglycerate. Effect of temperature, pH, ionic strenght and
hemoglobin concentration. Biochemistry, 8, 2567 (1969).
17. Braunilzer
G. The molecular weight of human haemoglobin. Bibl. heamat. (Basel), 18, 59
(1964).
18. Braunilzer
G., Hilse ., RudloffV., Hilschman N. The hemoglobins. Adv.
Protein. Chem., 19, 1 (1964).
19. Brodda
. Zur Theorie des SaureBasenHaushaltes von
menschlichem Blut. Akadem. Wiss. Lit. Mainz; Wesbaden. Steiner, 1975.
20. Christiansen
J., Douglas C.G., Haldane J.S. The absorption and dissociation of carbon
dioxide by human blood. J. PhysioL, XLVIII, 244 (1914).
21. Fischer
W.M., Vogel H.R., Thews G. O2 and CO2, exchange in
the human placenta. In: Lubbers D.W., LuftU.C., Thews G.. Witzler E.
Oxygen transport in blood and tissue. Stuttgart. Thieme, 1968.
22. Kilmartin
J. V., RossiBernardi L. Interactions of hemoglobin with hydrogen ions,
carbon dioxide, and organic phosphates. Physiol. Rev., 53, 836 (1973).
23. King
E. J., Gilchrist M. Determination of haemoglobin by a cyanhaematin method.
Lancet. II, 201 (1947).
24. Maren
.. Carbonic anhydrase: Chemistry, physiology, and
inhibition. Physiol. Rev., 47, 595 (1967).
25. MerletBenichou
E., Sinet M., Blayo M. C., Gaudebout C. Oxydencombining capacity in dog.
In vitro and in vivo determination. Respir. Physiol., 21, 87 (1974).
26. Perutz
M. F. The hemoglobin molecule. Proc. Roy. Soc., B, 173, 113 (1969).
27. Perutz
M.F. Stereochemistry of cooperative effects in haemoglobin. Nature, 228,
726 (1970).
28. Thews
G. Bin Nomogramm fur die O2Abhangigkeit des SaureBasenStatus
im menschlichen Blut. Pflugers Arch. ges. Physiol., 296, 212 (1967).
29. Thews
G. (ed.). Nomogramme zum SaureBasenStatus des Blutes und zum
Atemgastransport. BerlinHeidelbergNew York. Springer, 1971.
Источник
Гемоглобин: роль в газообмене и процессе дыхания
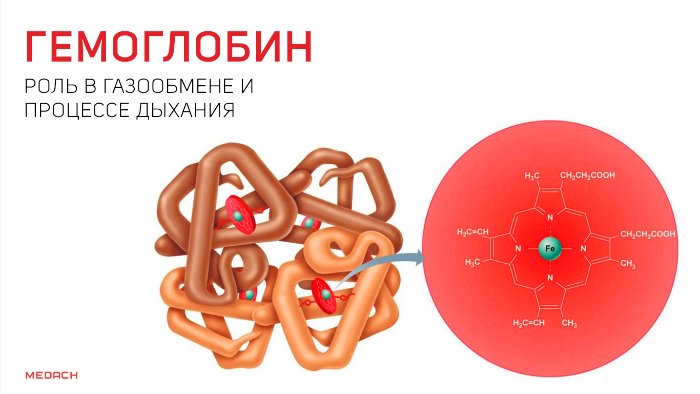
Одним из самых сложных процессов, что происходят в организме человека, несомненно, является дыхание. И сложность эта не только в танце легких, благодаря которому человек получает кислород, но и в процессах, с помощью которых этот кислород проникает дальше, в ткани, где превращается в углекислый газ, что отправляется в обратное путешествие. О данных процессах и пойдет речь далее.
Итак, приступим. Человек делает вдох, иии… Далеко не весь кислород поступает в легкие, а затем и в кровь. Часть вдыхаемого воздуха остается в так называемом мертвом пространстве. Мертвое пространство, в свою очередь, делится на анатомическое (дыхательные пути), в котором остается около 30 % вдыхаемого воздуха, и функциональное (вентилируемые, но по каким-то причинам не перфузируемые альвеолы).
Ухудшение альвеолярного газообмена может происходить при неглубоком и частом дыхании (причиной может стать перелом ребер, паралич дыхательной мускулатуры различного генеза и др.), а также при увеличении мертвого пространства, вызванном разнообразными причинами (нарушение перфузии альвеол в результате воспалительных заболеваний легких, удаление доли или целого легкого и др.), при снижении скорости кровотока по альвеолярным капиллярам (ТЭЛА, инфаркт легкого), при наличии диффузионного барьера (отек легких) и в результате ослабления альвеолярной вентиляции при обтурации просвета бронха. Газообмен между легкими и кровью происходит путем диффузии в соответствии с законом Фика. В легочных капиллярах она происходит за счет разности парциальных давлений в альвеолах и эритроцитах.
В альвеолах парциальное давление кислорода значительно превышает таковое для углекислого газа и составляет примерно 13,3 кПа (100 мм рт. ст.) и 5,3 кПа (40 мм рт. ст.) соответственно. Альвеолы омываются приносимой легочными артериями венозной кровью, в которой соотношение парциальных давлений этих двух газов обратно пропорционально и составляет приблизительно 5,3 кПа (40 мм рт. ст.) для кислорода и 6,1 кПа (46 мм рт. ст.) для углекислого газа. В среднем разница парциальных давлений составляет около 8 кПа (60 мм рт. ст.) для кислорода и около 0,8 кПа для углекислого газа.
Как уже было сказано выше, кислород путем диффузии проникает в кровь легочных капилляров. Диффузионное расстояние для кислорода при этом составляет 1–2 мкм, то есть именно на такое расстояние он проникает внутрь капилляра. Обмен крови в легочном капилляре происходит примерно за 0,75 секунды, но этого времени хватает на то, чтобы парциальные давления в альвеолах и в крови пришли в равновесие.
Кровь, в которой показатели парциального давления для кислорода и углекислого газа примерно равны таковым в альвеолах, называется артериализированной. Однако за счет наличия в легких артериовенозных шунтов и притока венозной крови из бронхиальных вен такой она остается недолго. В результате парциальное давление кислорода в аорте составляет примерно 12,0 кПа (как уже было сказано выше, парциальное давление в артериализированной крови равно таковому в альвеолах и составляет 13,3 кПа), а давление углекислого газа меняется незначительно и не приводит к затруднению его диффузии из крови в альвеолы.
Но кислород непосредственно в ткани попадает лишь в крайне незначительных количествах: для свободного перемещения по организму ему необходим транспортер. Эту функцию выполняет содержащийся в эритроцитах белок — гемоглобин. Гемоглобин существует в оксигенированной и неоксигенированной формах. В дезокси-гемоглобине железо находится на уровне порфиринового кольца и стабилизируется электростатическими силами, что обеспечивает поддержание всей структуры. Появившись, кислород начинает «тянуть» за железо, которое переносится на проксимальный гистидин на другом конце полипептидной цепи и меняет структуру всего протеина.
В результате гемоглобин переходит в оксигенированную форму, альфа- и бета-цепи при этом поворачиваются относительно друг друга на 15 градусов, облегчая присоединение остальных молекул кислорода. В итоге каждый из четырех содержащихся в нем атомов двухвалентного железа обратимо связывается с молекулой кислорода, что превращает молекулу гемоглобина в оксигемоглобин. По сравнению с миоглобином гемоглобин имеет низкое сродство к кислороду, однако оно не статично. Так, миоглобин может связывать кислород только одним участком, поэтому кривая его связывания — гипербола. Кривая связывания гемоглобина с кислородом имеет S-образную форму, демонстрируя, что при его связывании с первой молекулой кислорода гемоглобин имеет очень низкое сродство к кислороду, но при связывании последующих молекул кислорода сродство остальных его субъединиц к нему значительно увеличивается и в конечном счете повышается примерно в 500 раз.
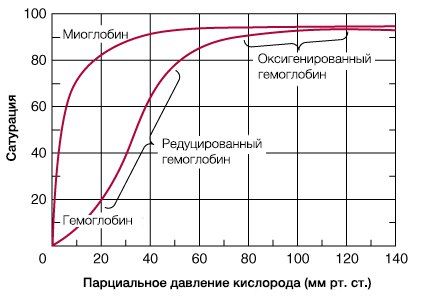
При этом альфа-цепи связывают кислород легче, чем бета-цепи. Этот процесс назван кооперативным взаимодействием. По мере снижения парциального давления кислорода в крови происходит его высвобождение из гемоглобина и поступление в ткани. Например, парциальное давление кислорода в работающих мышцах составляет всего 26 мм рт. ст, и при прохождении эритроцитов через капилляры, кровоснабжающие мышцы, происходит высвобождение и поступление в мышечные клетки примерно ⅓ всего переносимого гемоглобином кислорода. При повышении температуры тела также возрастает потребность в кислороде, что, в свою очередь, стимулирует высвобождение и поступление его в ткани. При снижении температуры, напротив, развивается гипоксия тканей, способствующая компенсаторному увеличению сродства гемоглобина к кислороду.
Гемоглобин также осуществляет перенос от тканей к легким продуктов тканевого дыхания — углекислого газа и ионов водорода. В ходе окислительных процессов в клетке выделяется углекислый газ, в результате гидратации которого образуются ионы водорода, что, в свою очередь, приводит к снижению рН. Давно известно, что снижение рН и повышение концентрации углекислого газа в крови оказывает сильное влияние на способность гемоглобина связывать кислород.
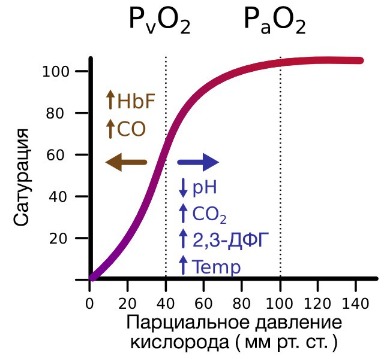
В периферических сосудах показатели рН низкие, и по мере связывания гемоглобина с ионами водорода и углекислым газом происходит снижение его сродства к кислороду. Это влияние величины рН и концентрации углекислого газа на способность гемоглобина связывать кислород называют эффектом Бора.
Обратная ситуация имеет место в альвеолярных капиллярах, где присоединение кислорода к гемоглобину превращает тот в более сильную кислоту.
При этом сродство гемоглобина к углекислому газу снижается, а повышение кислотности гемоглобина приводит к высвобождению излишка ионов водорода и образованию в крови из бикарбоната угольной кислоты, которая затем распадается на воду и углекислый газ. В обоих случаях углекислый газ из крови поступает в альвеолы, а затем в атмосферу. Данный процесс назван эффектом Холдейна. Стоит отметить, что важную роль в образовании углекислого газа в эритроцитах играет ион хлора, поступающий в плазму крови в обмен на бикарбонат при участии белка-переносчика АЕ1. Данный процесс в англоязычной литературе получил название «Chloride shift» или «перенос Хамбургера».
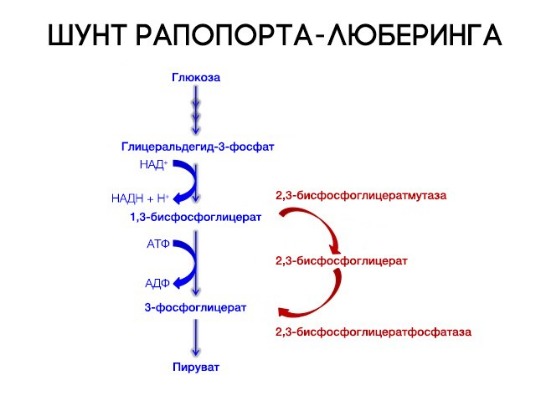
На сродство гемоглобина к кислороду оказывает влияние и присутствующее в эритроцитах вещество, получившее название 2,3-бисфосфоглицерат (БФГ). Его образование — своего рода побочная реакция анаэробного гликолиза, происходящего в эритроцитах в ходе ферментативного превращения глюкозы в пируват под действием фермента бифосфоглицератмутазы. БФГ способен самостоятельно связываться с неоксигенированной формой гемоглобина, образуя солевой мостик между двумя его бета-субъединицами и снижая сродство к кислороду.
При этом гемоглобин способен связать только одну молекулу БФГ, а при присоединении кислорода БФГ вытесняется из полости. В обычных условиях в эритроцитах крови содержится достаточно большое количество БФГ, которое может увеличиваться в условиях гипоксии (например, у дайверов при погружении на глубину), а также при восхождении на большую высоту. В первые часы подъема концентрация БФГ в эритроцитах будет возрастать, а сродство кислороду снижаться. Но на большой высоте парциальное давление будет значительно ниже такового на уровне моря, а значит, оно снизится и в тканях. При этом БФГ будет облегчать передачу кислорода от гемоглобина к тканям.
Некоторые вещества способны прочно связываться с гемоглобином или же вовсе менять его структуру. Одним из них является угарный газ, чье сродство к гемоглобину в 200 раз превышает таковое для кислорода. Отравления угарным газом часто происходят в помещениях с печным отоплением, при пожарах и авариях на производстве. Со временем кислород вытесняет угарный газ из гемоглобина, и в легких случаях пациенты помещаются под наблюдение и получают ингаляции с увлажненным кислородом. Необходимой мерой при тяжелых отравлениях угарным газом является переливание эритроцитарной массы.
К веществам, способным изменять структуру гемоглобина, относятся метгемоглобинобразователи — соединения, способные окислять двухвалентное железо в геме до трехвалентного. К ним относятся нитриты, нитраты, некоторые местные анестетики, аминофенолы, хлораты, примахин и некоторые сульфаниламиды. Состояние, характеризующееся появлением в крови окисленного гемоглобина, называют метгемоглобинемией. При высокой метгемоглобинемии капля крови, помещенная на фильтровальную бумагу, имеет характерный коричневый цвет, а при пропускании кислорода через пробирку с такой кровью ее цвет не меняется. Метгемоглобинемия выше 70 % от общего содержания гемоглобина часто приводит к гибели пациента еще до момента постановки диагноза.
Источники:
- Harrison’s hematology and oncology Longo, Dan L (Dan Louis), Third edition. New York : McGraw-Hill Education Medical, 2017.
- Наглядная физиология, С. Зильбернагль, А. Деспопулос, 2013.
- Ленинджер А. Основы биохимии: В 3-х т. Т. 1. /Д. Нельсон, М. Кокс ; Пер. с англ.-М.: БИНОМ: Лаборатория знаний, 2011.- 694 с.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Источник