Сколько молекул гема содержится в одной молекуле гемоглобина
Содержание статьи
Из чего состоит молекула гемоглобина
Гемоглобин (Hb) — это сложный железосодержащий белок, который находится в эритроцитах. Именно он является основной составляющей эритроцитов и придает им характерный красный цвет. Это один из важнейших компонентов крови, так как основной функцией гемоглобина является перенос кислорода из альвеол легких к клеткам всего организма, а также углекислого газа в обратном направлении (к легким).
В одном эритроците содержится приблизительно 400 000 000 молекул гемоглобина.
Формула молекулы гемоглобина — С2954Н4516N780O806S12Fe4.
Молекулярная масса гемоглобина — 66 800 г/моль (66,8 кДа).
Строение гемоглобина

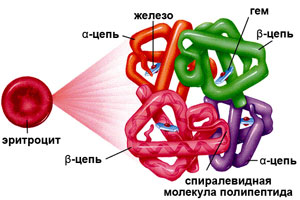
Строение гемоглобина в эритроците человека
Формула гемоглобина и его строение имеют не только теоретическую ценность, но и практическую. Например, замена глутаминовой кислоты на аминокислоту валин в 6-ом положении b-цепи приводит к синтезу аномального гемоглобина S — HbS, что проявляется развитием серповидноклеточной анемии.
Строение молекулы гемоглобина довольно сложное, даже несмотря на то, что в его состав входит всего 2 компонента:
- Гем
- Глобин
Гем
Гем — это природный пигмент, в состав которого входит соединение порфирина с железом. Общая доля гема в структуре гемоглобина составляет всего 4%. Железо, входящее в гем гемоглобина, имеет валентность Fe2+. Молекула гема устроена таким образом, что в ее центре находится двухвалентное железо, которое и захватывает молекулу кислорода в капиллярах альвеол.

Строение гема
Общая формула гема — C34H32O4N4.
Молекулярная масса гема — 616,5 г/моль.
Наличие в крови сильных окислителей (свободных радикалов) приводит к окислению двухвалентного железа до трехвалентного (Fe3+). Гем в этом случае превращается в гематин, а сам гемоглобин в метгемоглобин. Только двухвалентное железо способно присоединять кислород и транспортировать его от альвеол легких до тканей организма, поэтому окисление железа в составе гема и образование метгемоглобина очень негативно сказывается на способности эритроцитов транспортировать кислород, что приводит к гипоксии.
Антиоксиданты (витамины С, А, Е, селен и др.) препятствуют образованию метгемоглобина за счет инактивации свободных радикалов. А вот уже образовавшийся гематин перевести обратно в гем могут только специальные ферменты — НАДН- и НАДФН-метгемоглобинредуктаза. Именно эти ферменты восстанавливают Fe3+ в составе метгемоглобина до Fe2+ гемоглобина.
Глобин
Глобин — это альбуминовый белок, который составляет 96% массы гемоглобина и состоит из 4 цепей — 2 α и 2 β .
 Строение белка глобина — альфа- и бета-цепи
Строение белка глобина — альфа- и бета-цепиКаждая альфа-цепь глобина состоит из 141 аминокислоты, бета-цепь — из 146 аминокислот. Всего в молекуле гемоглобина присутствует 574 аминокислотных остатка.
Глобин человека, в отличие от глобина животных не содержит в своем составе аминокислот лейцин и цистин.
Молекулярный вес глобина составляет 64 400 г/моль (64,4 кДа).
Альфа- и бета-цепи глобина образуют 4 гидрофобным кармана, в которых располагается 4 гема. Именно гидрофобный карман белка глобина позволяет железу гема присоединять кислород не окисляясь, т.е. без перехода в Fe3+. Особое значение в формировании гидрофобного кармана играют 3 аминокислотных остатка: проксимальный гистидин, дистальный гистидин и валин.
Источник
Гемоглобин (Hb)
… среди лабораторных исследований одним из наиболее массовых является исследование концентрации гемоглобина крови.
Гемоглобин – красный пигмент крови (эритроцитов) человека и животных. Подсчитано, что в одном эритроците содержится около ~ 340000000 молекул гемоглобина. В крови человека в среднем содержится ~ 14,5% гемоглобина, его общее количество ~ 750 г. В эритроцитах гемоглобин находится в растворенном состоянии, несмотря на то, что его содержание в них более 30%.
Гемоглобин представляет собой сложный белок, относящийся к группе гемопротеинов; белковый компонент в котором представлен глобином, небелковый – простетической группой. Простетическая группа в молекуле гемоглобина представлена 4 одинаковыми железопорфириновыми соединениями, которые называются гемами. Молекула гема состоит из порфирина IХ, связанного с железом двумя атомами азота ковалентными и двумя другими атомами азота координационными связями. Атом железа (II) расположен в центре гема и придает крови характерный (красный) цвет, степень его окисления не изменяется независимо от присоединения или отдачи кислорода.
Видовые различия гемоглобина обусловлены химическим составом и строением глобина. Гемоглобины представляют собой тетрамерные белки, молекулы которых образованы различными типами полипептидных цепей, обозначаемых как , , , . В состав молекулы входят по 2 полипептидные цепи двух разных типов, каждая из которых оборачивает 1 гем гемоглобина. Гемоглобины различных видов различаются вторичной, третичной и четвертичной структурами, и индивидуальные свойства гемоглобинов неразрывно связаны с их структурами. Известно, что гемоглобин человека состоит из двух равных половин, каждая из которых образована двумя одинаковыми полипептидными цепями. У человека обнаружены гемоглобины различных типов, которые отличаются по химическому строению. В крови взрослого человека содержится гемоглобин А (HbA), состоящий из двух — и двух -полипептидных цепей (22). В дополнение к основному HbA в крови взрослого человека обнаружен гемоглобин A2 (HbA2), состоящий из двух — и двух -полипептидных цепей (22), на долю которого приходится ~ 2,5% от всего гемоглобина. Кроме того, известен фетальный гемоглобин F (HbF) – гемоглобин новорожденных, состоящий из двух — и двух -полипептидных цепей (22), и отличающийся от HbA вторичной, третичной и четвертичной структурами, что обусловливает их различия: по спектральным характеристикам, электрофоретической подвижности, устойчивости к тепловой денатурации и др. Кровь новорожденного ребенка состоит на ~ 80% из HbF, который к концу первого года жизни почти целиком заменяется на HbA (в крови взрослого человека содержится до ~ 1,5% HbF от общего количества гемоглобина).
Физиологическая роль гемоглобина заключается в транспорте кислорода (О2) к органам и тканям, транспорте углекислого газа (СО2) от тканей к легким (образовавшиеся при этом соединения называются оксигемоглобином — HbО2, и карбоксигемоглобином — HbCO2, соответственно); кроме этого он является внутриклеточным буфером, который поддерживает оптимальную для метаболизма pH. Следует заметить, что реакция присоединения молекулярного кислорода не является истинным окислением гемоглобина, так как валентность железа в гене при этом не изменяется, и эту реакцию правильнее называть оксигенацией. Истинное окисление гемоглобина происходит только тогда, когда железо переходит в трехвалентное состояние. В крови гемоглобин существует по крайней мере в четырех формах: оксигемоглобин, дезоксигемоглобин, карбоксигемоглобин, метгемоглобин. В эритроцитах молекулярные формы гемоглобина способны к взаимопревращению, их соотношение определено индивидуальными особенностями организма.
Нормальная концентрация гемоглобина у взрослого колеблется от 130 до 185 г/л (80 — 115 %). За среднюю величину принимают 160 г/л (100 %). При рождении ребенка пуповинная кровь содержит 140 — 190 г/л гемоглобина. Но в течение первых часов антенатальной жизни общая концентрация гемоглобина повышается до 165 — 225 г/л. Через несколько дней после рождения содержание гемоглобина уменьшается и далее в первые месяцы жизни наблюдается трименонредукция (трименонанемия) – нормальное временное постепенное снижение уровня гемоглобина, концентрация которого к третьему месяцу доходит до 63 – 82 % (100 — 130 г/л). Затем содержание гемоглобина медленно повышается и к концу первого года жизни достигает средних величин – около 76 % — 120 г/л (у детей в раннем возрасте нет различия между мужским и женским полом). После первого года жизни повышение продолжается и достигает нормальных (для взрослого) величин в пубертате. Так как у ребенка в первые месяцы жизни наблюдается физиологическая анемия (трименонредукция), следует учитывать, что уменьшение концентрации Hb в этом возрасте до 60 — 65 % не следует считать патологическим состоянием, нуждающимся в лечении.
Нормальные величины гемоглобина у взрослого человека со среднестатистической массой тела: у мужчин — 130 — 160 г/л, у женщин — 120 — 140 г/л. Содержание гемоглобина снижается на ~ 10% в промежутке времени от 17 до 07 час утра, а также после еды. Снижение гемоглобина от нормальных величин на ~ 6% наблюдается при взятии пробы в положении лежа. Незначительное, но диагностически значимое, снижение нижнего порога нормальных величин гемоглобина встречается у мужчин возрастной группы 65 — 74 года.
Клиническое значение:
снижение концентрации гемоглобина: анемии;
повышение концентрации гемоглобина: полицитемия, гемоконцентрация при дегитратации, ожогах, кишечной непроходимости, упорной рвоте; пребывание на больших высотах, чрезмерная физическая нагрузка или возбуждение; сердечно-сосудистая патология, обычно врожденная, приводящая к значительному венозному сбросу; заболевания легких, приводящие к снижению легочной перфузии, плохой аэрации легких, легочной артериальной фистуле; хроническое химическое воздействие нитритов, сульфонамидов, вызывающих образование мет- и сульфогемоглобина.
В лаборатории для определения концентрации гемоглобина чаще всего анализируют производные гемоглобина, образовавшиеся в процессе его окисления и присоединения к гему различных химических групп, приводящих к изменению валентности железа и окраски раствора. «Старыми» методами, все еще применяемыми в ряде лабораторий являются: сапониновый и методе Сали. При использовании сапонинового метода тельца Гейнца (маленькие округлые включения в эритроцитах, образованные из денатурированного гемоглобина) не растворяются, раствор остается мутноватым, за счет чего может меняться спектр поглощения раствора, и ошибка при этом достигает 20 — 30%. В методе Сали измеряется гематин, образовавшийся при взаимодействии гемоглобина с соляной кислотой. Метод основан на визуальной оценке содержания гемоглобина путем сравнения окраски исследуемой пробы со стандартными растворами солянокислого гематина. Ошибка метода достигает ~ 30%, на результаты определения влияют многие факторы: время реакции между гемоглобином и соляной кислотой, которое может колебаться от 2 до 40 мин в зависимости от содержания белков крови; оттенок цвета геминхлорида, зависящий от содержания билирубина в крови; харак-тера освещения и пр.
Химические и спектрофотометрические методы имеют высокую точность и рекомендуются в качестве референсных, но из-за трудоемкости и значительной стоимости анализа для рутинных определений не применяются. Для рутинных лабораторных исследований наиболее предпочтительны колориметрические методы, как наиболее дешевые, простые и быстрые в исполнении. Кровь человека – это нормальная смесь производных гемоглобина с различными спектрами поглощения. При количественном определении гемоглобина колориметрическими методами возникает проблема в выборе реагента, который превращал бы все производные гемоглобина только в одну форму перед фотометрическим анализом. Лучшими методами, количественно превращающими гемоглобин в его производные, оказались гемиглобинцианидный (HbCN), гемихромный (HbChr) и гемиглобиназидный (HbN3), которые при фотометрировании дают наименьшую ошибку определения среди других методов анализа.
Источник
Гемоглобин
Гемоглобин (от др.-греч. Гемо — кровь и лат. globus — шар) – это сложная белковая молекула внутри красных клеток крови – эритроцитов (у человека и позвоночных животных). Гемоглобин составляет примерно 98% массы всех белков эритроцита.
 Гемоглобин (от др.-греч. Гемо — кровь и лат. globus — шар) – это сложная белковая молекула внутри красных клеток крови – эритроцитов (у человека и позвоночных животных). Гемоглобин составляет примерно 98% массы всех белков эритроцита. За счет своей структуры гемоглобин участвует в переносе кислорода от легких к тканям, и оксида углерода обратно.
Гемоглобин (от др.-греч. Гемо — кровь и лат. globus — шар) – это сложная белковая молекула внутри красных клеток крови – эритроцитов (у человека и позвоночных животных). Гемоглобин составляет примерно 98% массы всех белков эритроцита. За счет своей структуры гемоглобин участвует в переносе кислорода от легких к тканям, и оксида углерода обратно.
Строение гемоглобина
Гемоглобин состоит из двух цепей глобина типа альфа и двух цепей другого типа (бета, гамма или сигма), соединенными с четырьмя молекулами гемма, содержащего железо. Структура гемоглобина записывается буквами греческого алфавита: α2γ2.
Обмен гемоглобина
Гемоглобин образуется эритроцитами в красном костном мозге и циркулирует с клетками в течение всей их жизни – 120 дней. Когда селезенкой удаляются старые клетки, компоненты гемоглобина удаляются из организма или поступают обратно в кровоток, чтобы включиться в новые клетки.
Типы гемоглобина
К нормальным типам гемоглобина относится гемоглобин А или HbA (от adult — взрослый), имеющий структуру α2β2, HbA2 (минорный гемоглобин взрослого, имеющий структуру α2σ2 и фетальный гемоглобин (HbF, α2γ2. Гемоглобин F – гемоглобин плода. Замена на гемоглобин взрослого полностью происходит к 4-6 месяцам (уровень фетального гемоглобина в этом возрасте менее 1%). Эмбриональный гемоглобин образовывается через 2 недели после оплодотворения, в дальнейшем, после образования печени у плода, замещается фетальным гемоглобином.
| Тип гемоглобина | Процент содержания у взрослого человека |
| HbA — взрослый гемоглобин | 98% |
| HbA2 – взрослый гемоглобин минорный | Около 2% |
| HbFi – фетальный гемоглобин | 0,5-1% |
| Эмбриональный гемоглобин | нет |
| HbA1C – гликированный гемоглобин | |
Аномальных гемоглобинов более 300, их называют по месту открытия.
Функция гемоглобина
Основная функция гемоглобина – доставка кислорода от легких к тканям и углекислого газа обратно.
Формы гемоглобина
- Оксигемоглобин – соединение гемоглобина с кислородом. Оксигемоглобин преобладает в артериальной крови, идущей от легких к тканям. Из-за содержания оксигемоглобина артериальная кровь имеет алый цвет.
- Восстановленный гемоглобин или дезоксигемоглобин (HbH) — гемоглобин, отдавший кислород тканям
- Карбоксигемоглобин – соединение гемоглобина с углекислым газом. Находится в венозной крови и придает ей темный вишневый цвет.
Как же это происходит? Почему в легких гемоглобин забирает, а в тканях отдает кислород?
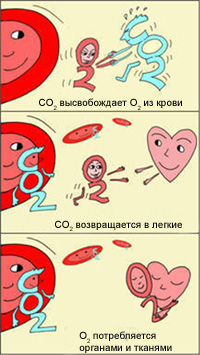 Эффект Бора
Эффект Бора
Эффект был описан датским физиологом Христианом Бором https://en.wikipedia.org/wiki/Christian_Bohr (отцом знаменитого физика Нильса Бора).
Христиан Бор заявил, что при большей кислотности (более низкое значение рН, например, в тканях) гемоглобин будет меньше связываться с кислородом, что позволит его отдать.
В легких, в условиях избытка кислорода, он соединяется с гемоглобином эритроцитов. Эритроциты с током крови доставляют кислород ко всем органам и тканям. В тканях организма с участием поступающего кислорода проходят реакции окисления. В результате этих реакций образуются продукты распада, в том числе, углекислый газ. Углекислый газ из тканей переносится в эритроциты, из-за чего уменьшается сродство к кислороду, кислород выделяется в ткани.
Эффект Бора имеет громадное значение для функционирования организма. Ведь если клетки интенсивно работают, выделяют больше СО2, эритроциты могут снабдить их большим количеством кислорода, не допуская кислородного «голодания». Следовательно, эти клетки могут и дальше работать в высоком темпе.
 Какой уровень гемоглобина в норме?
Какой уровень гемоглобина в норме?
В каждом миллилитре крови содержится около 150 мг гемоглобина! Уровень гемоглобина меняется с возрастом и зависит от пола. Так, у новорожденных гемоглобин значительно выше, чем у взрослых, а у мужчин выше, чем у женщин.
Что еще влияет на уровень гемоглобина?
Некоторые другие состояния также влияют на уровень гемоглобина, например, пребывание на высоте, курение, беременность.
Заболевания, связанные с изменением количества или структуры гемоглобина
- Повышение уровня гемоглобина наблюдается при эритроцитозах, обезвоживании.
- Снижение уровня гемоглобина наблюдается при различных анемиях.
- При отравлении угарным газом образуется карбгемоглобин (не путайте с карбоксигемоглобином!), который не может присоединять кислород.
- Под действием некоторых веществ образуется метгемоглобин.
- Изменение структуры гемоглобина называется гемоглобинопатией. Самые известные и частые заболевания этой группы – серповидно-клеточная анемия, бета-талассемия, персистенция фетального гемоглобина. См.гемоглобинопатии на сайте Всемирной организации здравоохранения https://www.who.int/mediacentre/factsheets/fs308/ru/index.html
Знаете ли Вы?
- У беспозвоночных животных гемоглобин растворен в плазме крови.
- В сутки из легких в ткани переносится около 600 литров кислорода!
- Красный цвет крови придает гемоглобин, входящий в состав эритроцитов. У некоторых червей вместо гемоглобина хлорокруорин и кровь зеленая. А у каракатиц, скорпионов и пауков голубая, так как вместо гемоглобина – содержащий медь гемоцианин.

Другие статьи раздела
Распространенный возбудитель инфекций дыхательных путей (фарингиты, синуситы, отиты, бронхиты и пневмонии). Анализы на антитела используются для диагностики инфекции Chlamydophila pneumoniae при длительных инфекциях дыхательных путей.
Mycoplasma pneumoniae — возбудитель пневмонии человека, острых респираторных заболеваний (ОРЗ), заболеваний верхних дыхательных путей (фарингита, бронхита), а также некоторых нереспираторных заболеваний.
Азооспермия (azoospermia) — отсутствие сперматозоидов в эякуляте
Бактерии – одноклеточные микроорганизмы, некоторые из которых могут вызывать заболевания.
Mycoplasma pneumoniae (микоплазма пневмонии), Chlamydohpila pneumoniae (хламидофила пневмонии, прежнее название Chlamydia pneumoniae)
Гипофиз – непарная железа внутренней секреции, расположенная на основании головного мозга в костном кармане – гипофизарной ямке турецкого седла. Гипофиз вырабатывает гормоны, оказывающие влияние на работу всего организма – рост и развитие, обмен веществ, половую функцию.
Повышенный рост волос (гирсутизм) может быть следствием не только повышенного уровня андрогенов (см. «гиперандрогения»), но и высокой активности 5-альфа-редуказы в коже (фермента волосяных фолликулов, превращающего тестостерон в гораздо более активный дигидротестостерон.
По данным ВОЗ (Всемирная организация здравоохранения) заболеваемость в России составляет более 50 человек на 100 000 населения. Имеет важное значение то, что у женщин значительно чаще чем у мужчин (50-90% против 10%) возможно бессимптомное течение заболевания.
Делеция (ген.) – вид хромосомных мутаций, при котором происходит потеря какого-либо участка хромосомы.
Механизм обратной связи – система, которая используется организмом для контроля некоторых функций и поддержания состояния постоянства организма. Механизм обратной связи использует один из продуктов пути обмена веществ, обычно конечный продукт, для контроля активности пути обмена веществ и регуляции количества этого продукта. Обратная связь может быть отрицательной и положительной.
Источник