Сколько молекул кислорода присоединяет одна молекула гемоглобина
Содержание статьи
14.13.1. ранспорт кислорода [1990 Грин Н., Стаут У., Тейлор Д.
14.13.1. Транспорт кислорода
Кислород переносят молекулы гемоглобина, содержащиеся в эритроцитах. Гемоглобин представляет собой тетрамерный белок с мол. массой 68000. В его состав в качестве простетических групп входят четыре молекулы гема, которые присоединены к четырем полипептидным цепям глобина и придают крови характерный красный цвет. Каждый гем содержит один атом двухвалентного железа, непрочно связывающего одну молекулу кислорода (рис. 14.62):
Нb + 4O2 ↔ НbO8.

Рис. 14.62. Строение молекулы гема
Присоединение кислорода к гемоглобину с образованием оксигемоглобина происходит при высоком парциальном давлении кислорода-таком, как в капиллярах легочных альвеол. При низком парциальном давлении кислорода (как в капиллярах метаболически активных тканей) связь между кислородом и гемоглобином становится непрочной, кислород освобождается и диффундирует в окружающие клетки.
Количество кислорода, которое может связаться с гемоглобином, зависит от напряжения кислорода в среде. Последнее выражают как парциальное давление кислорода в атмосфере, находящейся в равновесии с данной средой. Парциальное давление до сих пор выражают в миллиметрах ртутного столба. Например, атмосферное давление на уровне моря составляет 760 мм рт. ст. Кислород составляет около 1/5 атмосферного воздуха; следовательно, его парциальное давление на уровне моря равно примерно 1/5⋅760 = 152 мм рт. ст.
Определяя процент насыщения крови кислородом при различном парциальном давлении O2, получают S-образную кривую, называемую кривой диссоциации оксигемоглобина (рис. 14.63).

Рис. 14.63. Этот график поясняет термины, принятые для описания кривых диссоциации пигментов, переносящих кислород. Напряжение насыщения — это то напряжение кислорода, при котором насыщено кислородом 95% пигмента, а напряжение полунасыщения — то, при котором насыщено кислородом 50% пигмента. (Из Florey, An introduction to general and comparative physiology, 1966, W. B. Saunders and Co.)
Анализ этой кривой показывает, что в физиологическом плане гемоглобин можно считать полностью насыщенным кислородом при таком напряжении О2, при котором фактически насыщается 95% гемоглобина. В примере, приведенном на рис. 14.63, такое напряжение составляет около 73 мм рт. ст. При более высоком парциальном давлении О2 может происходить дальнейшее его поглощение, но 100%-ное насыщение гемоглобина достигается редко. При парциальном давлении кислорода около 30 мм рт. ст. только 50% гемоглобина находится в форме оксигемоглобина, а при нулевом парциальном давлении О2 молекулы гемоглобина вообще не связывают кислород. В области крутого наклона кривой уже при небольшом снижении парциального давления О2 процент насыщения гемоглобина значительно уменьшается. Кислород, освобождаемый пигментом, становится доступным для тканей.
Почему же кривая насыщения имеет S-образную форму? Такая форма кривой объясняется аллостерическим характером взаимодействия гемоглобина с кислородом (разд. 6.6). Когда молекула О2 связывается с атомом двухвалентного железа одного из гемов, конфигурация этого гема слегка изменяется. Это изменение отражается на конфигурации всей молекулы гемоглобина, которая определенным образом меняется. По мере присоединения кислорода к второй и третьей группам гема происходит дальнейшее изменение конфигурации гемоглобина, и в результате каждая последующая молекула О2 присоединяется легче, чем предыдущая (явление кооперативности), так что последний гем связывает кислород в несколько сотен раз легче, чем первый.
Обратный процесс происходит тогда, когда оксигемоглобин оказывается в области низкого парциального давления О2, как это бывает в активно дышащих тканях. Первую молекулу кислорода оксигемоглобин отдает тканям очень легко, но вторая, третья и четвертая молекулы отделяются значительно труднее и только при очень сильном снижении парциального давления O2. При повышении парциального давления СО2 кривая диссоциации оксигемоглобина сдвигается вправо, и это явление называют эффектом Бора (рис. 14.64).

Рис. 14.64. Кривые диссоциации оксигемоглобина при различном парциальном давлении СО2, иллюстрирующие эффект Бора. (Из Garth Chapman, The body fluids and their function, Studies in Biology, № 8, 1967, Arnold.)
14.37. Каково физиологическое значение эффекта Бора?
14.38. Рассмотрите рис. 14.65. Кривая диссоциации оксигемоглобина у плода сдвинута влево по сравнению с кривой для матери. Чем объясняется такое смещение?
14.39. Кривая диссоциации оксигемоглобина у южноамериканских лам, живущих в Андах на высоте около 5000 м над уровнем моря, расположена левее, чем у большинства других млекопитающих (рис. 14.66). Чем это можно объяснить?

Рис. 14.65. Кривые диссоциации оксигемоглобина в крови плода и матери у овцы

Рис. 14.66. Сравнение кривых диссоциации оксигемоглобина у ламы и других млекопитающих
Отдельные представители мужского пола предпочитают дорогих индивидуалок. На этом веб-ресурсе https://prostitutkinovosibirskagirls.com/sex-nations/negrityanki/ вы найдете огромный перечень весомых шлюх негритянок на любой вкус.
Источник
вязывание гемоглобина с кислородом. Обмен железа
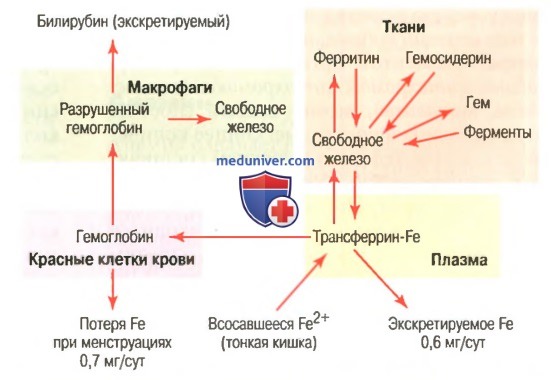
Связывание гемоглобина с кислородом. Обмен железаНаиболее важным свойством гемоглобиновой молекулы является ее способность свободно и обратимо связываться с кислородом. Эта способность детально изложена в отдельной статье на сайте в связи с дыханием (просим вас пользоваться формой поиска выше), поскольку главной функцией гемоглобина в организме является соединение его с кислородом в легких и затем освобождение этого кислорода в тканевых капиллярах, где парциальное давление кислорода гораздо ниже, чем в легких. Кислород не соединяется с двумя положительными связями железа гемоглобиновой молекулы. Вместо этого он связывается с так называемыми координационными связями атома железа. Это чрезвычайно свободная связь, поэтому соединение легко обратимо. Более того, кислород не переходит в ионную форму и переносится в виде молекулярного кислорода (составленного из двух атомов кислорода) к тканям, где легко освобождается в тканевые жидкости в форме молекулярного кислорода, а не иона кислорода. Обмен железа (метаболизм железа)Поскольку железо необходимо для формирования не только гемоглобина, но и других жизненно важных элементов организма (например, миоглобина, цитохромов, цитохромоксидазы, пероксидазы, катализы), важно понять способы утилизации железа в организме. Общее количество железа в теле человека в среднем составляет 4-5 г, причем около 65% этого количества входит в состав гемоглобина. Примерно 4% железа входит в состав миоглобина, 1% находится в составе различных гем-соединений, способствующих внутриклеточному окислению, 0,1% связан с белком трансферрином в плазме крови и 15-30% накапливаются для последующего использования в основном в ретикулоэндотелиальной системе и клетках паренхимы печени главным образом в форме ферритина.
а) Транспорт и накопление железа. Транспорт, накопление и метаболизм железа в организме схематически представлены на рисунке выше. После всасывания из тонкого кишечника железо немедленно связывается в плазме крови с бета-глобулином (апотрансферрином), формируя трансферрин, который затем транспортируется в плазме. Железо в трансферрине связано свободно и, следовательно, может высвобождаться в любую тканевую клетку в любой точке тела. Избыток железа в крови откладывается в основном в гепатоцитах и в меньшей степени — в ретикулоэндотелиальных клетках костного мозга. В цитоплазме клеток железо связывается главным образом с белком апоферритином, формируя ферритин. Молекулярная масса апоферритина — около 460000, и с этой большой молекулой может соединяться в кластеры радикалов железа разное количество железа; следовательно, ферритин может содержать как большое, так и небольшое количество железа. Железо, которое накапливается в виде ферритина, называют резервным железом. Меньшая часть этого резерва хранится в совершенно нерастворимой форме, называемой гемосидерином. Он в основном формируется, когда общее количество железа в теле больше, чем может связать апоферритин. Гемосидерин собирается в клетках в виде больших кластеров, которые видны под микроскопом, как большие частицы. Наоборот, частицы ферритина так малы и рассеяны, что их можно обычно увидеть в цитоплазме клеток только с помощью электронного микроскопа. Когда уровень железа в плазме падает до низких значений, некоторое его количество из запаса в форме ферритина легко выделяется в плазму и транспортируется в виде трансферрина к нуждающимся в железе областям. Уникальной особенностью молекулы трансферрина является то, что она прочно связывается с рецепторами клеточной мембраны эритробластов в костном мозге. Затем вместе со связанным железом молекула поглощается эритробластом путем эндоцитоза. Внутри клетки трансферрин освобождает железо прямо в митохондрии, где синтезируется гем. При отсутствии адекватного количества трансферрина в крови людей недостаточность транспорта железа к эритробластам может вызвать тяжелую гипохромную анемию, которая характеризуется наличием красных клеток крови, содержащих гораздо меньше гемоглобина, чем в норме. Когда эритроциты завершают свой жизненный путь и разрушаются, гемоглобин, выделившийся из клеток, поглощается моноцитарно-макрофагальными клетками. Железо при этом освобождается и накапливается преимущественно в виде ферритина, чтобы использовать ся, когда необходимо, для формирования нового гемоглобина. б) Ежедневная потеря железа. Мужчина выделяет примерно 0,6 мг железа ежедневно, главным образом с фекалиями. Дополнительное количество железа теряется при кровотечении. У женщин дополнительная менструальная потеря крови дает долговременную потерю железа в среднем примерно до 1,3 мг/сут. — Также рекомендуем «Всасывание железа в кишечнике. Длительность жизни эритроцитов» Оглавление темы «Эритропоэз. Белые клетки крови»: |
Источник
родство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.
Оглавление темы «Вентиляция легких. Перфузия легких кровью.»: Сродство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.Молекула гемоглобина может находиться в двух формах — напряженной и расслабленной. Расслабленная форма гемоглобина имеет свойство насыщаться кислородом в 70 раз быстрее, чем напряженная. Изменение фракций напряженной и расслабленной формы в общем количестве гемоглобина в крови обусловливает S-образный вид кривой диссоциации оксигемоглобина, а следовательно, так называемое сродство гемоглобина к кислороду. Если вероятность перехода от напряженной формы гемоглобина к расслабленной больше, то возрастает сродство гемоглобина к кислороду, и наоборот. Вероятность образования указанных фракций гемоглобина изменяется в большую или меньшую сторону под влиянием нескольких факторов. Основной фактор — это связывание кислорода с геминовой фуппой молекулы гемоглобина. При этом чем больше геминовых фупп гемоглобина связывают кислород в эритроцитах, тем более легким становится переход молекулы гемоглобина к расслабленной форме и тем выше их сродство к кислороду. Поэтому при низком Р02, что имеет место в метаболически активных тканях, сродство гемоглобина к кислороду ниже, а при высоком Р02 — выше. Как только гемоглобин захватывает кислород, повышается его сродство к кислороду и молекула гемоглобина становится насыщенной при связывании с четырьмя молекулами кислорода.
Когда эритроциты, содержащие гемоглобин, достигают тканей, то кислород из эритроцитов диффундирует в клетки. В мышцах он поступает в своеобразного депо кислорода — в молекулы миоглобина, из которого кислород используется в биологическом окислении мышц. Диффузия кислорода из гемоглобина эритроцитов в ткани обусловлена низким Р02 в тканях — 35 мм рт. ст. Внутри клеток тканей напряжение кислорода, необходимое для поддержания нормального метаболизма, составляет еще меньшую величину — не более 1 кПа. Поэтому кислород путем диффузии из капилляров достигает метаболически активных клеток. Некоторые ткани приспособлены к низкому содержанию Р02 в капиллярах крови, что компенсируется высокой плотностью капилляров на единицу объема тканей. Например, в скелетной и сердечной мышцах Р02 в капиллярах может снизиться чрезвычайно быстро во время сокращения. В мышечных клетках содержится белок миоглобин, который имеет более высокое сродство к кислороду, чем гемоглобин. Миоглобин интенсивно насыщается кислородом и способствует его диффузии из крови в скелетную и сердечную мышцы, где он обусловливает процессы биологического окисления. Эти ткани способны экстрагировать до 70 % кислорода из крови, проходящей через них, что обусловлено снижением сродства гемоглобина к кислороду под влиянием температуры тканей и рН. Эффект рН и температуры на сродство гемоглобина к кислороду. Молекулы гемоглобина способны реагировать с ионами водорода, в результате этой реакции происходит снижение сродства гемоглобина к кислороду. При насыщении гемоглобина менее 100 % низкое рН понижает связывание кислорода с гемоглобином — кривая диссоциации оксигемоглобина смещается вправо по оси х. Это изменение свойства гемоглобина под влиянием ионов водорода называется эффектом Бора. Метаболически активные ткани продуцируют кислоты, такую как молочная, и С02. Если рН плазмы крови снижается от 7,4 в норме до 7,2, что имеет место при сокращении мыщц, то концентрация кислорода в ней будет возрастать вследствие эффекта Бора. Например, при постоянном рН 7,4 кровь отдавала бы порядка 45 % кислорода, т. е. насыщение гемоглобина кислородом снижалось до 55 %. Однако когда рН снижается до 7,2, кривая диссоциации смещается по оси х вправо. В результате насыщение гемоглобина кислородом падает до 40 %, т. е. кровь может отдавать в тканях до 60 % кислорода, что на 1/з больше, чем при постоянном рН.
Метаболически активные ткани повышают продукцию тепла. Повышение температуры тканей при физической работе изменяет соотношение фракций гемоглобина в эритроцитах и вызывает смещение кривой диссоциации оксигемоглобина вправо вдоль оси х. В результате большее количество кислорода будет освобождаться из гемоглобина эритроцитов и поступать в ткани. Эффект 2,3-дифосфоглицерата (2,3-ДФГ) на сродство гемоглобина к кислороду. При некоторых физиологических состояниях, например при понижении Р02 в крови ниже нормы (гипоксия) в результате пребывания человека на большой высоте над уровнем моря, снабжение тканей кислородом становится недостаточным. При гипоксии может понижаться сродство гемоглобина к кислороду вследствие увеличения содержания в эритроцитах 2,3-ДФГ. В отличие от эффекта Бора, уменьшение сродства гемоглобина к кислороду под влиянием 2,3-ДФГ не является обратимым в капиллярах легких. Однако при движении крови через капилляры легких эффект 2,3-ДФГ на снижение образования оксигемоглобина в эритроцитах (плоская часть кривой диссоциации оксигемоглобина) выражен в меньшей степени, чем отдача кислорода под влиянием 2,3-ДФГ в тканях (наклонная часть кривой), что обусловливает нормальное кислородное снабжение тканей. — Также рекомендуем «Углекислый газ. Транспорт углекислого газа.» |
Источник