Спектр поглощения гемоглобина и его производных
СПЕКТРЫ ПОГЛОЩЕНИЯ ГЕМОГЛОБИНА И ЕГО ПРОИЗВОДНЫХ У ЖИВОТНЫХ творческая работа учащихся по биологии (9 класс) на тему
УЧРЕЖДЕНИЕ ОБРАЗОВАНИЯ «ГОСУДАРСТВЕННАЯ
ОБЩЕОБРАЗОВАТЕЛЬНАЯ СРЕДНЯЯ ШКОЛА № 28 Г. ВИТЕБСКА»
СПЕКТРЫ ПОГЛОЩЕНИЯ ГЕМОГЛОБИНА И ЕГО
ПРОИЗВОДНЫХ У ЖИВОТНЫХ
Исполнители:
Шустова О.С., Савицкая Т.В., 9 «Б» класс
Научные руководители:
Баран В.П., кандидат биологических наук, доцент УО «Витебская ордена «Знак почета» государственная академия ветеринарной медицины»
Баран Е.Н., учитель биологии
Хвалько Н.Г., учитель физики
2008 г.
Цель: Исследование спектров поглощения гемоглобина и его производных у различных видов животных.
Задачи: 1)Определение содержания гемоглобина в крови животных; 2) Определение спектров поглощения оксигемоглобина, дезоксигемоглобина и метгемоглобина в крови кролика, овцы, теленка.
Гемоглобин — это глобулярный белок способный связывать и переносить молекулярный кислород. Гемоглобин является основным компонентом эритроцитов теплокровных животных. Он является основным компонентом эритроцитов высших животных. В одном эритроците содержится около 280 миллионов молекул гемоглобина, каждая из которых состоит примерно из 10 тысяч атомов водорода, углерода, азота, кислорода, серы и железа. Молекулярная масса гемоглобина человека равна 68000
Гемоглобин относят к сложным белкам, в составе которого в качестве небелковой части выступает порфириновое ядро гемма, которое связано с белком глобином. Гемм по строению одинаков у различных видов животных, а видовые различия гемоглобина связаны со строением глобина.
Основная функция гемоглобина — обратимое связывание молекулярного кислорода и доставка его во все клетки организма и связывание углекислого газа в тканях и его транспортировка к легким. В состоянии покоя в крови растворяется до 200 мл кислорода в минуту. При сильных физических нагрузках количество растворенного кислорода увеличивается в 10 раз до 2-3 л в минуту. В среднем грамм гемоглобина поглощает до 1,34 мл кислорода.
Гемоглобин — представитель гемопротеинов, т.е. группы сложных белков. Молекула его состоит из четырех субъединиц — двух α и двух β- субъединиц. Полипептидная цепь каждой из субъединиц специфическим образом уложена вокруг большого плоского железосодержащего гема. Все четыре цепи гемоглобина сходны между собой по форме. Форма и функция гемоглобинов различных животных сходны, однако аминокислотный состав их различается и тем сильнее, чем дальше эволюционно они удалены друг от друга.
Гем только в связи с нативным глобином способен лабильно связывать кислород. При поглощении кислорода β-цепи гемоглобина сближаются, при отдаче его — расходятся. Положение α-цепей при этом не меняется. Следовательно, присоединение и отдача кислорода молекулой гемоглобина сопровождается изменением его структуры, что приводит к изменению спектра поглощения гемоглобина. Присоединив молекулу кислорода, гемоглобин переходит в оксигенированную форму (HbO2) [2.503,585].
При присоединении к молекуле гемоглобина углекислого газа образуется карбоксигемоглобин. Таким образом, углекислый газ переносится от тканей к легким. Если на гемоглобин подействовать сильными окислителями (оксидами азота, парами нитробензола и другим сильными окислителями) он превращается в метгемоглобин (HbOH). В метгемоглобине железо находится в трехвалентном состоянии, в то время как в восстановленном и в оксигенированном гемоглобине — в двухвалентном. Метгемоглобин вне организма образуется при длительном выдерживании на воздухе растворов оксигемоглобина. Каждая форма гемоглобина характеризуется определенным спектром поглощения, представляющим собой зависимость оптической плотности раствора гемоглобина от длины волны света.
По литературным данным наиболее интенсивной полосой в спектре поглощения гемоглобина является полоса Соре, принадлежащая порфириновой части его молекулы. По изменению положения и интенсивности поглощения этой полосы можно судить о структурных изменениях молекул различных форм гемоглобина (таблицу 1).
Спектры поглощения различных форм гемоглобина применяются в клинической практике при выявлении отравлений у человека и животных, а также в судебной медицинской и ветеринарной практике.
Таблица 1- Спектральные характеристики различных форм гемоглобина человека
α-полоса | β-полоса | Полоса Соре | ||||
λ, нм | ελ , М-1см-1 | λ, нм | ελ , М-1см-1 | λ, нм | ελ , М-1см-1 | |
Оксигемоглобин | 577 | 14600 | 542 | 13800 | 412 | 135000 |
Дезоксигемоглобин | 555 | 13500 | 430 | 119000 | ||
Карбоксигемоглобин | 569 | 13400 | 539 | 13400 | 419 | 191000 |
Материалы и методы исследований. Для проведения исследований использовали венозную кровь кролика, овцы, теленка, стабилизированную гепарином, растворенным в 0,85% растворе хлорида натрия. Схема эксперимента состояла из четырех этапов: 1)Определение содержания гемоглобина в крови животных; 2) Определение спектров поглощения оксигемоглобина, дезоксигемоглобина и метгемоглобина. Материалом для исследований служила цельная стабилизированная кровь кролика, овцы, теленка, гемолизаты эритроцитов.
Исследование содержания гемоглобина в крови животных проводили гемиглобинцианидным методом с использованием наборов НТПК «Анализ Х». Стабилизированную кровь добавляли к 5 мл трансформирующего раствора. В интервале 10-45 минут содержание гемоглобина определяли фотометрией на фотоэлектроколориметре КФК-3 при длине волны 540 нм против трансформирующего раствора. Определение спектров поглощения проводили в гемолизатах крови животных, приготовленных из эритроцитарной суспензии. Для получения эритроцитарной суспензии стабилизированную кровь центрифугировали в течение 20 минут при 3000 об/мин. Полученную плазму отбирали, проводили четырехкратную отмывку эритроцитов 0,85% раствором NaCl с последующим центрифугированием. Гемолиз эритроцитов проводили дистиллированной водой. Восстановленный гемоглобин получали добавлением к раствору оксигемоглобина насыщенного раствора сульфата аммония. Раствор метгемоглобина — добавлением раствора железосинеродистого калия. Исследование спектров поглощения различных форм гемоглобина проводили в его растворах с конечным разведением 1:25. Спектры поглощения снимали на спектрофотометре СФ-46 в интервале длин волн 380-600 нм.
Собственные исследования. В результате исследования содержания гемоглобина в крови животных было установлено, что уровень гемоглобина в крови овцы 136,35 г/л, теленка -106,01 г/л, кролика-100,75 г/л и находился в пределах физиологической нормы.
Рисунок 1.- Содержание гемоглобина в крови различных сельскохозяйственных животных
Исследование спектров поглощения показало, что оксигемоглобин кролика максимальную оптическую плотность проявлял при 415, 540 и 580 нм (рис. 2). В тоже время оксигемоглобин теленка аналогичные свойства проявлял при 400,420,540 и 580 нм. Спектры поглощения оксигемоглобина овцы имели ряд особенностей, поскольку максимум оптической плотности проявлялся в интервале 410-420 нм, а также при 540 и 580 нм. Обращает на себя внимание сходность спектров поглощения всех исследованных животных при высоких длинах волн. В тоже время существенные различия проявляются в интервале 400-420 нм, что связано со свойствами и строением белковой молекулы.
Рисунок 2.-Спектры поглощения оксигемоглобина у различных видов сельскохозяйственных животных
При исследовании спектров поглощения восстановленного гемоглобина (рис. 3) было установлено, что дезоксигемоглобин кролика имел максимумы поглощения в интервале 410-420 нм, а также при 540 и 580 нм. Оптическая плотность восстановленного гемоглобина овцы была максимальной при 415, 540, 580 нм. Спектры поглощения восстановленного гемоглобина теленка имели ряд особенностей. Обращает на себя внимание примерно сходные высокие величины оптической плотности в интервале 400-420 нм, пики при 540 и 580 нм, и минимальным значением оптической плотности при 520 нм, чего не регистрировалось у других животных.
В результате исследования спектров поглощения метгемоглобина (рис.4) кролика было выявлено, что максимумы поглощения проявлялись при 415, 540, 580 нм и минимум поглощения — при 500 нм. Метгемоглобин овцы проявлял максимальные значения оптической плотности в интервале 410-415 нм, а также при 535 нм, имел минимальные значения при 580 нм. Метгемоглобин теленка характеризовался двумя интервалами максимумов оптической плотности при 400-420 нм и 535-540нм, при этом регистрировался минимум поглощения при 580 нм.
Рисунок 3.-Спектры поглощения восстановленного гемоглобина различных видов сельскохозяйственных животных
Рисунок 4.-Спектры поглощения метгемоглобина различных видов сельскохозяйственных животных
Выводы:
1.Наиболее значимые различия по спектрам поглощения окси- и дезоксигемоглобина выявлены в интервале 410-425 нм. Максимумы поглощения окси- и дезоксигемоглобина кролика и овцы при 415нм, теленка-420 нм. Спектры поглощения гемоглобина и дезоксигемоглобина у животных в зелено-желтой части спектра сходны.
2. Метгемоглобин животных имеет более широкий диапазон спектров поглощения, что выражается в наличии интервалов долин волн со сходной оптической плотностью.
Список использованной литературы:
1.Павленко, Ю.Г.Физика /Ю.Г. Павленко. -М.:Джангар,2001
2. Березов, Т.Т. Биологическая химия: учебник / Т.Т. Березов, Б.Ф. Коровкин. — М.: Медицина, 1998. — 704 с.
3.Элементарный учебник физики /Под ред Г.С. Ландберга.-М.:Наука, 1966.4.Рубина, А.Б. Биофизика /А.Б. Рубина.-М.: Высшая школа, 1987.
Источник
Лабораторная работа №22
Изучение оптических свойств различных форм гемоглобина
Каждая форма гемоглобина характеризуется определенным спектром поглощения, представляющим собой зависимость оптической плотности раствора гемоглобина от длины волны света. Наиболее интенсивной полосой в спектре поглощения гемоглобина является полоса Соре, принадлежащая порфириновой части его молекулы (рис. 5).
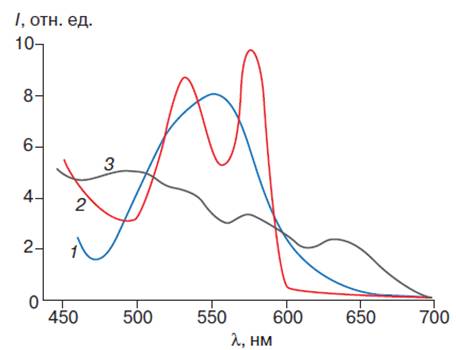
Рис. 5. Спектр поглощения производных гемоглобина. Спектры поглощения дезоксигемоглобина (1), оксигемоглобина (2) и ферригемоглобина (3)
По изменению положения и интенсивности поглощения этой полосы можно судить о структурных изменениях молекул различных форм гемоглобина (табл. 22).
Таблица 22
Спектральные характеристики различных форм гемоглобина
Формы гемоглобина | α-Полоса | β-Полоса | Полоса Соре | |||
λ, нм | ελ, М-1см-1 | λ, нм | ελ, М-1см-1 | λ, нм | ελ, М-1см-1 | |
Оксигемоглобин | 557 | 14600 | 542 | 13800 | 412 | 135000 |
Дезоксигемоглобин | 555 | 13500 | 430 | 119000 | ||
Карбоксигемоголобин | 569 | 13400 | 539 | 13400 | 419 | 191000 |
Оборудование и материалы. СФ-(46) или другой спектрофотометр, центрифуга на 9000 об/мин, центрифужные пробирки, кюветы, пенициллиновые флаконы, пипетки Пастера, прибор для получения оксида углерода, гемоглобин кристаллический, хлористый натрий, гепарин, бихромат калия, феррицианид калия, дитионит натрия.
Получение раствора оксигемоглобина. Для работы рекомендуется использовать свежеприготовленные растворы гемоглобина. Кровь берут у декапитированных животных. Цельную кровь стабилизируют гепарином, растворенным в 0,85%-ном растворе хлористого натрия. Для отделения плазмы стабилизированную кровь центрифугируйте в течение 10 мин при 3000 об/мин. Плазму крови отберите пипеткой. К эритроцитам добавьте трехкратный объем 0,85%-ного раствора хлористого натрия, осторожно при этом размешивая суспензию стеклянной палочкой. Суспензию центрифугируйте в течение 5 мин при 6000 об/мин. Промойте эритроциты 3 раза. Промытые эритроциты подвергните гемолизу дистиллированной водой в течение 20 мин. Стромы осадите центрифугированием при 9000 об/мин в течение 15 мин. В прозрачном гемолизате определите содержание гемоглобина с помощью приведенного в работе № 20 метода.
Ход анализа
Регистрация спектра поглощения оксигемоглобина. Раствор оксигемоглобина разбавьте дистиллированной водой до оптической плотности раствора, попадающей в диапазон 0,4-0,5. Снимите спектр поглощения раствора оксигемоглобина в интервале длин волн 380-600 нм (оптическая плотность раствора измеряется через каждые 5 нм).
Регистрация спектра поглощения метгемоглобина. Добавьте к раствору оксигемоглобина 1-2 капли насыщенного раствора феррицианида калия. Визуально оцените изменение окраски. Раствор метгемоглобина имеет коричневую окраску. Снимите спектр поглощения раствора гемоглобина в интервале длин волн 380-600 нм. Для компенсации светопоглощения за счет феррицианида в контроль добавьте такой же объем раствора этого вещества, какой был добавлен к раствору оксигемоглобина.
Регистрация спектра поглощения метгемоглобина. Добавьте к водному раствору оксигемоглобина несколько кристаллов дитионита натрия (Na2S2O4). Визуально оцените изменение окраски. Ярко алая окраска (цвет оксигемоглобина) переходит в синевато-красную, характерную для гемоглобина. Снимите спектр поглощения раствора в интервале длин волн 380-600 нм.
ЗАДАНИЕ
1. Представьте в графическом виде зависимость оптической плотности различных состояний гемоглобина от длины поглощаемого света (спектр поглощения), откладывая по оси ординат оптическую плотность раствора, а по оси абсцисс соответствующие длины волн.
2. Найдите минимумы и максимумы поглощения гемоглобинов и сделайте вывод.
Источник
Поглощение света и цвет гемоглобина.Цвет растворенного вещества, не испускающего световые лучи, зависит от его способности поглощать падающий свет в той или иной части спектра видимого света. Как правило, каждое вещество поглощает свет лишь в определенной области спектра, тогда как свет других длин волн проходит через это вещество почти беспрепятственно. Цвет раствора вещества определяется спектральным составом прошедшего через него света. Красный цвет растворов гемоглобина (и, следовательно, крови) обусловлен тем, что это вещество относительно сильно поглощает коротковолновый свет, т. е. в синей области спектра, а большую часть длинноволнового (красного) света пропускает. При исследовании света, прошедшего через раствор оксигенированного гемоглобина, с помощью спектроскопа можно обнаружить не только полосу поглощения в синей области спектра (полосу Соре), но также две характерные темные полосы (полосы поглощения) в желтой и желто-зеленой областях спектра с максимумами при длинах волн 577 и 541 нм [11]. Дезоксигемоглобин несколько интенсивнее, чем оксигемоглобин, поглощает длинноволновые лучи и менее интенсивно — коротковолновые. В связи с этим венозная кровь выглядит темнее и имеет красный цвет с синеватым оттенком. При спектроскопическом исследовании выявляется одна широкая полоса поглощения в желто-зеленой части спектра с максимумом при длине волны 555 нм. Спектрфотометрия. Для количественного анализа абсорбционных свойств окрашенного раствора используют спектрофотометры. В этих приборах видимый свет разлагается в спектр при помощи призмы или дифракционной решетки, а затем свет очень узкой области длин волн (так называемый монохроматический свет) проходит через исследуемый раствор. Поглощение света зависит от длины волны и от свойств раствора. Для определения соотношения между интенсивностью падающего (I0) и прошедшего (I) света используется фотоэлемент. Отношение I/I0 называется пропусканием, а отношение (I0 — I)/I0 — поглощением. Полный спектр поглощения раствора получают путем последовательного измерения этих величин для разных длин волн. ГЛАВА 22. ТРАНСПОРТ ГАЗОВ КРОВИ 607
Спектры поглощения.На рис. 22.4 изображены спектры поглощения оксигемоглобина ндезоксигемоглобина. Тем участкам спектра, в которых при спектроскопии обнаруживаются темные полосы, соответствуют максимумы на кривой поглощения. Для оксигемоглобина характерны два таких максимума, а для гемоглобина — один, занимающий положение между ними. Из рисунка видно, что эти максимумы приходятся на те же длины волн, что и полосы поглощения. Точки пересечения обеих кривых поглощения, или так называемые изобестические точки, соответствуют длинам волн, при которых растворы равной концентрации Hb и НbО2 пропускают свет в одинаковой степени. Если длина волны световых лучей соответствует изобестической точке, то поглощение их гемоглобином не зависит от степени его оксигенации. Монохроматический свет такой длины волны используют в тех случаях, когда необходимо определить концентрацию гемоглобина, не подвергая его химическим модификациям (см. ниже). Если же спектрофотометрию используют для измерения насыщения гемоглобина кислородом, то, напротив, выбирают свет с такой длиной волны, при которой разница между коэффициентами поглощения оксигемоглобина и дезоксигемоглобина максимальна, т.е. 600, 577, 470 нм и т. д. (см. рис. 22.4). Закон Ламберта-Бэра. Вкачестве количественной характеристики поглощения света часто используют также экстинкцию(Е) (на рис. 22.4 отложена по правой оси ординат): О) где I0-интенсивность падающего света, а I- интенсивность прошедшего света. Экстинкцию удобно использовать в связи с тем, что она прямо про- порциональна концентрации растворенного вещества С: (2) где d-толщина слоя раствора, а ε — коэффициент экстинкции (величина, постоянная для каждого вещества). Линейная зависимость между экстинкцией, концентрацией и толщиной слоя раствора называется законом Ламберта-Бэра. Этот закон справедлив только для монохроматического света. Содержание гемоглобина в крови; среднее содержание гемоглобина в эритроците Нормальные показатели.Содержание гемоглобина в крови человека составляет в среднем 158 г/л (15.8 г/дл) у мужчин и 140 г/л (14 г/дл) у женщин. Как и практически любые биологические показатели, эта величина претерпевает определенные колебания даже у здоровых людей. Пределы колебаний определяют путем построения частотного распределениязначений для большого числа людей (рис. 22.5). С возрастом содержание гемоглобина в крови заметно меняется. В крови новорожденного оно составляет 200 г/л. причем возможны значительные индивидуальные колебания (рис. 22.5). В течение первого года жизни содержание гемоглобина снижается примерно до 115 г/л, а затем постепенно возрастает до уровня, характерного для взрослых. Высокое содержание гемоглобина в крови наблюдается не только у плода, но также у лиц, длительное время живущих в условиях высокогорья (с. 714). И в том и в другом случае повышение содержания гемоглобина необходимо для того, чтобы обеспечить нормальное снабжение тканей кислородом при пониженном парциальном давлении этого газа. Уменьшение содержания гемоглобина по сравнению с нормальным уровнем называется анемией.Как правило, диагноз анемия ставят в том случае, если содержание гемоглобина меньше 130 г/л у мужчин и 120 г/л у женщин. Измерение содержания гемоглобина.Для измерения содержания гемоглобина существует много методов, в том числе: 1) определение количества связанного О2(1 г Hb может присоединить до 1,36 мл О2); 2) анализ уровня железа в крови (содержание железа в гемоглобине составляет 0,34%); 3) колориметрия (сравнение цвета крови с цветом стандартного раствора); 4) измерение экстинкции (спектрофотометрия). При проведении рутинных определений уровня гемоглобина отдают предпочтение последнему методу, так как при использова- 6C8 ЧАСТЬ VI. ДЫХАНИЕ нии первых двух способов необходима сложная аппаратура, а метод колориметрии неточен. Спектрофотометрический анализ. Принцип метода состоит в определении содержания Hb в крови по экстинкции монохроматического света. Поскольку растворенный гемоглобин нестабилен, а экстинкция зависит от степени оксигенации, его необходимо предварительно перевести в стабильную форму. Спектрофотометрические измерения содержания гемоглобина производят следующим образом. Кровь набирают в капиллярную пипетку и затем смешивают с раствором, содержащим калий железосинеродистый (K3[Fe(CN)6]), цианистый калий (KCN) и бикарбонат натрия (NaHCO3). Под действием этих веществ эритроциты разрушаются, и гемоглобин превращается в цианметгемоглобинHbCN (содержащий трехвалентное железо), способный сохраняться в течение нескольких недель. При спектрофотометрии раствор цианметгемоглобина освещают монохроматическим светом с длиной волны 546 нм и определяют экстинкцию Е. Зная коэффициент экстинкции ε и толщину слоя раствора d, можно, исходя из закона Ламберта-Бэра [уравнение (2)], определить концентрацию раствора С непосредственно по величине экстинкции Е. Чаще предпочитают, однако, предварительно откалибровать шкалу экстинкции при помощи стандартного раствора. В настоящее время цианметгемоглобиновый метод считается наиболее точным из общепринятых способов измерения содержания гемоглобина [32]. Среднее содержание гемоглобина в эритроците. Важным диагностическим показателем, позволяющим оценить эритропоэз и провести дифференциальную диагностику различных форм анемии, служит среднее содержание гемоглобина в одном эритроците (СГЭ) (по международной классификации-mean corpuscular hemoglobin, MCH). Эта величина отражает абсолютное количество гемоглобина, содержащееся в среднем в одном эритроците. Ее находят путем деления количества гемоглобина в определенном объеме крови на число эритроцитов в том же объеме. Приведем пример расчета СГЭ. У здорового мужчины в 1 л крови содержится 158 г Hb и 5,1 млн ∙ 106 эритроцитов (1 л = 106 мкл). СГЭ равно отношению этих величин: Такая же величина СГЭ характерна и для здоровых женшин: Эритроциты с нормальным содержанием гемоглобина (26-36 пг) называют нормохромнымн. Если СГЭ патологически снижено, то эритроциты называют гипохромными, а если оно повышено — гиперхромными. Эти же термины употребляют и для обозначения различных форм анемии. Так, когда образование гемоглобина снижается в результате недостатка железа, содержание гемоглобина в расчете на эритроцит падает, и возникает гипохромная анемия. При других разновидностях анемии (например, пернициозной анемии) нарушается образование красных кровяных телец в костном мозгу, и в крови появляются деформированные эритроциты с высоким содержанием гемоглобина. В этом случае речь идет о гиперхромной анемии. После значительной кровопотери СГЭ сначала не изменяется (нормохромная анемия), а в последующем вследствие избыточной продукции эритроцитов содержание гемоглобина в них падает (гипохромная анемия). Рекомендуемые страницы: |
Источник