Сродство гемоглобина кислороду что это
Содержание статьи
Гемоглобин: роль в газообмене и процессе дыхания
Одним из самых сложных процессов, что происходят в организме человека, несомненно, является дыхание. И сложность эта не только в танце легких, благодаря которому человек получает кислород, но и в процессах, с помощью которых этот кислород проникает дальше, в ткани, где превращается в углекислый газ, что отправляется в обратное путешествие. О данных процессах и пойдет речь далее.
Итак, приступим. Человек делает вдох, иии… Далеко не весь кислород поступает в легкие, а затем и в кровь. Часть вдыхаемого воздуха остается в так называемом мертвом пространстве. Мертвое пространство, в свою очередь, делится на анатомическое (дыхательные пути), в котором остается около 30 % вдыхаемого воздуха, и функциональное (вентилируемые, но по каким-то причинам не перфузируемые альвеолы).
Ухудшение альвеолярного газообмена может происходить при неглубоком и частом дыхании (причиной может стать перелом ребер, паралич дыхательной мускулатуры различного генеза и др.), а также при увеличении мертвого пространства, вызванном разнообразными причинами (нарушение перфузии альвеол в результате воспалительных заболеваний легких, удаление доли или целого легкого и др.), при снижении скорости кровотока по альвеолярным капиллярам (ТЭЛА, инфаркт легкого), при наличии диффузионного барьера (отек легких) и в результате ослабления альвеолярной вентиляции при обтурации просвета бронха. Газообмен между легкими и кровью происходит путем диффузии в соответствии с законом Фика. В легочных капиллярах она происходит за счет разности парциальных давлений в альвеолах и эритроцитах.
В альвеолах парциальное давление кислорода значительно превышает таковое для углекислого газа и составляет примерно 13,3 кПа (100 мм рт. ст.) и 5,3 кПа (40 мм рт. ст.) соответственно. Альвеолы омываются приносимой легочными артериями венозной кровью, в которой соотношение парциальных давлений этих двух газов обратно пропорционально и составляет приблизительно 5,3 кПа (40 мм рт. ст.) для кислорода и 6,1 кПа (46 мм рт. ст.) для углекислого газа. В среднем разница парциальных давлений составляет около 8 кПа (60 мм рт. ст.) для кислорода и около 0,8 кПа для углекислого газа.
Как уже было сказано выше, кислород путем диффузии проникает в кровь легочных капилляров. Диффузионное расстояние для кислорода при этом составляет 1–2 мкм, то есть именно на такое расстояние он проникает внутрь капилляра. Обмен крови в легочном капилляре происходит примерно за 0,75 секунды, но этого времени хватает на то, чтобы парциальные давления в альвеолах и в крови пришли в равновесие.
Кровь, в которой показатели парциального давления для кислорода и углекислого газа примерно равны таковым в альвеолах, называется артериализированной. Однако за счет наличия в легких артериовенозных шунтов и притока венозной крови из бронхиальных вен такой она остается недолго. В результате парциальное давление кислорода в аорте составляет примерно 12,0 кПа (как уже было сказано выше, парциальное давление в артериализированной крови равно таковому в альвеолах и составляет 13,3 кПа), а давление углекислого газа меняется незначительно и не приводит к затруднению его диффузии из крови в альвеолы.
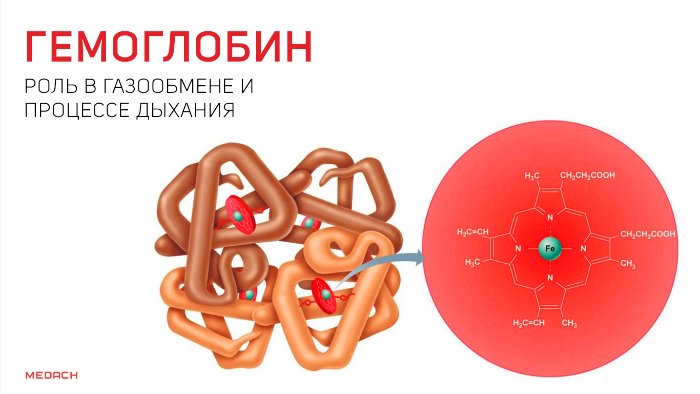
Но кислород непосредственно в ткани попадает лишь в крайне незначительных количествах: для свободного перемещения по организму ему необходим транспортер. Эту функцию выполняет содержащийся в эритроцитах белок — гемоглобин. Гемоглобин существует в оксигенированной и неоксигенированной формах. В дезокси-гемоглобине железо находится на уровне порфиринового кольца и стабилизируется электростатическими силами, что обеспечивает поддержание всей структуры. Появившись, кислород начинает «тянуть» за железо, которое переносится на проксимальный гистидин на другом конце полипептидной цепи и меняет структуру всего протеина.
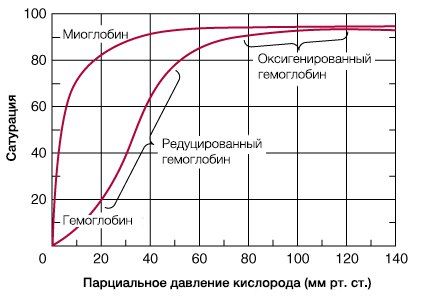
В результате гемоглобин переходит в оксигенированную форму, альфа- и бета-цепи при этом поворачиваются относительно друг друга на 15 градусов, облегчая присоединение остальных молекул кислорода. В итоге каждый из четырех содержащихся в нем атомов двухвалентного железа обратимо связывается с молекулой кислорода, что превращает молекулу гемоглобина в оксигемоглобин. По сравнению с миоглобином гемоглобин имеет низкое сродство к кислороду, однако оно не статично. Так, миоглобин может связывать кислород только одним участком, поэтому кривая его связывания — гипербола. Кривая связывания гемоглобина с кислородом имеет S-образную форму, демонстрируя, что при его связывании с первой молекулой кислорода гемоглобин имеет очень низкое сродство к кислороду, но при связывании последующих молекул кислорода сродство остальных его субъединиц к нему значительно увеличивается и в конечном счете повышается примерно в 500 раз.
При этом альфа-цепи связывают кислород легче, чем бета-цепи. Этот процесс назван кооперативным взаимодействием. По мере снижения парциального давления кислорода в крови происходит его высвобождение из гемоглобина и поступление в ткани. Например, парциальное давление кислорода в работающих мышцах составляет всего 26 мм рт. ст, и при прохождении эритроцитов через капилляры, кровоснабжающие мышцы, происходит высвобождение и поступление в мышечные клетки примерно ⅓ всего переносимого гемоглобином кислорода. При повышении температуры тела также возрастает потребность в кислороде, что, в свою очередь, стимулирует высвобождение и поступление его в ткани. При снижении температуры, напротив, развивается гипоксия тканей, способствующая компенсаторному увеличению сродства гемоглобина к кислороду.
Гемоглобин также осуществляет перенос от тканей к легким продуктов тканевого дыхания — углекислого газа и ионов водорода. В ходе окислительных процессов в клетке выделяется углекислый газ, в результате гидратации которого образуются ионы водорода, что, в свою очередь, приводит к снижению рН. Давно известно, что снижение рН и повышение концентрации углекислого газа в крови оказывает сильное влияние на способность гемоглобина связывать кислород.
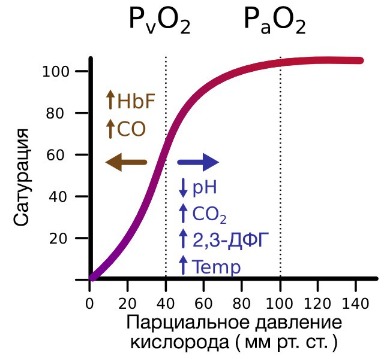
В периферических сосудах показатели рН низкие, и по мере связывания гемоглобина с ионами водорода и углекислым газом происходит снижение его сродства к кислороду. Это влияние величины рН и концентрации углекислого газа на способность гемоглобина связывать кислород называют эффектом Бора.
Обратная ситуация имеет место в альвеолярных капиллярах, где присоединение кислорода к гемоглобину превращает тот в более сильную кислоту.
При этом сродство гемоглобина к углекислому газу снижается, а повышение кислотности гемоглобина приводит к высвобождению излишка ионов водорода и образованию в крови из бикарбоната угольной кислоты, которая затем распадается на воду и углекислый газ. В обоих случаях углекислый газ из крови поступает в альвеолы, а затем в атмосферу. Данный процесс назван эффектом Холдейна. Стоит отметить, что важную роль в образовании углекислого газа в эритроцитах играет ион хлора, поступающий в плазму крови в обмен на бикарбонат при участии белка-переносчика АЕ1. Данный процесс в англоязычной литературе получил название «Chloride shift» или «перенос Хамбургера».
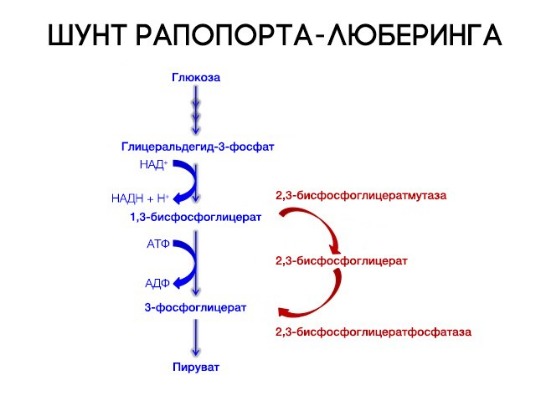
На сродство гемоглобина к кислороду оказывает влияние и присутствующее в эритроцитах вещество, получившее название 2,3-бисфосфоглицерат (БФГ). Его образование — своего рода побочная реакция анаэробного гликолиза, происходящего в эритроцитах в ходе ферментативного превращения глюкозы в пируват под действием фермента бифосфоглицератмутазы. БФГ способен самостоятельно связываться с неоксигенированной формой гемоглобина, образуя солевой мостик между двумя его бета-субъединицами и снижая сродство к кислороду.
При этом гемоглобин способен связать только одну молекулу БФГ, а при присоединении кислорода БФГ вытесняется из полости. В обычных условиях в эритроцитах крови содержится достаточно большое количество БФГ, которое может увеличиваться в условиях гипоксии (например, у дайверов при погружении на глубину), а также при восхождении на большую высоту. В первые часы подъема концентрация БФГ в эритроцитах будет возрастать, а сродство кислороду снижаться. Но на большой высоте парциальное давление будет значительно ниже такового на уровне моря, а значит, оно снизится и в тканях. При этом БФГ будет облегчать передачу кислорода от гемоглобина к тканям.
Некоторые вещества способны прочно связываться с гемоглобином или же вовсе менять его структуру. Одним из них является угарный газ, чье сродство к гемоглобину в 200 раз превышает таковое для кислорода. Отравления угарным газом часто происходят в помещениях с печным отоплением, при пожарах и авариях на производстве. Со временем кислород вытесняет угарный газ из гемоглобина, и в легких случаях пациенты помещаются под наблюдение и получают ингаляции с увлажненным кислородом. Необходимой мерой при тяжелых отравлениях угарным газом является переливание эритроцитарной массы.
К веществам, способным изменять структуру гемоглобина, относятся метгемоглобинобразователи — соединения, способные окислять двухвалентное железо в геме до трехвалентного. К ним относятся нитриты, нитраты, некоторые местные анестетики, аминофенолы, хлораты, примахин и некоторые сульфаниламиды. Состояние, характеризующееся появлением в крови окисленного гемоглобина, называют метгемоглобинемией. При высокой метгемоглобинемии капля крови, помещенная на фильтровальную бумагу, имеет характерный коричневый цвет, а при пропускании кислорода через пробирку с такой кровью ее цвет не меняется. Метгемоглобинемия выше 70 % от общего содержания гемоглобина часто приводит к гибели пациента еще до момента постановки диагноза.
Источники:
- Harrison’s hematology and oncology Longo, Dan L (Dan Louis), Third edition. New York : McGraw-Hill Education Medical, 2017.
- Наглядная физиология, С. Зильбернагль, А. Деспопулос, 2013.
- Ленинджер А. Основы биохимии: В 3-х т. Т. 1. /Д. Нельсон, М. Кокс ; Пер. с англ.-М.: БИНОМ: Лаборатория знаний, 2011.- 694 с.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Источник
Большая Энциклопедия Нефти и Газа
Сродство — гемоглобин
Cтраница 1
Сродство гемоглобина к кислороду ( отражается кривой диссоциации оксигемоглобина) непостоянно. Особенно значительно на него влияют следующие факторы. В эритроцитах содержится особое вещество 2, 3-дифосфоглицерат. Его количество увеличивается, в частности, при снижении напряжения кислорода в крови. Молекула 2, 3-дифос-фоглицерата способна внедряться в центральную часть молекулы гемоглобина, что приводит к снижению сродства гемоглобина к кислороду. Кривая диссоциации смещается вправо. Кислород легче переходит в ткани. Кривая диссоциации оксигемоглобина в этих условиях также смещается вправо. Подобным же образом действует на диссоциацию оксигемоглобина повышение температуры. Нетрудно понять, что эти изменения сродства гемоглобина к кислороду имеют важное значение для обеспечения снабжения им тканей. В тканях, в которых процессы обмена веществ протекают интенсивно, концентрация двуокиси углерода и кислых продуктов увеличивается, а температура повышается. Это ведет к усилению диссоциации оксигемоглобина.
[2]
В регуляции сродства гемоглобина к кислороду могут также участвовать иизкомолскулярные вещества, образующиеся внутри эритроцитов. Молекула 2 3 — ДФГ обладает большим отрицательным зарядом и хорошо подходит к положительно заряженному карману тетрамера НЬ, частично образованному концевой группой NH ( З — иепей и остатками серина, лизина и гистидина.
[3]
По признаку сродства гемоглобина к кислороду ныряющие животные в большинстве случаев существенно не отличаются от неныряющих. Поскольку дыхание у всех этих животных происходит при нормальном давлении, повышение степени сродства не имело бы смысла; при разрядке оксигемоглобина в тканях высокое сродство к кислороду лишь затрудняло бы этот процесс. Не исключено, что высокое сродство гемоглобина к кислороду выполняет у пингвинов особую функцию, ускоряя реоксигенацию крови при коротких появлениях кормящихся птиц на поверхности, а снабжение тканей кислородом облегчается относительно высоким эффектом Бора.
[4]
Регулирующее влияние ДФГ на сродство гемоглобина к кислороду в эритроцитах зависит от величины парциального давления кислорода в легких. После того как здоровый человек поднимется, скажем, на высоту 4000 м над уровнем моря, в течение первых нескольких часов концентрация ДФГ в его эритроцитах будет возрастать; при этом число молекул ДФГ, связанных с гемоглобином, увеличится, а сродство гемоглобина к кислороду снизится. На большой высоте парциальное давление кислорода значительно ниже, чем на уровне моря. Поэтому и в тканях парциальное давление кислорода снижается. Увеличение содержания ДФГ в эритроцитах при восхождении на большую высоту облегчает освобождение кислорода из гемоглобина в тканях. Изменения противоположного характера наблюдаются у людей, акклиматизировавшихся к условиям высокогорья, например у жителей Гималаев или Андов, когда они спускаются в долины.
[6]
Хотя спектр поглощения и сродство гемоглобина к кислороду являются функцией простетической группы, оба эти свойства до определенной степени зависят и от глобина.
[7]
Рассмотренным выше сезонным изменениям сродства гемоглобина к кислороду на эволюционном уровне соответствует генетическая адаптация эктотермных организмов к различным температурным режимам. Гемоглобины эктотермных видов способны присоединять и отдавать кислород именно при тех условиях температуры и содержания Оз в среде, которые типичны для местообитания данного вида. Это обусловлено сильным давлением отбора в пользу таких величин РЫ, которые достаточно низки для того, чтобы кислород мог эффективно связываться у дыхательных поверхностей, но еще достаточно высоки, чтобы он мог легко освобождаться в более глубоких тканях. Так же как и в случае эволюционной адаптации ферментов к температуре, где отбор благоприятствует ферментам с подходящими величинами / См или 50 5, выработка хорошо адаптированных гемоглобинов, по-видимому, требует изменений в первичной структуре их полипептидных цепей. Попутно следует заметить, что гем оказался одним и тем же во всех исследованных гемоглобинах.
[8]
Влияние ДФГ, У человека ДФГ снижает сродство гемоглобина к кислороду в 26 раз. Это очень важно с физиологической точки зрения, поскольку в отсутствие этого механизма гемоглобину было бы трудно освобождать много кислорода в капиллярах тканей. Такое действие ДФГ обусловлено его способ-ностью связываться с дезоксигемоглобином, но не с оксигемо-глобином. Одна молекула ДФГ связывается с гемоглобиновъш тетрамером, располагаясь в центральном пространстве в непосредственной близости ко всем четырем субъединицам.
[10]
Влияние С02, Н и ДФГ на сродство гемоглобина к кислороду и на кооперативность функционирования ассоциированных гемоглобиновых субъединиц описаны в гл.
[11]
Подкисление растворов гемоглобина углекислотой или другими кислотами уменьшает сродство гемоглобина к кислороду. Указанные явления объясняют наличием в глобине ионной группы, находящейся рядом с группой, связывающей железо и влияющей на сродство железа к кислороду.
[12]
Второй важный аспект влияния температуры на перенос газов кровью касается сродства гемоглобина к кислороду. Если мы вспомним, что было сказано ранее о температурной зависимости сродства ферментов к субстратам, об аналогии между ферментами и гемоглобином, то не будем удивлены, узнав, что величины PSQ для большинства изученных гемоглобинов при снижении температуры уменьшаются. Направление этого изменения PSQ противоположно тому, которое мы могли бы оценить как выгодное для организма, так как с повышением температуры одновременно уменьшаются и количество кислорода у дыхательной поверхнисчи, и эффективность связывания его гемоглобином.
[13]
Видовая чувствительность к СО различна и обусловлена как видовыми особенностями сродства гемоглобина к СО, так и неодинаковой скоростью поступления яда в организ м, связанной с интенсивностью обменных процессов, массой тела, частотой сердечных сокращений и частотой дыхания.
[14]
В результате повышается рН плазмы крови в легких, что способствует увеличению сродства гемоглобина к кислороду, в) Бикарбонат повышает рН и увеличивает буферную емкость плазмы крови.
[15]
Страницы:
1
2
3
4
Источник
Кривая диссоциации гемоглобина


Мы поможем в написании ваших работ!

Мы поможем в написании ваших работ!

Мы поможем в написании ваших работ!
ЗНАЕТЕ ЛИ ВЫ?
Сродство гемоглобина к кислороду возрастает по мере последовательного связывания молекул кислорода, что придает кривой диссоциации оксигемоглобина сигмовидную или S-образную форму (рис.). Эта кривая, соотносящая SaO2 с РаО2, важна для анализа процесса кислородного транспорта к периферическим тканям.
Верхняя часть кривой (РаО2 > 60 мм рт.ст.) плоская. Это указывает на то, что SaO2 остается относительно постоянной, несмотря на значительные колебания РаО2. Повышение кислородного транспорта может быть достигнуто только за счет увеличения содержания гемоглобина (например, при переливании крови) или растворения в крови кислорода (например, при кислородной терапии).
Крутые средняя и нижняя части кривой иллюстрируют то положение, что, хотя SaO2 падает (когда РаО2 оказывается ниже 60 мм рт, ст.), насыщение гемоглобина кислородом продолжается, поскольку градиент РО2 между альвеолами и капиллярами сохранияется. Периферические ткани в этих условиях могут продолжать извлекать достаточное количество кислорода, несмотря на снижение капиллярного РО2.
РаО2, при котором гемоглобин насыщен кислородом на 50 % (при 37°С и рН 7,4), известно как Р50. Это общепринятая мера сродства гемоглобина к кислороду. Р50 крови человека в норме составляет 26,6 мм рт.ст. Однако оно может изменяться при различных метаболических и физиологических условиях, воздействующих на процесс связывания кислорода гемоглобином.
Когда сродство гемоглобина к кислороду падает, кислород с большей легкостью переходит в ткани, и наоборот. Повышение Р50 определяет сдвиг кривой диссоциации оксигемоглобина вправо (рис). Сродство гемоглобина к кислороду снижается, указывая, что теперь требуется более высокое РаО2 для поддержания SaO2 на прежнем уровне. Более низкое сродство гемоглобина к кислороду означает повышенное высвобождение кислорода в тканях.
Сдвиг кривой диссоциации влево и соответствующее снижение Р50 указывают на повышенное сродство гемоглобина с кислородом и меньшее его высвобождение в тканях. На Р50 и положение кривой диссоциации гемоглобина влияют несколько факторов:
1. Концентрация ионов водорода. Снижение рН сдвигает кривую вправо, повышение рН – влево. Изучение изменений уровней углекислого газа и ионов водорода в легких и периферических тканях облегчает анализ влияния рН на кривую диссоциации. Образовавшийся в ходе обмена веществ в периферических тканях углекислый газ диффундирует в крови на уровне капилляров. Когда тканевое РСО2 растет, концентрация ионов водорода повышается и рН в тканях падает. Сродство гемоглобина к кислороду при этом уменьшается, что способствует его высвобождению. В легких РСО2 падает и рН увеличивается; сродство гемоглобина к кислороду повышается и связывание кислорода гемоглобином возрастает.
2. Концентрация углекислого газа. Углекислый газ оказывает двоякое действие на кривую диссоциации оксигемоглобина. С одной стороны, содержание углекислого газа влияет на внутриклеточный рН. С другой стороны, накопление СО2 вызывает образование карбаминовых соединений вследствие его взаимодействия с аминогруппами гемоглобина. Эти карбаминовые соединения служат в качестве аллостерических эффекторов молекулы гемоглобина и непосредственно влияют на связывание кислорода. Низкий уровень карбаминовых соединений вызывает сдвиг кривой вправо и снижение сродства гемоглобина к кислороду, что сопровождается увеличением высвобождения кислорода в тканях. По мере роста РаСО2 сопутствующее ему увеличение карбаминовых соединений сдвигает кривую влево, повышая связывание кислорода гемоглобином.
3. Концентрация органических фосфатов. Органические фосфаты, в частности 2,3-дифосфоглицерат (2,3-ДФГ), образуются в эритроцитах в процессе гликолиза. Концентрация органических фосфатов в эритроците в несколько раз выше, чем концентрация АТФ. В эритроците нет митохондрий, в которых происходит окислительное фосфорилирование, поэтому в нем в качестве энергетического субстрата используется 2,3-ДФг. Продукция 2,3-ДФГ увеличивается во время гипоксии, что является важным механизмом адаптации. Ряд условий, вызывающих снижение кислорода в периферических тканях, таких как анемия, острая кровопотеря, хроническое заболевание легких, застойная сердечная недостаточность, пребывание на больших высотах, характеризуются увеличением продукции органических фосфатов в эритроцитах. При этом уменьшается сродство гемоглобина к кислороду и повышается его высвобождение в тканях. И, наоборот, при некоторых патологических состояниях, таких как септический шок и гипофосфатемия, наблюдается низкий уровень 2,3-ДГФ, что приводит к сдвигу кривой диссоциации оксигемоглобина влево.
4. Температура. Температура тела влияет на кривую диссоциации оксигемоглобина менее выражено, чем факторы, описанные выше. Гипертермия вызывает повышение Р50, то есть сдвиг кривой вправо, что является благоприятной приспособительной реакцией на повышенный кислородный запрос клеток при лихорадочных состояниях. Гипотермия, напротив, снижает Р50, то есть сдвигает кривую диссоциации влево.
5. Окись углерода. Этот газа быстро диффундирует через альвеолярно-капиллярную мембрану и связывается с гемоглобином, занимая место кислорода. Сродство гемоглобина к СО в 240 раз превосходит таковое для О2. СО, связываясь с гемоглобином (образуется карбоксигемоглобин), ухудшает оксигенацию периферических тканей посредством двух механизмов: СО непосредственно уменьшает кислородную емкость крови, снижая количество гемоглобина, доступного для связывания кислорода, и СО снижает Р50 и сдвигает кривую диссоциации оксигемоглобина влево. Важным следствием этих механизмов для клиники является то, что при высоких уровнях карбоксигемоглобина может наблюдаться тяжелая тканевая гипоксия, несмотря на нормальное РаО2.
6. Метгемоглобинемия. Окисление части двухвалентного железе гемоглобина до трехвалентного приводит к образованию метгемоглобина. В норме у здоровых людей метгемоглобин составляет менее 3 % общего гемоглобина. Низкий его уровень поддерживается внутриклеточными ферментными механизмами восстановления. Метгемоглобинемия может наблюдаться как следствие врожденной недостаточности этих восстановительных ферментов или образования аномальных молекул гемоглобина, резистентных к ферментативному восстановлению (например, гемоглобин М). Некоторые лекарства, обладающие оксидантными свойствами (например, противомалярийные средства и местные анестетики), также вызывают метгемоглобинемию. Метгемоглобин сдвигает кривую диссоциации оксигемоглобина влево, блокируя высвобождение кислорода в периферических тканях.
7. Прочие гемоглобины. Описано множество генетических вариантов молекул гемоглобина с неизмененным сродством к кислороду. Фетальный гемоглобин (HbF), однако, является примечательным исключением. Гемоглобин F имеет две γ-цепи, а не β-цепи, характерные для HbA. Кривая диссоциации оксигемоглобина для HbF сдвинута влево. Возможно, это происходит из-за того, что 2,3-ДФГ не способен связаться в γ-цепями, что обеспечивает высокое сродство гемоглобина к кислороду. Данное обстоятельство имеет существенное значение для плода, когда РаО2 низкое и плацентарное поглощение кислорода возрастает за счет высокого сродства к О2.
Источник