Строение и состав холестерина
Содержание статьи
ХОЛЕСТЕРИН
ХОЛЕСТЕРИН (греческий chole желчь + stereos твердый; синоним холестерол) — 3-β-гидроксихолест-5-ен, C27H46O, важнейший в биологическом отношении представитель стеринов. Холестерин является источником образования в организме млекопитающих желчных кислот (см.), кортикостероидов (см.), половых гормонов (см.), витамина D3 (см. Кальциферолы.), таким образом, физиологическая функция холестерина чрезвычайно многообразна. Холестерину отводят одну из главных ролей в развитии атеросклероза (см.), в соответствии с современной точкой зрения гиперхолестеринемия (см.) относится к ведущим этиологическим факторам его развития. Однако корреляция между содержанием холестерина в крови и степенью выраженности атеросклероза у человека обнаруживается не всегда. В патологии человека устойчивую гиперхолестеринемию обычно связывают с длительным нарушением холестеринового обмена (см.), в том числе генетически обусловленным. Повышение концентрации холестерина в крови обычно наблюдают при сахарном диабете, гипотиреозе, подагре, ожирении, гипертонической болезни, при некоторых заболеваниях печени, остром нарушении мозгового кровообращения и др. Однако генез гиперхолестеринемии при всех этих патологических состояниях неодинаков. Пониженное содержание холестерина отмечают при ряде инфекционных болезней, острых и хронических заболеваниях кишечника, гипертиреозе, выраженной сердечной недостаточности с застоем крови в печени и др. (см. Гипохолестеринемия).
Холестерин был описан в 1789 году французским химиком Фуркруа (A. F. Fourcroy) как главный составной компонент желчных камней человека. В 1816 году другой французский химик Шеврель (М. E. Chevreul) впервые назвал открытое Фуркруа соединение холестерином. Строение холестерина было окончательно установлено в 30-х годов 20 века, тогда же был осуществлен и его полный химический синтез.
Молекулярный вес (масса) холестерина составляет 386,66; его молекула состоит из четырех циклов, жестко связанных между собой и образующих циклопентанпергидрофенантреновое ядро, и алифатической цени при 17-м углеродном атоме (C17), обладающей небольшой подвижностью. В положении C3 молекулы холестерина имеется гидроксильная группа, а в положении C5-C6 двойная связь. Все шестиуглеродные циклы холестерина находятся в конфигурации кресла и в транс-сочленении, между собой. Общая длина молекулы холестерина 2,2 нм, площадь поверхности около 3,8 нм2.

Из безводных растворителей холестерин кристаллизуется в виде бесцветных игл, а из водного спирта — в виде жемчужных пластинок (моногидрат холестерина);t°пл 149,5-150°, относительная плотность d418 1,052, удельное вращение [a]D -39° (в хлороформе). Холестерин нерастворим в воде (при 20° в 100 мл воды растворяется всего лишь 80-150 мкг холестерина), однако он относительно легко растворяется в ацетоне, спирте, эфире и других органических растворителях. Холестерин хорошо растворим в животных и растительных жирах (маслах), а также в смеси полярных и неполярных органических растворителей.
Из химических свойств холестерина важное биологическое значение имеет его способность образовывать сложные эфиры с кислотами. Большая часть эфиров холестерина в организме человека и других млекопитающих образована высшими жирными кислотами (см.), содержащими в своей цепи 16-20 углеродных атомов. Гидроксильная группа в молекуле холестерина может окисляться в кетогруппу, что происходит, например, при образовании стероидных гормонов (см.). Благодаря подвижности водородного атома при С7 легко образуются окисленные продукты холестерина: 7-гидрокси- и 7-кетохолестерины. Один из них 7-альфа-гидроксихолестерин является важнейшим промежуточным продуктом на пути окисления холестерина в желчные кислоты в печени.
Другим важным химическим свойством холестерина, широко используемым для его аналитического определения, является его способность образовывать интенсивно окрашенные продукты при взаимодействии с сильными кислотами (см. Кислоты и основания) в неводных растворителях: с серной кислотой в уксусном ангидриде или в смеси уксусная кислота — хлороформ (см. Либерманна — Бурхарда реакция), с серной кислотой в хлороформе (реакция Сальковского), с хлористым цинком и хлористым ацетилом в хлороформе (реакция Чучаева), с хлорным железом и серной кислотой в уксусной кислоте (реакция Липшютца). Окрашенные продукты образует как сам холестерин, так и его эфиры, а также и другие стерины, содержащие в 5 -6-м положении двойную связь. Особенностью холестерина является его способность к образованию малорастворимых комплексов с различными кислотами, например, щавелевой, трихлоруксусной, и неорганическими солями — хлористым кальцием, хлористым литием и особенно с полиеновыми антибиотиками (см.) и растительными сапонинами (см.). Комплексообразование холестерина при взаимодействии с полиеновыми антибиотиками лежит в основе действия последних на дрожжи и дрожжеподобные организмы, содержащие в своей оболочке стерины (см.). Образование комплекса с дигитонином используется для раздельного определения свободного (неэтерифицированного) и этерифицированного холестерина: этот комплекс образует только свободный холестерин.
В теле взрослого человека, по данным химического анализа, находится около 140 г холестерина (примерно 0,2% веса тела); по данным радио-изотопных исследований, содержание холестерина значительно выше (200-350 г). В отдельных органах и тканях человека содержатся следующие количества холестерина (в мг на 1 г сырой ткани): кора надпочечников — 100; мозг и нервная ткань — 20; сосудистая стенка — 5; печень, почки, селезенка, костный мозг, кожа — 3; соединительная ткань — 2; скелетная мышца — 1. Неэтерифицированный холестерин преимущественно входит в состав клеточных мембран и в миелиновые оболочки. Ткани мозга, желчь и эритроциты содержат только неэтерифицированный холестерин; в скелетных мышцах содержится 93% неэтерифицированного и 7% этерифицированного холестерина, а надпочечники, напротив, содержат 83% этерифицированного и 17% неэтерифицированного холестерина. В плазме крови человека примерно две трети холестерина этерифицировано.
Каждая клетка в организме млекопитающих содержит холестерин и нуждается в нем для поддержания формы (так называемая функция клеточного «скелета»). Входя в состав клеточных мембран, неэтерифицированный холестерин вместе с фосфолипидами (см. Фосфатиды) обеспечивает избирательную проницаемость клеточной мембраны для веществ, входящих в клетку и выходящих из нее. Вместе с фосфолипидами холестерин регулирует активность мембранно-связанных ферментов путем изменения вязкости мембраны и модификации вторичной структуры ферментов.
Холестерин образует комплексы с некоторыми белками, особенно с теми, молекулы которых содержат большое количество остатков аргинина (см.) и лизина (см.). В присутствии фосфолипидов способность холестерина образовывать комплексы с белками возрастает. С некоторыми фосфолипидами, например, с лецитином (см.), холестерин непосредственно образует комплексы, которые в водной среде дают мицеллярные растворы; при обработке таких растворов ультразвуком получаются липосомы. Характерно, что в животном организме всюду, где встречается холестерин, ему сопутствуют фосфолипиды. Эфиры холестерина находятся внутри клетки и могут рассматриваться как его запасная форма. Их гидролиз по мере надобности осуществляется при участии лизосомной холестеринэстеразы (см.).
Содержание холестерина в плазме крови человека зависит от возраста: наиболее низко оно у новорожденных (65 — 70 мг/ 100 мл), к 1 году жизни концентрация холестерина увеличивается более чем вдвое и достигает примерно 150 мг/100 мл, к 7-8 годам содержание холестерина в плазме крови возрастает всего лишь на 10-15 мг/100 мл, оставаясь постоянным до 13-14 лет, после чего несколько снижается. С 18 — 20 лет наступает постепенное, но неуклонное повышение концентрации холестерина в плазме крови до некоторой постоянной величины, продолжающееся до 50 лет у мужчин и до 60-65 лет у женщин. В высокоразвитых странах Европы и Америки, а также в Австралии средняя концентрация холестерина в плазме крови мужчин 40-60 лет составляет 205-220 мг/100 мл, а. в плазме крови женщин того же возраста 195 — 235 мг/’100 мл.
Содержание холестерина в эритроцитах составляет 120 -140 мг/100 мл и у здоровых людей не зависит от его концентрации в плазме крови.
Установлено, что в плазме крови человека и животных весь холестерин находится в составе липопротеидных комплексов (см. Липопротеиды), с помощью к-рых и осуществляется его транспорт. У взрослого человека примерно 67 — 70% холестерина плазмы крови находится в составе липопротеидов низкой плотности (ЛПНП), 9 — 10% — в составе липопротеидов очень низкой плотности (ЛПОНП) и 20 — 24% — в составе липопротеидов высокой плотности (ЛПВГ1). Сходное распределение характерно и для животных , восприимчивых к развитию атеросклероза, — обезьян, свиней, кроликов, морских свинок, голубей и др. Напротив, у животных, устойчивых к развитию атеросклероза,- собак, кошек, сусликов, норок, песцов, енотов и др., большая часть холестерина плазмы крови находится в ЛПВП, обладающих антиатерогенным действием.
Другие внеклеточные жидкости содержат следующие количества холестерина (мг/100 мл): желчь — 390; плазма спермы — 80; секрет предстательной железы — 80; лимфа — 25; молоко — 20; синовиальная жидкость — 7; слюна — 5; цереброспинальная жидкость — 0,4; моча — 0,2.
Для количественного определения холестерина в плазме (сыворотке) крови используют методы, основанные на приведенных выше цветных реакциях (предложено свыше 400 вариантов таких методов). Наиболее часто используются методы, основанные на реакции Либерманна — Бурхарда и реакции Липшютца. Методы определения холестерина подразделяются на одноступенчатые — без предварительного экстрагирования холестерина из плазмы (сыворотки) крови — и многоступенчатые, включающие экстрагирование холестерина, а в ряде методов омыление (см.) эфиров холестерина, осаждение неэтерифицированного холестерина дигитонином и затем уже проведение цветной реакции. К одноступенчатым методам относится ускоренный метод Ильки (см. Ильки метод), а также метод Мирского — Товарека, основанный на образовании холестерином окрашенного продукта в растворе ледяной уксусной кислоты и уксусного ангидрида при добавлении серной и сульфосалициловой кислот. Одноступенчатые методы просты в исполнении, но дают завышенные результаты. Из многоступенчатых методов в клин, практике широко применяется метод Абелль и сотр. (см. Абелля метод), включающий предварительное экстрагирование холестерина из плазмы (сыворотки) петролейным эфиром, методы Левченко и Зигельгардта — Смирновой, при которых холестерин экстрагирует-с я хлороформом, микрометод Покровского (см. Покровского микрометоды), предусматривающий использование для экстрагирования спиртоэфирной смеси. К этой группе методов относятся также метод Раппопорта — Энгельберга и метод Григо. Одновременное определение общего и свободного холестерина проводится с помощью многоступенчатых методов с использованием дигитонина для осаждения свободного холестерина (см. Балаховского метод). Автоматические методы определения холестерина на приборах Technicon, Abbot и др. тоже основаны на образовании холестерином окрашенных продуктов.
Для определения холестерина применяют также ферментативный метод, основанный на окислении холестерина в присутствии холестериноксидазы (холестеролоксидазы; КФ 1.1.3.6) и определении количества образующейся перекиси водорода, а также газохроматографическое определение (см. Хроматография). Эффективное разделение холестерина и его эфиров достигается с помощью хроматографических методов, в частности хроматографии в тонком слое.
В целом определение холестерина различными методами дает неоднозначные результаты. Арбитражным является метод Абелль и сотр.
В клинике стало принятым рассчитывать величину отношения холестерина атерогенных липопротеидов к холестерину антиатерогенных липопротеидов. Одно из таких отношений — так называемый холестериновый коэффициент атерогенности — рассчитывается на основании определения концентраций общего холестерина и холестерина липопротеидов высокой плотности:
К = (Х — Х*ЛПВП) / Х*ЛПВП
где X — концентрация холестерина, Х*ЛПВП — концентрация холестерина липопротеидов высокой плотности. Это отношение является идеальным у новорожденных (не более 1), у лиц 20-30 лет его величина колеблется от 2 до 2,8, у лиц старше 30 лет без клинических признаков атеросклероза она находится в пределах 3-3,5, а у лиц с ишемической болезнью сердца превышает 4, достигая нередко 5-6 и выше. Этот коэффициент как показатель развития атеросклероза является более чувствительным, чем холестерин-лецитиновый показатель (отношение концентрации холестерина к концентрации лецитина в плазме крови), который одно время широко применялся в клинике.
Библиогр.: Биохимические методы исследования в клинике, под ред. А. А. Покровского, сА 18, М., 1969; Физер Л и Физер М. Стероиды, пер. с англ., М., 1964; Chevreul М. Е. Note sur le sucre de diabetes, Ann. Chim. (Paris), t. 95, p. 319, 1815; My ant N. The biology of cholesterol and steroids, L., 1981
A. H. Климов, Д. В. Иоффе.
Источник
Хороший, плохой, злой холестерин
Статья на конкурс «био/мол/текст»: Вряд ли сейчас найдется человек, который не слышал, что высокий холестерин — это плохо. Однако столь же мала вероятность встретить человека, который знает, ПОЧЕМУ высокий холестерин — это плохо. И чем определяется высокий холестерин. И что такое высокий холестерин. И что такое холестерин вообще, зачем он нужен и откуда берется.
Итак, история вопроса такова. Давным-давно, в одна тысяча девятьсот тринадцатом году, петербуржский физиолог Аничков Николай Александрович показал: не что иное, как холестерин, вызывает атеросклероз у экспериментальных кроликов, содержащихся на пище животного происхождения [1]. Вообще же, холестерин необходим для нормального функционирования животных клеток и является основной составляющей клеточных мембран , а также служит субстратом для синтеза стероидных гормонов и желчных кислот.
Главный липидный компонент пищевого жира и жировых отложений — это триглицериды, которые представляют собой эфиры глицерина и жирных кислот. Холестерин и триглицериды, будучи неполярными липидными веществами, транспортируются в плазме крови в составе липопротеиновых частиц. Частицы эти подразделяют по размеру, плотности, относительному содержанию холестерина, триглицеридов и белков на пять больших классов: хиломикроны, липопротеины очень низкой плотности (ЛПОНП), липопротеины промежуточной плотности (ЛППП), липопротеины низкой плотности (ЛПНП) и липопротеины высокой плотности (ЛПВП) [2]. Традиционно ЛПНП считается «плохим» холестерином, а ЛПВП — «хорошим» (рис. 1).
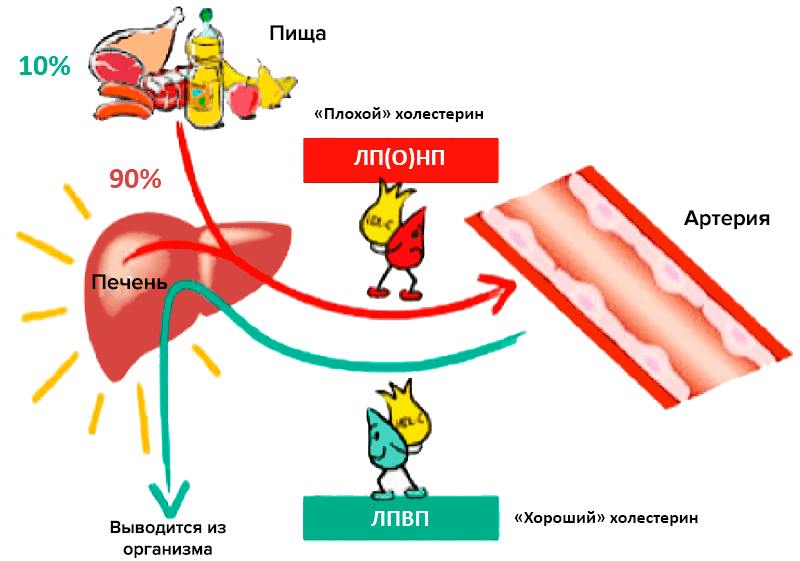
Рисунок 1. «Плохой» и «хороший» холестерины. Участие различных липопротеиновых частиц в транспорте липидов и холестерина.
Схематично структура липопротеина включает неполярное ядро, состоящее по большей части из холестерина и триглицеридов, и оболочку из фосфолипидов и апопротеинов (рис. 2). Ядро — функциональный груз, который доставляется до места назначения. Оболочка же участвует в распознавании клеточными рецепторами липопротеиновых частиц, а также в обмене липидными частями между различными липопротеинами [3].
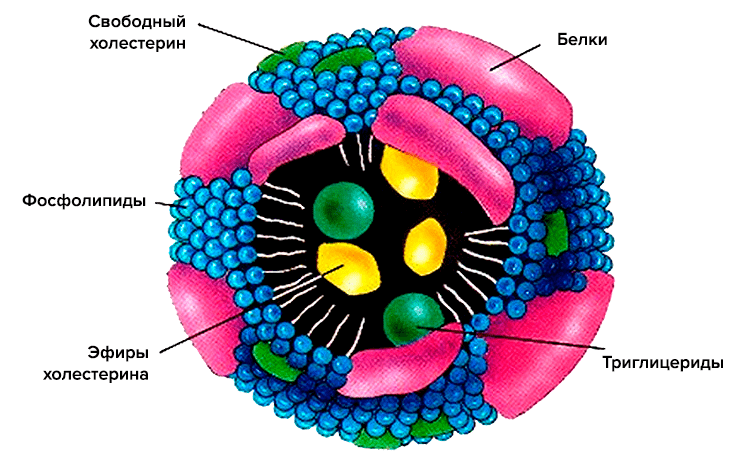
Рисунок 2. Схематическое строение липопротеиновой частицы
Баланс уровня холестерина в организме достигается следующими процессами: внутриклеточный синтез, захват из плазмы (главным образом из ЛПНП), выход из клетки в плазму (главным образом в составе ЛПВП). Предшественник синтеза стероидов — ацетил коэнзим А (CoA). Процесс синтеза включает, по крайней мере, 21 шаг, начиная с последовательного преобразования ацетоацетил CoA. Лимитирующая стадия синтеза холестерина в большой степени определяется количеством холестерина, абсорбируемого в кишечнике и транспортируемого в печень [4]. При недостатке холестерина происходит компенсаторное усиление его захвата и синтеза.
Транспорт холестерина
Систему транспорта липидов можно разделить на две большие части: внешнюю и внутреннюю.
Внешний путь начинается с всасывания в кишечнике холестерина и триглицеридов. Его конечный результат — доставка триглицеридов в жировую ткань и мышцы, а холестерина — в печень. В кишечнике пищевой холестерин и триглицериды связываются с апопротеинами и фосфолипидами, формируя хиломикроны, которые через лимфоток попадают в плазму, мышечную и жировую ткани. Здесь хиломикроны взаимодействуют с липопротеинлипазой — ферментом, который освобождает жирные кислоты. Эти жирные кислоты поступают в жировую и мышечную ткани для накопления и окисления соответственно. После изъятия триглицеридного ядра остаточные хиломикроны содержат большое количество холестерина и апопротеина Е. Апопротеин Е специфически связывается со своим рецептором в клетках печени, после чего остаточный хиломикрон захватывается и катаболизируется в лизосомах. В результате этого процесса освобождается холестерин, который затем преобразуется в желчные кислоты и выводится или участвует в формировании новых липопротеинов, образующихся в печени (ЛПОНП). При нормальных условиях хиломикроны находятся в плазме в течение 1-5 ч. после приема пищи [2], [3].
Внутренний путь. Печень постоянно синтезирует триглицериды, утилизируя свободные жирные кислоты и углеводы. В составе липидного ядра ЛПОНП они выходят в кровь. Внутриклеточный процесс формирования этих частиц схож с таковым для хиломикронов, за исключением различия в апопротеинах. Последующее взаимодействие ЛПОНП с липопротеинлипазой в тканевых капиллярах приводит к формированию остаточных ЛПОНП, богатых холестерином (ЛППП). Примерно половина этих частиц выводится из кровотока клетками печени в течение 2-6 ч. Остальные претерпевают модификацию с замещением оставшихся триглицеридов эфирами холестерина и освобождением от всех апопротеинов, за исключением апопротеина В. В результате формируются ЛПНП, которые содержат ¾ всего плазменного холестерина. Их главная функция — доставка холестерина в клетки надпочечников, скелетных мышц, лимфоцитов, гонад и почек [3]. Модифицированные ЛПНП (окисленные продукты, количество которых возрастает при повышенном содержании в организме активных форм кислорода, так называемом окислительном стрессе) могут распознаваться иммунной системой как нежелательные элементы. Тогда макрофаги их захватывают и выводят из организма в виде ЛПВП. При чрезмерно высоком уровне ЛПНП макрофаги становятся перегруженными липидными частицами и оседают в стенках артерий, образуя атеросклеротические бляшки.
Основные транспортные функции липопротеинов приведены в таблице.
Таблица. Функции липопротеинов [5].
| Класс | Размеры | Функция |
|---|---|---|
| ЛПВП | 4-14 нм | Транспорт холестерина от периферийных тканей к печени |
| ЛПНП | 20-22,5 нм | Транспорт холестерина, триглицеридов и фосфолипидов от печени к периферийным тканям |
| ЛППП | 25-35 нм | Транспорт холестерина, триглицеридов и фосфолипидов от печени к периферийным тканям |
| ЛПОНП | 30-80 нм | Транспорт холестерина, триглицеридов и фосфолипидов от печени к периферийным тканям |
| Хиломикроны | 75-1200 нм | Транспорт холестерина и жирных кислот, поступающих с пищей, из кишечника в периферические ткани и печень |
Регуляция уровня холестерина
Уровень холестерина в крови в большой степени определяется диетой. Пищевые волокна снижают уровень холестерина, а пища животного происхождения повышает его содержание в крови.
Один из основных регуляторов метаболизма холестерина — рецептор LXR (рис. 3). LXR α и β принадлежат к семейству ядерных рецепторов, которые образуют гетеродимеры с ретиноидным Х рецептором и активируют гены-мишени. Их естественные лиганды — оксистерины (окисленные производные холестерина). Обе изоформы идентичны на 80% по аминокислотной последовательности. LXR-α обнаружен в печени, кишечнике, почках, селезенке, жировой ткани; LXR-β в небольшом количестве обнаруживается повсеместно [6]. Метаболический путь оксистеринов быстрее, чем у холестерина, и поэтому их концентрация лучше отражает краткосрочный баланс холестерина в организме. Существует всего три источника оксистеринов: ферментативные реакции, неферментативное окисление холестерина и поступление с пищей. Неферментативные источники оксистеринов как правило минорные, но в патологических состояниях их вклад возрастает (окислительный стресс, атеросклероз), и оксистерины могут действовать наряду с другими продуктами перекисного окисления липидов [6]. Основное влияние LXR на метаболизм холестерина: обратный захват и транспорт в печень, вывод с желчью, снижение кишечного всасывания. Уровень продукции LXR различается на протяжении аорты; в дуге, зоне турбулентности, LXR в 5 раз меньше, чем в участках со стабильным течением. В здоровых артериях повышение экспрессии LXR в зоне сильного потока оказывает антиатерогенное действие [7].
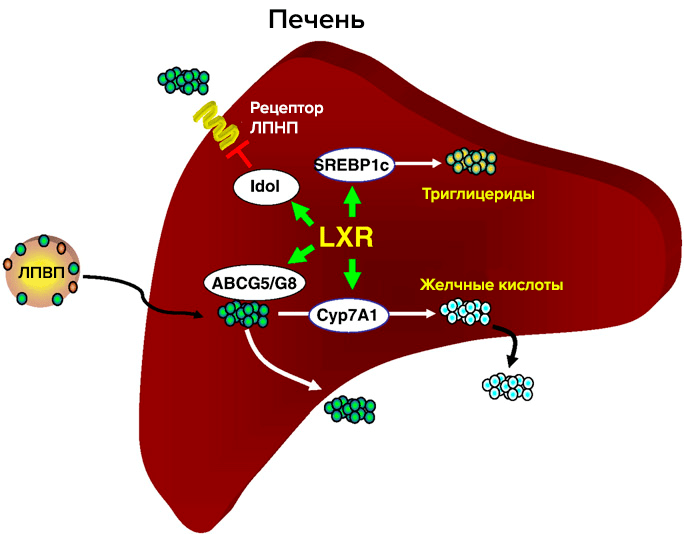
Рисунок 3. Участие рецептора LXR в метаболизме холестерина в печени
Важную роль в метаболизме холестерина и стероидов играет рецептор-«мусорщик» SR-BI (рис. 4). Он был обнаружен в 1996 году как рецептор для ЛПВП [8]. В печени SR-BI отвечает за избирательный захват холестерина из ЛПВП. В надпочечниках SR-BI опосредует избирательный захват этерифицированного холестерина из ЛПВП, который необходим для синтеза глюкокортикоидов. В макрофагах SR-BI связывает холестерин, что является первым этапом в обратном транспорте холестерина. SR-BI также захватывает холестерин из плазмы и опосредует его прямой выход в кишечник [9].
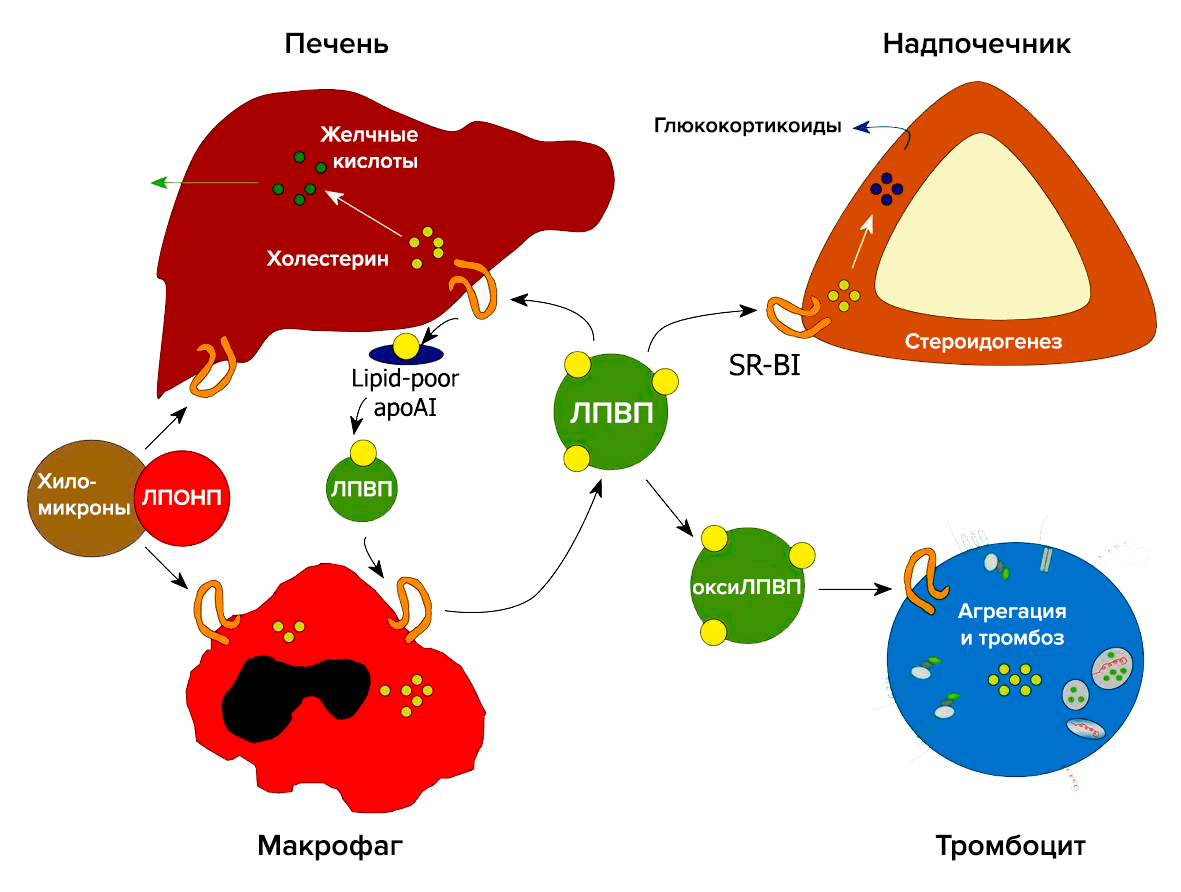
Рисунок 4. Участие рецептора SR-BI в метаболизме холестерина
Выведение холестерина из организма
Классический путь выведения холестерина: транспорт холестерина с периферии в печень (ЛПВП), захват клетками печени (SR-BI), экскреция в желчь и выведение через кишечник, где большая часть холестерина возвращается в кровь [10].
Основная функция ЛПВП — обратный транспорт холестерина в печень. Плазменные ЛПВП являются результатом комплекса различных метаболических событий. Состав ЛПВП очень различается по плотности, физико-химическим свойствам и биологической активности. Это сферические или дисковидные образования. Дисковидные ЛПВП в основном состоят из апопротеина A-I с вложенным слоем фосфолипидов и свободного холестерина. Сферические ЛПВП больше и дополнительно содержат гидрофобное ядро из эфиров холестерина и небольшого количества триглицеридов.
При метаболическом синдроме активируется обмен триглицеридов и эфиров холестерина между ЛПВП и триглицерид-богатыми липопротеинами. В результате содержание триглицеридов в ЛПВП повышается, а холестерина снижается (т.е. холестерин не выводится из организма) [11]. Отсутствие ЛПВП у людей встречается при болезни Tangier, главные клинические проявления которой — увеличенные оранжевые миндалины, роговичная дуга, инфильтрация костного мозга и мукозного слоя кишечника [3].
Если коротко обобщить, то страшен не сам холестерин, который является необходимым компонентом, обеспечивающим нормальную структуру клеточных мембран и транспорт липидов в крови, а кроме того он является сырьем для производства стероидных гормонов. Метаболические расстройства же проявляются при нарушении баланса ЛПНП и ЛПВП , что отражает нарушение системы транспорта липопротеинов, включающей работу печени, образование желчи и участие макрофагов. Поэтому любые заболевания печени, а также аутоиммунные процессы могут вызвать развитие атеросклероза даже при вегетарианской диете. Если мы вернемся к изначальным опытам Н.А. Аничкова по кормлению кроликов пищей, богатой холестерином, то увидим, что холестерин не встречается в естественном рационе кроликов и поэтому, как яд, нарушает работу печени, вызывает сильное воспаление сосудов и, как следствие, образование бляшек.
- Anitschkow N. and Chalatow S. (1983). Classics in arteriosclerosis re: On experimental cholesterin steatosis and its ificance in the origin of some pathological processes by N. Anitschkow and S. Chalatow, translated by Mary Z. Pelias, 1913. Arteriosclerosis, Thrombosis, and Vascular Biology. 3, 178-182;
- Климов А.Н. Причины и условия развития атеросклероза. Превентивная кардиология. М.: «Медицина», 1977. — 260-321 с.;
- Cox R.A. and Garcia-Palmieri M.R. Cholesterol, triglycerides, and associated lipoproteins. Clinical methods: the history, physical, and laboratory examinations (3rd Edition). Boston: Butter-worths, 1990. — 153-160 p.;
- Grundy S.M. (1978). Cholesterol bolism in man. West. J. Med. 128, 13-25;
- Википедия: «Липопротеины»;
- Wójcicka G., Jamroz-Wisniewska A., Horoszewicz K., Beltowski J. (2007). Liver X receptors (LXRs). Part I: Structure, , regulation of activity, and role in lipid bolism. Postepy Hig. Med. Dosw. 61, 736-759;
- Calkin A. and Tontonoz P. (2010). Liver X Receptor aling pathways and atherosclerosis. Arterioscler. Thromb. Vasc. Biol. 30, 1513-1518;
- S. Acton, A. Rigotti, K. T. Landschulz, S. Xu, H. H. Hobbs, M. Krieger. (1996). Identification of Scavenger Receptor SR-BI as a High Density Lipoprotein Receptor. Science. 271, 518-520;
- Vrins C.L.J. (2010). From blood to gut: Direct secretion of cholesterol via transintestinal cholesterol efflux. World J. Gastroenterol. 16, 5953-5957;
- Van der Velde A.E. (2010). Reverse cholesterol transport: From classical view to new insights. World J. Gastroenterol. 16, 5908-5915;
- Wilfried Le Goff, Maryse Guerin, M.John Chapman. (2004). Pharmacological modulation of cholesteryl ester transfer protein, a new therapeutic target in atherogenic dyslipidemia. Pharmacology & Therapeutics. 101, 17-38;
- Липидный фундамент жизни;
- Наночастицами — по «плохому» холестерину!.
Источник