Свойства гемоглобина кооперативное взаимодействие субъединиц
Содержание статьи
Эффективность связывания кислорода с гемоглобином регулируется
Кооперативное взаимодействие
Взаимовлияние протомеров олигомерного белка друг на друга называется кооперативное взаимодействие.
В легких такое взаимодействие субъединиц гемоглобина повышает его сродство к кислороду и ускоряет присоединение кислорода в 300 раз. В тканях идет обратный процесс, сродство снижается и ускорение отдачи кислорода также 300-кратное.
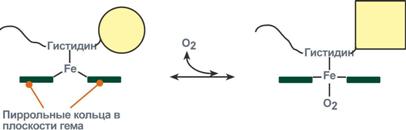
Схема кооперативного взаимодействия субъединиц гемоглобина
Объясняется такой феномен тем, что в легких при присоединении первой молекулы кислорода к железу (за счет 6-й координационной связи) атом железа втягивается в плоскость гема, кислород остается вне плоскости. Это вызывает перемещение участка белковой цепи и изменение конформации первого протомера. Такой измененный протомер влияет на другие субъединицы и облегчает связывание кислорода со второй субъединицей. Это меняет конформацию второй субъединицы, облегчая присоединение последующих молекул кислорода и изменение других протомеров.
Изменение формы субъединиц гемоглобина
при присоединении и отщеплении кислорода
Дезоксиформа гемоглобина обозначается как Т-форма, напряженная (англ. tense), она обладает существенно более низким сродством к кислороду. Оксигенированная форма, или R-форма (англ. relaxed), обладает высоким сродством к кислороду.
Изменение рН среды
Влияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании — повышается.
При повышении концентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина. В легких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н+ из гемоглобина.
Реакция взаимодействия кислорода с гемоглобином упрощенно имеет вид:
Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H+ и О2 обусловлено конформационными перестройками глобиновой части молекулы. В тканях молекула О2 отрывается от железа и ионы водорода присоединяются к остаткам гистидина (глобиновой части), образуя восстановленный гемоглобин (H-Hb) с низким сродством к кислороду. В легких поступающий в больших количествах кислород «вытесняет» ион водорода из связи с остатком гистидина гемоглобиновой молекулы.
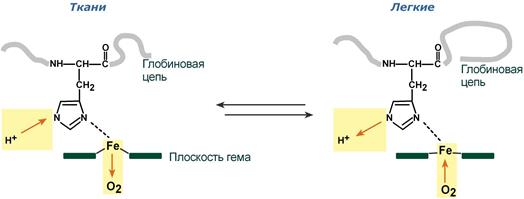
Механизм эффекта Бора
Роль 2,3-дифосфоглицерата
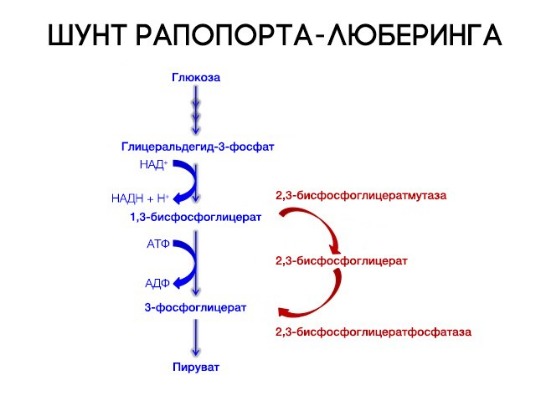
2,3-Дифосфоглицерат образуется в эритроцитах из 1,3-дифосфоглицерата, промежуточного метаболита гликолиза, в реакциях, получивших название шунт Раппопорта.
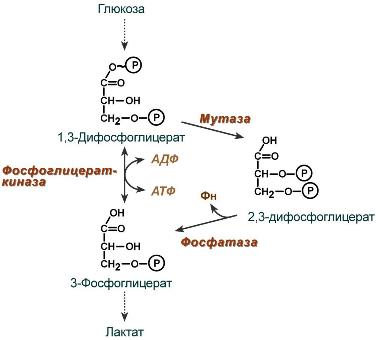
Реакции шунта Раппопорта
2,3-Дифосфоглицерат располагается в центральной полости тетрамера дезоксигемоглобина и связывается с β-цепями, образуя поперечный солевой мостик между атомами кислорода 2,3-дифосфоглицерата и аминогруппами концевого валина обеих β-цепей, также аминогруппами радикалов лизина и гистидина.
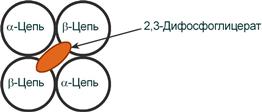
Расположение 2,3-дифосфоглицерата в гемоглобине
Функция 2,3-дифосфоглицерата заключается в снижении сродства гемоглобина к кислороду, что имеет особенное значение при подъеме на высоту и при нехватке кислорода во вдыхаемом воздухе. В этих условиях связывание кислорода с гемоглобином в легких не нарушается, так как концентрация его относительно высока. Однако в тканях за счет 2,3-дифосфоглицерата отдача кислорода возрастает в 2 раза.
Источник
7.Миоглобин и гемоглобин. Конформационные изменения и кооперативные взаимодействия субъединиц гемоглобина. Эффект Бора. Роль 2,3 –бифосфоглицерата.
Два белка — гемоглобин1 и миоглобин — часто называют дыхательными ферментами (рис. 1). Оба этих вещества выполняют роль переносчиков при дыхании: гемоглобин — основной компонент красных кровяных телец2 (эритроцитов), переносящих по артериям кислород из легких к тканям;миоглобин — красный белок в мышцах, принимающий кислород от гемоглобина и хранящий его таме до того момента, когда он потребуется для окисления пищевых веществ. Эти процессы в организме сопряжены с одновременным переносом углекислого газа, переправляемого из тканей в легкие, в основном в виде бикарбоната. Перенос бикарбоната и углекислого газа идет также при содействии гемоглобина.
Миоглобин и гемоглобин представляют собой белки, соединенные с железосодержащим пигментом — гемом3 (рис. 2). Белковая часть миоглобина содержит около 2500 атомов углерода, азота, кислорода, водорода и серы, соединенных друг с другом в длинную цепь, образующую своего рода корзинку вокруг группы гема. Все 2500 атомов молекулы миоглобина подчинены единственному атому железа, расположенному в центре гема, они обеспечивают обратимое взаимодействие железа с молекулами кислорода.
Было установлено, что гем приобретает способность переносить кислород лишь при условии, если его окружает и защищает специфический белок — глобин (сам по себе гем не связывает кислород). Обычно при соединении кислорода с железом один или более электронов необратимо переходят с атомов железа на атомы кислорода. Иными словами, происходит химическая реакция. Экспериментально было доказано, что миоглобин и гемоглобин обладают уникальной способностьюобратимо связывать O2 без окисления гемового Fe2+ в Fe3+. Таким образом, процесс дыхания, который на первый взгляд кажется столь простым, на самом деле осуществляется благодаря взаимодействию многих видов атомов в гигантских молекулах чрезвычайной сложности.
Проблемой молекулярного механизма дыхания, а в связи с этим выяснением строения гемоглобина и миоглобина на протяжении долгого времени занимались английские ученые М.Перутц и Дж.Кендрю. Взаимодействие указанных соединений с субстратом — кислородом — было детально выяснено прежде всего на основе рентгеноструктурного анализа высокого разрешения.
Эффект Вериго-Бора (синонимы — эффект Вериго, эффект Бора) — зависимость степени диссоциации оксигемоглобина от величины парциального давления углекислоты вальвеолярном воздухе и крови, при снижении которого сродство кислорода к гемоглобину повышается, что затрудняет переход кислорода из капилляров в ткани. Эффект этот был открыт независимо друг от друга Б. Ф. Вериго в 1898 году и датским физиологом Ч. Бором в 1904.
Важная особенность анаэробного гликолиза в эритроцитах по сравнению с другими клетками — присутствие в них фермента бисфосфоглицератмутазы. Бисфосфоглицератмутаза катализирует образование 2,3-бисфосфоглицерата из 1,3-бисфосфоглицерата (рис. 14-3). Образующийся только в эритроцитах 2,3-бисфосфоглицерат служит важным аллостерическим регулятором связывания кислорода гемоглобином
8. Ферменты, особенности ферментативного катализа (механизм выполнения ферментом каталитической функции, энергетический барьер реакции, энергия активации, образование фермент-субстратного комплекса). Единицы активности ферментов
Ферме́нты, или энзи́мы — обычно белковые молекулы или молекулы РНК (рибозимы) или их комплексы, ускоряющие (катализирующие) химические реакции в живых системах. Реагенты в реакции, катализируемой ферментами, называются субстратами, а получающиеся вещества — продуктами. Ферменты специфичны к субстратам (АТФаза катализирует расщепление только АТФ, а киназа фосфорилазы фосфорилирует только фосфорилазу).
Ферментативный катализ (биокатализ), ускорение биохимических реакций при участии белковых макромолекул. называемых ферментами (энзимами). Ферментативный катализ — разновидность катализа, хотя термин «ферментация» (брожение)известен с давних времен, когда еще не было понятия химического катализа.
Единицы активности ферментов.1) За единицу активности фермента (Uunit, англ.) принимают такое количество фермента, которое катализирует превращение 1 мкмоля S (суб страта) за 1 мин. при оптимальных условиях (1U= 1 мкмоль/мин.)
2) В системе СИ активность выражают в каталах: 1 катал — количество фермента, катали зирующее превращение 1 моля S за 1 сек. при оптимальных условиях (1кат.=1 моль/с)
3)Удельнаяактивность определяется количеством единиц ферментативной активности, которое приходится на 1 мг белка в биологическом объекте (U/мг белка)
Соседние файлы в папке экз
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Гемоглобин
Гемоглобин (от др.-греч. Гемо — кровь и лат. globus — шар) — это сложная белковая молекула внутри красных клеток крови — эритроцитов (у человека и позвоночных животных). Гемоглобин составляет примерно 98% массы всех белков эритроцита.
Гемоглобин (от др.-греч. Гемо — кровь и лат. globus — шар) — это сложная белковая молекула внутри красных клеток крови — эритроцитов (у человека и позвоночных животных). Гемоглобин составляет примерно 98% массы всех белков эритроцита. За счет своей структуры гемоглобин участвует в переносе кислорода от легких к тканям, и оксида углерода обратно.
Строение гемоглобина
Гемоглобин состоит из двух цепей глобина типа альфа и двух цепей другого типа (бета, гамма или сигма), соединенными с четырьмя молекулами гемма, содержащего железо. Структура гемоглобина записывается буквами греческого алфавита: α2γ2.
Обмен гемоглобина
Гемоглобин образуется эритроцитами в красном костном мозге и циркулирует с клетками в течение всей их жизни — 120 дней. Когда селезенкой удаляются старые клетки, компоненты гемоглобина удаляются из организма или поступают обратно в кровоток, чтобы включиться в новые клетки.
Типы гемоглобина
К нормальным типам гемоглобина относится гемоглобин А или HbA (от adult — взрослый), имеющий структуру α2β2, HbA2 (минорный гемоглобин взрослого, имеющий структуру α2σ2 и фетальный гемоглобин (HbF, α2γ2. Гемоглобин F — гемоглобин плода. Замена на гемоглобин взрослого полностью происходит к 4-6 месяцам (уровень фетального гемоглобина в этом возрасте менее 1%). Эмбриональный гемоглобин образовывается через 2 недели после оплодотворения, в дальнейшем, после образования печени у плода, замещается фетальным гемоглобином.
| Тип гемоглобина | Процент содержания у взрослого человека |
| HbA — взрослый гемоглобин | 98% |
| HbA2 — взрослый гемоглобин минорный | Около 2% |
| HbFi — фетальный гемоглобин | 0,5-1% |
| Эмбриональный гемоглобин | нет |
| HbA1C — гликированный гемоглобин |
Аномальных гемоглобинов более 300, их называют по месту открытия.
Функция гемоглобина
Основная функция гемоглобина — доставка кислорода от легких к тканям и углекислого газа обратно.
Формы гемоглобина
- Оксигемоглобин — соединение гемоглобина с кислородом. Оксигемоглобин преобладает в артериальной крови, идущей от легких к тканям. Из-за содержания оксигемоглобина артериальная кровь имеет алый цвет.
- Восстановленный гемоглобин или дезоксигемоглобин (HbH) — гемоглобин, отдавший кислород тканям
- Карбоксигемоглобин — соединение гемоглобина с углекислым газом. Находится в венозной крови и придает ей темный вишневый цвет.
Как же это происходит? Почему в легких гемоглобин забирает, а в тканях отдает кислород?
Эффект Бора
Эффект был описан датским физиологом Христианом Бором https://en.wikipedia.org/wiki/Christian_Bohr (отцом знаменитого физика Нильса Бора).
Христиан Бор заявил, что при большей кислотности (более низкое значение рН, например, в тканях) гемоглобин будет меньше связываться с кислородом, что позволит его отдать.
В легких, в условиях избытка кислорода, он соединяется с гемоглобином эритроцитов. Эритроциты с током крови доставляют кислород ко всем органам и тканям. В тканях организма с участием поступающего кислорода проходят реакции окисления. В результате этих реакций образуются продукты распада, в том числе, углекислый газ. Углекислый газ из тканей переносится в эритроциты, из-за чего уменьшается сродство к кислороду, кислород выделяется в ткани.
Эффект Бора имеет громадное значение для функционирования организма. Ведь если клетки интенсивно работают, выделяют больше СО2, эритроциты могут снабдить их большим количеством кислорода, не допуская кислородного «голодания». Следовательно, эти клетки могут и дальше работать в высоком темпе.
Какой уровень гемоглобина в норме?
В каждом миллилитре крови содержится около 150 мг гемоглобина! Уровень гемоглобина меняется с возрастом и зависит от пола. Так, у новорожденных гемоглобин значительно выше, чем у взрослых, а у мужчин выше, чем у женщин.
Что еще влияет на уровень гемоглобина?
Некоторые другие состояния также влияют на уровень гемоглобина, например, пребывание на высоте, курение, беременность.
Заболевания, связанные с изменением количества или структуры гемоглобина
- Повышение уровня гемоглобина наблюдается при эритроцитозах, обезвоживании.
- Снижение уровня гемоглобина наблюдается при различных анемиях.
- При отравлении угарным газом образуется карбгемоглобин (не путайте с карбоксигемоглобином!), который не может присоединять кислород.
- Под действием некоторых веществ образуется метгемоглобин.
- Изменение структуры гемоглобина называется гемоглобинопатией. Самые известные и частые заболевания этой группы — серповидно-клеточная анемия, бета-талассемия, персистенция фетального гемоглобина. См.гемоглобинопатии на сайте Всемирной организации здравоохранения https://www.who.int/centre/factsheets/fs308/ru/index.html
Знаете ли Вы?
- У беспозвоночных животных гемоглобин растворен в плазме крови.
- В сутки из легких в ткани переносится около 600 литров кислорода!
- Красный цвет крови придает гемоглобин, входящий в состав эритроцитов. У некоторых червей вместо гемоглобина хлорокруорин и кровь зеленая. А у каракатиц, скорпионов и пауков голубая, так как вместо гемоглобина — содержащий медь гемоцианин.
Другие статьи раздела
Распространенный возбудитель инфекций дыхательных путей (фарингиты, синуситы, отиты, бронхиты и пневмонии). Анализы на антитела используются для диагностики инфекции Chlamydophila pneumoniae при длительных инфекциях дыхательных путей.
Mycoplasma pneumoniae — возбудитель пневмонии человека, острых респираторных заболеваний (ОРЗ), заболеваний верхних дыхательных путей (фарингита, бронхита), а также некоторых нереспираторных заболеваний.
Азооспермия (azoospermia) — отсутствие сперматозоидов в эякуляте
Бактерии — одноклеточные микроорганизмы, некоторые из которых могут вызывать заболевания.
Mycoplasma pneumoniae (микоплазма пневмонии), Chlamydohpila pneumoniae (хламидофила пневмонии, прежнее название Chlamydia pneumoniae)
Гипофиз — непарная железа внутренней секреции, расположенная на основании головного мозга в костном кармане — гипофизарной ямке турецкого седла. Гипофиз вырабатывает гормоны, оказывающие влияние на работу всего организма — рост и развитие, обмен веществ, половую функцию.
Повышенный рост волос (гирсутизм) может быть следствием не только повышенного уровня андрогенов (см. «гиперандрогения»), но и высокой активности 5-альфа-редуказы в коже (фермента волосяных фолликулов, превращающего тестостерон в гораздо более активный дигидротестостерон.
По данным ВОЗ (Всемирная организация здравоохранения) заболеваемость в России составляет более 50 человек на 100 000 населения. Имеет важное значение то, что у женщин значительно чаще чем у мужчин (50-90% против 10%) возможно бессимптомное течение заболевания.
Делеция (ген.) — вид хромосомных мутаций, при котором происходит потеря какого-либо участка хромосомы.
Механизм обратной связи — система, которая используется организмом для контроля некоторых функций и поддержания состояния постоянства организма. Механизм обратной связи использует один из продуктов пути обмена веществ, обычно конечный продукт, для контроля активности пути обмена веществ и регуляции количества этого продукта. Обратная связь может быть отрицательной и положительной.
Источник
Гемоглобин: роль в газообмене и процессе дыхания
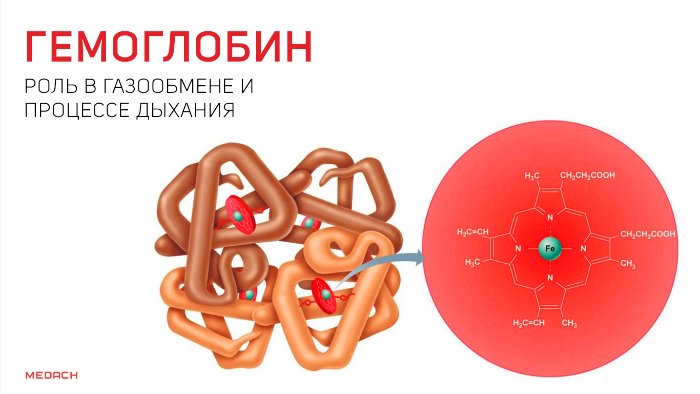
Одним из самых сложных процессов, что происходят в организме человека, несомненно, является дыхание. И сложность эта не только в танце легких, благодаря которому человек получает кислород, но и в процессах, с помощью которых этот кислород проникает дальше, в ткани, где превращается в углекислый газ, что отправляется в обратное путешествие. О данных процессах и пойдет речь далее.
Итак, приступим. Человек делает вдох, иии… Далеко не весь кислород поступает в легкие, а затем и в кровь. Часть вдыхаемого воздуха остается в так называемом мертвом пространстве. Мертвое пространство, в свою очередь, делится на анатомическое (дыхательные пути), в котором остается около 30 % вдыхаемого воздуха, и функциональное (вентилируемые, но по каким-то причинам не перфузируемые альвеолы).
Ухудшение альвеолярного газообмена может происходить при неглубоком и частом дыхании (причиной может стать перелом ребер, паралич дыхательной мускулатуры различного генеза и др.), а также при увеличении мертвого пространства, вызванном разнообразными причинами (нарушение перфузии альвеол в результате воспалительных заболеваний легких, удаление доли или целого легкого и др.), при снижении скорости кровотока по альвеолярным капиллярам (ТЭЛА, инфаркт легкого), при наличии диффузионного барьера (отек легких) и в результате ослабления альвеолярной вентиляции при обтурации просвета бронха. Газообмен между легкими и кровью происходит путем диффузии в соответствии с законом Фика. В легочных капиллярах она происходит за счет разности парциальных давлений в альвеолах и эритроцитах.
В альвеолах парциальное давление кислорода значительно превышает таковое для углекислого газа и составляет примерно 13,3 кПа (100 мм рт. ст.) и 5,3 кПа (40 мм рт. ст.) соответственно. Альвеолы омываются приносимой легочными артериями венозной кровью, в которой соотношение парциальных давлений этих двух газов обратно пропорционально и составляет приблизительно 5,3 кПа (40 мм рт. ст.) для кислорода и 6,1 кПа (46 мм рт. ст.) для углекислого газа. В среднем разница парциальных давлений составляет около 8 кПа (60 мм рт. ст.) для кислорода и около 0,8 кПа для углекислого газа.
Как уже было сказано выше, кислород путем диффузии проникает в кровь легочных капилляров. Диффузионное расстояние для кислорода при этом составляет 1-2 мкм, то есть именно на такое расстояние он проникает внутрь капилляра. Обмен крови в легочном капилляре происходит примерно за 0,75 секунды, но этого времени хватает на то, чтобы парциальные давления в альвеолах и в крови пришли в равновесие.
Кровь, в которой показатели парциального давления для кислорода и углекислого газа примерно равны таковым в альвеолах, называется артериализированной. Однако за счет наличия в легких артериовенозных шунтов и притока венозной крови из бронхиальных вен такой она остается недолго. В результате парциальное давление кислорода в аорте составляет примерно 12,0 кПа (как уже было сказано выше, парциальное давление в артериализированной крови равно таковому в альвеолах и составляет 13,3 кПа), а давление углекислого газа меняется незначительно и не приводит к затруднению его диффузии из крови в альвеолы.
Но кислород непосредственно в ткани попадает лишь в крайне незначительных количествах: для свободного перемещения по организму ему необходим транспортер. Эту функцию выполняет содержащийся в эритроцитах белок — гемоглобин. Гемоглобин существует в оксигенированной и неоксигенированной формах. В дезокси-гемоглобине железо находится на уровне порфиринового кольца и стабилизируется электростатическими силами, что обеспечивает поддержание всей структуры. Появившись, кислород начинает «тянуть» за железо, которое переносится на проксимальный гистидин на другом конце полипептидной цепи и меняет структуру всего протеина.
В результате гемоглобин переходит в оксигенированную форму, альфа- и бета-цепи при этом поворачиваются относительно друг друга на 15 градусов, облегчая присоединение остальных молекул кислорода. В итоге каждый из четырех содержащихся в нем атомов двухвалентного железа обратимо связывается с молекулой кислорода, что превращает молекулу гемоглобина в оксигемоглобин. По сравнению с миоглобином гемоглобин имеет низкое сродство к кислороду, однако оно не статично. Так, миоглобин может связывать кислород только одним участком, поэтому кривая его связывания — гипербола. Кривая связывания гемоглобина с кислородом имеет S-образную форму, демонстрируя, что при его связывании с первой молекулой кислорода гемоглобин имеет очень низкое сродство к кислороду, но при связывании последующих молекул кислорода сродство остальных его субъединиц к нему значительно увеличивается и в конечном счете повышается примерно в 500 раз.
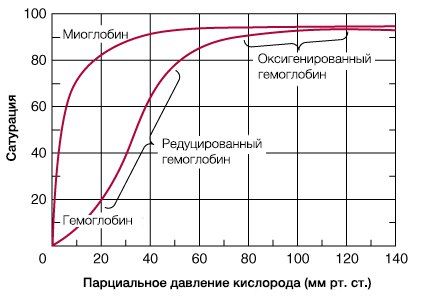
При этом альфа-цепи связывают кислород легче, чем бета-цепи. Этот процесс назван кооперативным взаимодействием. По мере снижения парциального давления кислорода в крови происходит его высвобождение из гемоглобина и поступление в ткани. Например, парциальное давление кислорода в работающих мышцах составляет всего 26 мм рт. ст, и при прохождении эритроцитов через капилляры, кровоснабжающие мышцы, происходит высвобождение и поступление в мышечные клетки примерно ⅓ всего переносимого гемоглобином кислорода. При повышении температуры тела также возрастает потребность в кислороде, что, в свою очередь, стимулирует высвобождение и поступление его в ткани. При снижении температуры, напротив, развивается гипоксия тканей, способствующая компенсаторному увеличению сродства гемоглобина к кислороду.
Гемоглобин также осуществляет перенос от тканей к легким продуктов тканевого дыхания — углекислого газа и ионов водорода. В ходе окислительных процессов в клетке выделяется углекислый газ, в результате гидратации которого образуются ионы водорода, что, в свою очередь, приводит к снижению рН. Давно известно, что снижение рН и повышение концентрации углекислого газа в крови оказывает сильное влияние на способность гемоглобина связывать кислород.
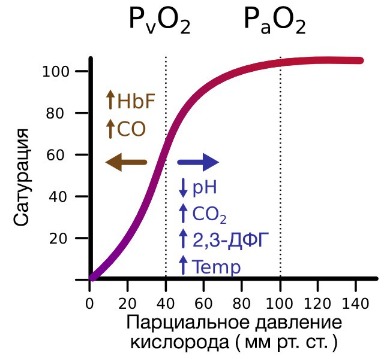
В периферических сосудах показатели рН низкие, и по мере связывания гемоглобина с ионами водорода и углекислым газом происходит снижение его сродства к кислороду. Это влияние величины рН и концентрации углекислого газа на способность гемоглобина связывать кислород называют эффектом Бора.
Обратная ситуация имеет место в альвеолярных капиллярах, где присоединение кислорода к гемоглобину превращает тот в более сильную кислоту.
При этом сродство гемоглобина к углекислому газу снижается, а повышение кислотности гемоглобина приводит к высвобождению излишка ионов водорода и образованию в крови из бикарбоната угольной кислоты, которая затем распадается на воду и углекислый газ. В обоих случаях углекислый газ из крови поступает в альвеолы, а затем в атмосферу. Данный процесс назван эффектом Холдейна. Стоит отметить, что важную роль в образовании углекислого газа в эритроцитах играет ион хлора, поступающий в плазму крови в обмен на бикарбонат при участии белка-переносчика АЕ1. Данный процесс в англоязычной литературе получил название «Chloride shift» или «перенос Хамбургера».
На сродство гемоглобина к кислороду оказывает влияние и присутствующее в эритроцитах вещество, получившее название 2,3-бисфосфоглицерат (БФГ). Его образование — своего рода побочная реакция анаэробного гликолиза, происходящего в эритроцитах в ходе ферментативного превращения глюкозы в пируват под действием фермента бифосфоглицератмутазы. БФГ способен самостоятельно связываться с неоксигенированной формой гемоглобина, образуя солевой мостик между двумя его бета-субъединицами и снижая сродство к кислороду.
При этом гемоглобин способен связать только одну молекулу БФГ, а при присоединении кислорода БФГ вытесняется из полости. В обычных условиях в эритроцитах крови содержится достаточно большое количество БФГ, которое может увеличиваться в условиях гипоксии (например, у дайверов при погружении на глубину), а также при восхождении на большую высоту. В первые часы подъема концентрация БФГ в эритроцитах будет возрастать, а сродство кислороду снижаться. Но на большой высоте парциальное давление будет значительно ниже такового на уровне моря, а значит, оно снизится и в тканях. При этом БФГ будет облегчать передачу кислорода от гемоглобина к тканям.
Некоторые вещества способны прочно связываться с гемоглобином или же вовсе менять его структуру. Одним из них является угарный газ, чье сродство к гемоглобину в 200 раз превышает таковое для кислорода. Отравления угарным газом часто происходят в помещениях с печным отоплением, при пожарах и авариях на производстве. Со временем кислород вытесняет угарный газ из гемоглобина, и в легких случаях пациенты помещаются под наблюдение и получают ингаляции с увлажненным кислородом. Необходимой мерой при тяжелых отравлениях угарным газом является переливание эритроцитарной массы.
К веществам, способным изменять структуру гемоглобина, относятся метгемоглобинобразователи — соединения, способные окислять двухвалентное железо в геме до трехвалентного. К ним относятся нитриты, нитраты, некоторые местные анестетики, аминофенолы, хлораты, примахин и некоторые сульфаниламиды. Состояние, характеризующееся появлением в крови окисленного гемоглобина, называют метгемоглобинемией. При высокой метгемоглобинемии капля крови, помещенная на фильтровальную бумагу, имеет характерный коричневый цвет, а при пропускании кислорода через пробирку с такой кровью ее цвет не меняется. Метгемоглобинемия выше 70 % от общего содержания гемоглобина часто приводит к гибели пациента еще до момента постановки диагноза.
Источники:
- Harrison’s hematology and oncology Longo, Dan L (Dan Louis), Third edition. New York : McGraw-Hill Education Medical, 2017.
- Наглядная физиология, С. Зильбернагль, А. Деспопулос, 2013.
- Ленинджер А. Основы биохимии: В 3-х т. Т. 1. /Д. Нельсон, М. Кокс ; Пер. с англ.-М.: БИНОМ: Лаборатория знаний, 2011.- 694 с.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Источник