T r формы гемоглобина
Содержание статьи
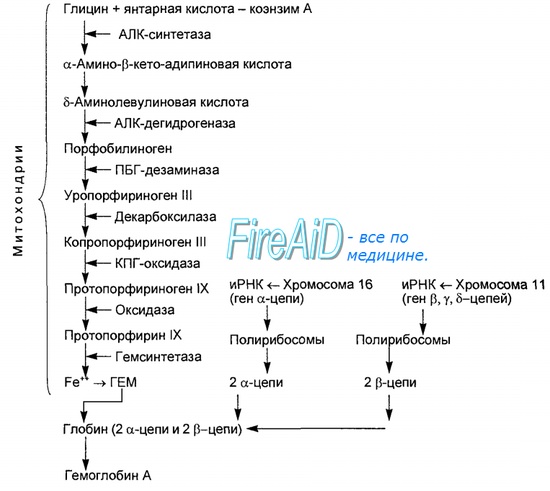
åìîãëîáèí
274-275
Òêàíè è îðãàíû. Êðîâü
Ãåìîãëîáèí
 Ãëàâíàÿ ôóíêöèÿ ýðèòðîöèòîâ
Ãëàâíàÿ ôóíêöèÿ ýðèòðîöèòîâ
(ñì. ñ. 268)
òðàíñïîðò êèñëîðîäà îò ëåãêèõ â òêàíè è ÑÎ2 îò òêàíåé
îáðàòíî â ëåãêèå. Âûñøèå îðãàíèçìû íóæäàþòñÿ äëÿ ýòîãî â ñïåöèàëüíîé
òðàíñïîðòíîé ñèñòåìå, òàê êàê ìîëåêóëÿðíûé êèñëîðîä ïëîõî ðàñòâîðèì â âîäå:
â 1 ë ïëàçìû êðîâè ðàñòâîðèìî òîëüêî îêîëî 3,2 ìë Î2.
Ñîäåðæàùèéñÿ â ýðèòðîöèòàõ áåëîê ãåìîãëîáèí (Hb) ñïîñîáåí ñâÿçàòü
â 70 ðàç áîëüøå 220 ìë Î2/ë. Ñîäåðæàíèå Hb â êðîâè ñîñòàâëÿåò
140-180 ã/ë ó ìóæ÷èí è 120-160 ã/ë ó æåíùèí, ò. å. âäâîå âûøå ïî ñðàâíåíèþ ñ
áåëêàìè ïëàçìû (50-80 ã/ë). Ïîýòîìó Hb âíîñèò íàèáîëüøèé âêëàä â îáðàçîâàíèå
ðÍ-áóôåðíîé åìêîñòè êðîâè (ñì. ñ. 280).
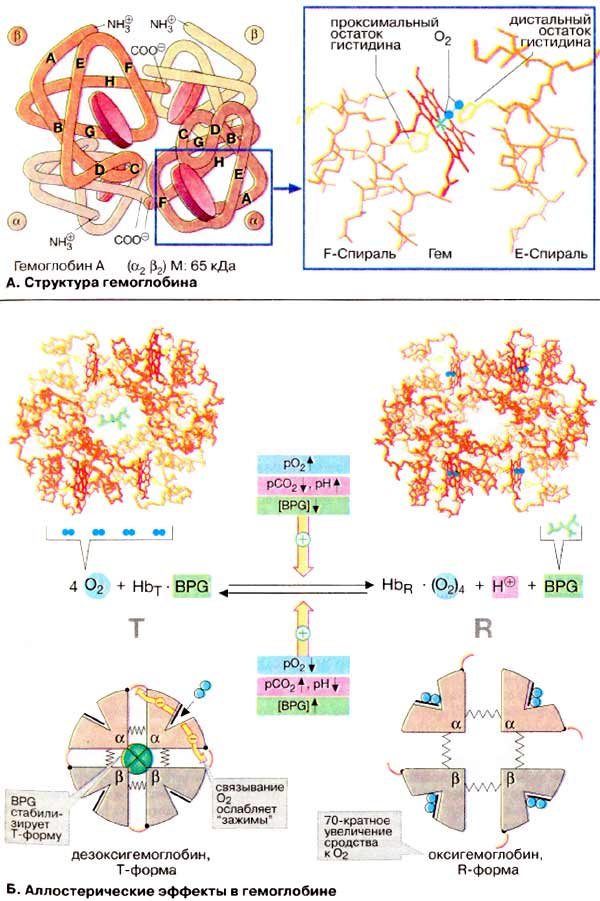
À. Ñòðóêòóðà
ãåìîãëîáèíà
Ãåìîãëîáèí âçðîñëîãî îðãàíèçìà
(HbA, ñì. íèæå) ÿâëÿåòñÿ òåòðàìåðîì, ñîñòîÿùèì èç äâóõ α- è äâóõ
β-ñóáüåäèíèö ñ ìîëåêóëÿðíûìè ìàññàìè ïðèìåðíî 16 êÄà. α- è β-öåïè îòëè÷àþòñÿ
àìèíîêèñëîòíîé ïîñëåäîâàòåëüíîñòüþ, íî èìåþò ñõîäíóþ êîíôîðìàöèþ. Ïðèìåðíî 80%
àìèíîêèñëîòíûõ îñòàòêîâ ãëîáèíà îáðàçóþò α-ñïèðàëè, îáîçíà÷åííûå áóêâàìè
À-Í (ñì. ñõåìó). Êàæäàÿ ñóáúåäèíèöà íåñåò ãðóïïó ãåìà (ôîðìóëó ñì. íà ðèñ.
197) ñ èîíîì äâóõâàëåíòíîãî æåëåçà â öåíòðå. Ïðè ñâÿçûâàíèè
O2ñ àòîìîì æåëåçà â ãåìå (îêñèãåíàöèÿ Hb) è îòùåïëåíèè
O2 (äåçîêñèãåíàöèÿ) ñòåïåíü îêèñëåíèÿ àòîìà æåëåçà íå
ìåíÿåòñÿ. Îêèñëåíèå Fe2+ äî Fe3+ â ãåìå íîñèò ñëó÷àéíûé
õàðàêòåð. Îêèñëåííàÿ ôîðìà ãåìîãëîáèíà, ìåòãåìîãëîáèí, íå ñïîñîáíà
ïåðåíîñèòü O2. Äîëÿ ìåòãåìîãëîáèíà ïîääåðæèâàåòñÿ ôåðìåíòàìè íà
íèçêîì óðîâíå è ñîñòàâëÿåò ïîýòîìó îáû÷íî òîëüêî 1-2%.
×åòûðå èç øåñòè êîîðäèíàöèîííûõ ñâÿçåé
àòîìà æåëåçà â ãåìîãëîáèíå çàíÿòû àòîìàìè àçîòà ïèððîëüíûõ êîëåö, ïÿòàÿ
îñòàòêîì ãèñòèäèíà ãëîáèíà (ïðîêñèìàëüíûé îñòàòîê ãèñòèäèíà), à øåñòàÿ
ìîëåêóëîé êèñëîðîäà â îêñèãåìîãëîáèíå è, ñîîòâåòñòâåííî, Í2Î â
äåçîêñèãåìîãëîáèíå.
Á. Àëëîñòåðè÷åñêèå ýôôåêòû â
ãåìîãëîáèíå
Àíàëîãè÷íî àñïàðòàò-êàðáàìîèëòðàíñôåðàçå
(ñì. ñ. 118) Hb ìîæåò íàõîäèòüñÿ â äâóõ ñîñòîÿíèÿõ (êîíôîðìàöèÿõ):
îáîçíà÷àåìûõ êàê Ò- è R-ôîðìû ñîîòâåòñòâåííî. Ò-Ôîðìà (íàïðÿæåííàÿ îò
àíãë. tense) îáëàäàåò ñóùåñòâåííî áîëåå íèçêèì ñðîäñòâîì ê O2
ïî ñðàâíåíèþ ñ R-ôîðìîé (íà ñõåìå ñïðàâà). Ñâÿçûâàíèå O2 ñ îäíîé èç
ñóáúåäèíèö Ò-ôîðìû ïðèâîäèò ê ëîêàëüíûì êîíôîðìàöèîííûì èçìåíåíèÿì, êîòîðûå
îñëàáëÿþò ñâÿçü ìåæäó ñóáúåäèíèöàìè. Ñ âîçðàñòàíèåì ïàðöèàëüíîãî äàâëåíèÿ
O2 óâåëè÷èâàåòñÿ äîëÿ ìîëåêóë Hb â âûñîêîàôôèííîé R-ôîðìå (îò àíãë.
relaxed). Áëàãîäàðÿ êîîïåðàòèâíûì âçàèìîäåéñòâèÿì ìåæäó ñóáúåäèíèöàìè ñ
ðîñòîì êîíöåíòðàöèè êèñëîðîäà ïîâûøàåòñÿ ñðîäñòâî Hb ê O2, â
ðåçóëüòàòå ÷åãî êðèâàÿ íàñûùåíèÿ èìååò ñèãìîèäàëüíûé âèä (ñì. ñ
276).
Íà ðàâíîâåñèå ìåæäó Ò- è R-ôîðìàìè
âëèÿþò ðàçëè÷íûå àëëîñòåðè÷åñêèå ýôôåêòîðû, ðåãóëèðóþùèå ñâÿçûâàíèå
O2 ãåìîãëîáèíîì (æåëòûå ñòðåëêè). Ê íàèáîëåå âàæíûì ýôôåêòîðàì
îòíîñÿòñÿ CO2, Í+ è 2,3-äèôîñôîãëèöåðàò [ÄÔÃ (BPG)]
(ñì. ñ. 276).
Äîïîëíèòåëüíàÿ
èíôîðìàöèÿ
Hb âçðîñëîãî îðãàíèçìà ñîñòîèò, êàê
óïîìÿíóòî âûøå, èç äâóõ α- è äâóõ β-öåïåé (α2β2). Íàðÿäó ñ
ýòîé îñíîâíîé ôîðìîé (HbA1) â êðîâè ïðèñóòñòâóþò
íåçíà÷èòåëüíûå êîëè÷åñòâà âòîðîé ôîðìû ñ áîëåå âûñîêèì ñðîäñòâîì ê
O2, ó âòîðîé β-öåïè çàìåíåíû δ-öåïÿ-ìè (HbA2,
α2δ2). Äâå äðóãèå ôîðìû Hb âñòðå÷àþòñÿ òîëüêî â
ýìáðèîíàëüíîì ïåðèîäå ðàçâèòèÿ. Â ïåðâûå òðè ìåñÿöà îáðàçóþòñÿ ýìáðèîíàëüíûå
ãåìîãëîáèíû ñîñòàâà ξ2ε2 è α2γ2.
Çàòåì âïëîòü äî ðîæäåíèÿ äîìèíèðóåò ôåòàëüíûé ãåìîãëîáèí (HbF,
α2δ2), êîòîðûé ïîñòåïåííî çàìåíÿåòñÿ íà ïåðâîì ìåñÿöå
æèçíè íà HbÀ. Ýìáðèîíàëüíûé è ôåòàëüíûé ãåìîãëîáèíû îáëàäàþò áîëåå âûñîêèì
ñðîäñòâîì ê Î2 ïî ñðàâíåíèþ ñ HbÀ, òàê êàê îíè äîëæíû ïåðåíîñèòü
êèñëîðîä èç ñèñòåìû ìàòåðèíñêîãî êðîâîîáðàùåíèÿ.
Источник
Строение и функции гемоглобина. T- и R-формы гемоглобина.
16. Гемоглобин — основной белок крови
Гемоглобин входит в состав группы белков гемопротеины, которые сами являются подвидом хромопротеинов и
подразделяются на неферментативныебелки (гемоглобин, миоглобин) и ферменты(цитохромы, каталаза,
пероксидаза). Небелковой частью их является гем – структура, включающая в себя порфириновое кольцо
(состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями.
Строение гемоглобина
Гемоглобин представляет собой белок, включающий 4 гемсодержащие белковые субъединицы. Между собой протомеры соединяются гидрофобными, ионными, водородными связями по принципу комплементарности.
При этом они взаимодействуют не произвольно, а определенным участком — контактной поверхностью. Этот процесс высокоспецифичен, контакт происходит одновременно в десятках точек по принципу комплементарности. Взаимодействие осуществляют разноименно заряженные группы, гидрофобные участки, неровности на поверхности белка. Белковые субъединицы в нормальном гемоглобине могут быть представлены различными типами полипептидных цепей: α, β, γ, δ, ε, ξ (соответственно, греч. — альфа, бета, гамма, дельта, эпсилон, кси). В состав молекулы гемоглобина входят по двецепи двухразных типов. Гем соединяется с белковой субъединицей, во-первых, через остаток гистидинакоординационной связью железа, во-вторых, через гидрофобныесвязи пиррольных колец и гидрофобных аминокислот. Гем располагается как бы «в кармане» своей цепи и формируется гемсодержащий протомер.
Нормальные формы гемоглобина
Существует несколько нормальных вариантов гемоглобина:
HbР– примитивный гемоглобин, содержит 2ξ- и 2ε-цепи, встречается в эмбрионе между 7-12 неделями жизни,
HbF– фетальный гемоглобин, содержит 2α- и 2γ-цепи, появляется через 12 недель внутриутробного развития и является основным
после 3 месяцев,
HbA– гемоглобин взрослых, доля составляет 98%, содержит 2α- и 2β-цепи, у плода появляется через 3 месяца жизни и к рождению
составляет 80% всего гемоглобина,
HbA2– гемоглобин взрослых, доля составляет 2%, содержит 2α- и 2δ-цепи,
HbO2– оксигемоглобин, образуется при связывании кислорода в легких, в легочных венах его 94-98% от всего количества гемоглобина,
HbCO2– карбогемоглобин, образуется при связывании углекислого газа в тканях, в венозной крови составляет 15-20% от всего
количества гемоглобина.
Патологические формы гемоглобина
HbS– гемоглобин серповидно-клеточной анемии.
MetHb– метгемоглобин, форма гемоглобина, включающая трехвалентный ион железа вместо двухвалентного. Такая форма обычно образуется
спонтанно, в этом случае ферментативных мощностей клетки хватает на его восстановление. При использовании сульфаниламидов,
употреблении нитрита натрия и нитратов пищевых продуктов, при недостаточности аскорбиновой кислоты ускоряется переход Fe2+ в Fe3+.
Образующийся metHb не способен связывать кислород и возникает гипоксия тканей. Для восстановления ионов железа в клинике используют
аскорбиновую кислоту и метиленовую синь.
Hb-CO– карбоксигемоглобин, образуется при наличии СО (угарный газ) во вдыхаемом воздухе. Он постоянно присутствует в крови в малых концентрациях, но его доля может колебаться от условий и образа жизни.
Угарный газ является активным ингибитором гем-содержащих ферментов, в частности, цитохромоксидазы4-го комплекса дыхательной цепи.
HbA1С– гликозилированный гемоглобин. Концентрация его нарастает при хронической гипергликемии и является хорошим скрининговым показателем уровня глюкозы крови за длительный период времени.
17. Аллостерические эффекты гемоглобина: кооперативный эффект, эффект Бора, эффект 2,3-дифосфоглицерата. Механизмы, физиологическое значение.
Эффективность транспорта кислорода
регулируется
Изменение рН среды
Влияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при
защелачивании – повышается.
При повышенииконцентрации протонов (закисление среды) в тканяхвозрастает освобождение кислорода из оксигемоглобина. В легкихпосле
удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н+ из
гемоглобина.
Реакция взаимодействия кислорода с гемоглобином упрощенно имеет вид:
Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H+ и О2обусловлено конформационными
перестройками глобиновой части молекулы. В тканяхионы водорода присоединяются к остаткам гистидина, образуя восстановленный
гемоглобин (H-Hb) с низким сродством к кислороду. В легкихпоступающий кислород «вытесняет» ион водорода из связи с остатком гистидина
гемоглобиновой молекулы.
Кооперативное взаимодействие
Взаимовлияние протомеров олигомерного белка друг на друга называется кооперативное взаимодействие.
В легкихтакое взаимодействие субъединиц гемоглобина повышает его сродство к кислороду и ускоряет присоединение кислорода в 300 раз.
В тканяхидет обратный процесс, сродство снижается и ускорение отдачи кислорода также 300-кратное.
Схема кооперативного взаимодействия субъединиц гемоглобина
Объясняется такой феномен тем, что в легких при присоединении первой молекулы кислорода к железу (за счет 6-й координационной связи) атом
железа втягивается в плоскость гема, кислород остается вне плоскости. Это вызывает перемещение участка белковой цепи и изменение
конформации первого протомера. Такой измененный протомер влияет на другие субъединицы и облегчает связывание кислорода со второй
субъединицей. Это меняет конформацию второй субъединицы, облегчая присоединение последующих молекул кислорода и изменение других
протомеров.
Роль 2,3-дифосфоглицерата
2,3-Дифосфоглицерат образуется в эритроцитах из 1,3-дифосфоглицерата, промежуточного метаболитагликолиза, в реакциях, получивших
название шунт Раппопорта.
2,3-Дифосфоглицерат располагается в центральной полоститетрамера дезоксигемоглобина и связывается с ?-цепями, образуя поперечный
солевой мостик между атомами кислорода 2,3-дифосфоглицератаи аминогруппами концевого валинаобеих ?-цепей, также аминогруппами
радикалов лизинаи гистидина.
Функция 2,3-дифосфоглицерата заключается в снижении сродствагемоглобина к кислороду. Это имеет особенное значение при подъеме на
высоту, при нехватке кислорода во вдыхаемом воздухе. В этих условиях связывание кислорода с гемоглобином в легких не нарушается, так как
концентрация его относительно высока. Однако в тканях за счет 2,3-дифосфоглицерата отдача кислорода возрастает в 2 раза.
Обмен кислорода и углекислого газа в тканях
В тканях диффундирующий в кровь из клеток СО2 большей частью (около 90%) по градиенту концентрации попадает в эритроциты. Движущей
силой этого процесса является быстрая, постоянно идущая реакция превращения его в угольную кислоту при участии
фермента карбоангидразы. Угольная кислота диссоциирует и подкисляет содержимое эритроцита, что улучшает отдачу оксигемоглобином
кислорода (Эффект Бора).
Одновременно с концевыми NH2-группами β-цепей гемоглобина связывается 10-12% карбонат-иона с образованием карбаминогемоглобина(HHbCO2).
Остальные бикарбонаты выходят в плазму крови в обмен на ионы хлора (гипохлоремический сдвиг).
Обмен кислорода и углекислого газа в легких
В легочных капиллярах имеется относительно низкая концентрация углекислого газав альвеолярном воздухе:
происходит высокоэффективная диффузия СО2 из плазмы через альвеолярные мембраны и его удаление с выдыхаемым воздухом,
уменьшение концентрации СО2 в плазме стимулирует его образование в карбоангидразнойреакции внутри эритроцита и снижает
здесь концентрацию иона HCO3
–,
одновременно высокая концентрация кислорода вытесняет СО2 из комплекса с гемоглобином с образованием оксигемоглобина –
более сильной кислоты, чем угольная,
диссоциирующие от оксигемоглобина ионы Н+ нейтрализуют поступающий извне ион HCO3
– с образованием угольной кислоты. После
карбоангидразной реакции образуется СО2, который выводится наружу.
Поиск по сайту:
Источник
емоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина.
Оглавление темы «Функции клеток крови. Эритроциты. Нейтрофилы. Базофилы.»: Гемоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина.Гемоглобин — это гемопротеин, с молекулярной массой около 60 тыс., окрашивающий эритроцит в красный цвет после связывания молекулы O2 с ионом железа (Fe++). У мужчин в 1 л крови содержится 157 (140—175) г гемоглобина, у женщин — 138 (123—153) г. Молекула гемоглобина состоит из четырех субъединиц гема, связанных с белковой частью молекулы — глобином, сформированной из полипептидных цепей.
Синтез гема протекает в митохондриях эритробластов. Синтез цепей глобина осуществляется на полирибосомах и контролируется генами 11-й и 16-й хромосом. Схема синтеза гемоглобина у человека представлена на рис. 7.2. Гемоглобин, содержащий две а- и две В-цепи, называется А-тип (от adult — взрослый). 1 г гемоглобина А-типа связывает 1,34 мл O2. В первые три месяца жизни плода человека в крови содержатся эмбриональные гемоглобины типа Gower I (4 эпсилон цепи) и Gower II (2а и 25 цепи). Затем формируется гемоглобин F (от faetus — плод). Его глобин представлен двумя цепями а и двумя В. Гемоглобин F обладает на 20—30 % большим сродством к O2, чем гемоглобин А, что способствует лучшему снабжению плода кислородом. При рождении ребенка до 50—80 % гемоглобина у него представлены гемоглобином F и 15—40 % — типом А, а к 3 годам уровень гемоглобина F снижается до 2 %. Соединение гемоглобина с молекулой 02 называется оксигемоглобином. Сродство гемоглобина к кислороду и диссоциация оксигемоглобина (отсоединения молекул кислорода от оксигемоглобина) зависят от напряжения кислорода (Р02), углекислого газа (РС02) в крови, рН крови, ее температуры и концентрации 2,3-ДФГ в эритроцитах. Так, сродство повышают увеличение Р02 или снижение РС02 в крови, нарушение образования 2,3-ДФГ в эритроцитах. Напротив, повышение концентрации 2,3-ДФГ, снижение Р02 крови, сдвиг рН в кислую сторону, повышение РС02 и температуры крови — уменьшают сродство гемоглобина к кислороду, тем самым облегчая ее отдачу тканям. 2,3-ДФГ связывается с р-цепями гемоглобина, облегчая отсоединение 02 от молекулы гемоглобина. Увеличение концентрации 2,3-ДФГ наблюдается у людей, тренированных к длительной физической работе, адаптированных к длительному пребыванию в горах. Оксигемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином. В состоянии физиологического покоя у человека гемоглобин в артериальной крови на 97 % насыщен кислородом, в венозной — на 70 %. Чем выраженней потребление кислорода тканями, тем ниже насыщение венозной крови кислородом. Например, при интенсивной физической работе потребление кислорода мышечной тканью увеличивается в несколько десятков раз и насыщение кислородом оттекающей от мышц венозной крови снижается до 15 %. Содержание гемоглобина в отдельном эритроците составляет 27,5—33,2 пикограмма. Снижение этой величины свидетельствует о гипохромном (т. е. пониженном), увеличение — о гиперхромном (т. е. повышенном) содержании гемоглобина в эритроцитах. Этот показатель имеет диагностическое значение. Например, гиперхромия эритроцитов характерна для В|2-дефицитной анемии, гипохромия — для железодефицитной анемии. — Также рекомендуем «Старение эритроцитов. Разрушение эритроцитов. Длительность жизни эритроцита. Эхиноцит. Эхиноциты.» |
Источник
обин — Доказательная медицина для всех
Гемоглобин (Hb) — сложный белок, обеспечивающий транспорт кислорода из легких к тканям. Гемоглобин состоит из белковых цепей и гема — порфиринового кольца, которое содержит железо.
Физиологически, основной функцией гемоглобина является перенос кислорода из легких к органам и тканям, но не меньшей важностью является перенос гемоглобином оксида азота (NO) и регуляция тонуса сосудов (вазомоторного тонуса).
Низкий уровень гемоглобина является одним из проявлений анемии, повышенный уровень гемоглобина также является признаком ряда заболеваний и патологических состояний.
Гемоглобин. Цифры и факты
- Одна молекула гемоглобина переносит четыре молекулы кислорода
- Во всем гемоглобине в организме содержит 2,5 грамма железа у мужчин и 1,9 грамма у женщин
- Паразит, вызывающий малярию, малярийный плазмодий, питается гемоглобином. Подробнее о малярии
ЭТО ИНТЕРЕСНО: физиологический процесс распада гемоглобина в организме называется гемоглобинолизом
Виды гемоглобинов
В организме здорового взрослого человека присутствует несколько типов гемоглобина:
- Гемоглобин А (HbA)
- Гемоглобин A2 (HbA2)
- Фетальный гемоглобин (HbF)
- Гликированный гемоглобин (HbA1C)
Гликированный гемоглобин имеет важнейшее значение в диагностике и лечении сахарного диабета
Нормы гемоглобина
Казалось бы, все знают, что норма гемоглобина для женщин составляет 120-140 г/л (грамм на литр), а для мужчин 140-160 г/л. Но как и с нормальными показателями уровня сывороточного железа, с нормами гемоглобина не все так просто.
ЭТО ИНТЕРЕСНО: Методы определения концентрации гемоглобин в крови называются гемоглобинометрией
Сначала интересные факты о том, откуда взялись вышеуказанные нормы. Эти нормы разработаны ВОЗ, но разработаны они не для оценки нормального уровня гемоглобина как такового, а для оценки питания. Т.е. проще говоря, эти уровни гемоглобина соответствующие указанному диапазону, с точки зрения экспертов ВОЗ, говорят о том, что человек, в общем то, неплохо питается, не более того.
Ассоциация гематологов США предлагает рассматривать нижнюю границу нормы гемоглобина, на следующем уровне:
Популяция* | Нижняя граница нормы гемоглобина |
Мужчины в возрасте от 20 до 59 лет | 137 г/л |
Мужчины в возрасте старше 60 лет | 132 г/л |
Женщины 20 лет и старше | 122 г/л |
* Нормы гемоглобин для представителей европеоидной расы
Как следует из приведенной таблицы, на уровень гемоглобина влияют пол и возраст, другие факторы, влияющие на уровень гемоглобина:
- Проживание на большой высоте
- Занятия спортом
- Курение
- Раса
- Сопутствующие заболевания
У курящих, живущих на большой высоте, спортсменов — уровень гемоглобина будет выше, т.е. то, что для других норма, для других будет уже анемией. Как и наоборот, то, что для людей живущих примерно на уровне моря будет повышенным уровнем гемоглобина, для курящих, спортсменов и живущих на большой высоте будет нормой.
Норма гемоглобина у беременных женщин*
Первый триместр | Второй триместр | Третий триместр | |
Гемоглобин (г/л) | 116-139 | 97-148 | 9.5-150 |
Гематокрит (в процентах) | 31.0-41.0 | 30.0-39.0 | 28.0-40.0 |
*Данные показатели получены в результате клинических исследований, но не являются нормативными. Подробнее о некоторых лабораторных нормах у беременных женщин.
Итак, после того, как мы рассказали о сложностях в оценке того, какой уровень является нормальным для гемоглобина, а какой нет, мы расскажем на какие нормативные показатели обычно ориентируются врачи.
Показатель | Мужчины | Женщины |
Гемоглобин г/л | 157 ± 17 | 138 ± 15 |
Гематокрит % | 46.0 ± 4.0 | 40.0 ± 4.0 |
Эритроцитов в мкл | 5.2 ± 0.7 | 4.6 ± 0.5 |
Ретикулоциты % | 1.6 ± 0.5 | 1.4 ± 0.5 |
Средний объем эритроцита, fL | 88.0 ± 8.0 | |
Среднее содержание гемоглобина в эритроците | 30.4 ± 2.8 | |
Средняя концентрация гемоглобина в эритроците | 34.4 ± 1.1 | |
Ширина распределения эритроцитов | 13.1 ± 1.4 | |
Напомним, что нормальные показатели гемоглобина у взрослых отличаются от показателей у детей.
Гемоглобин у детей
Возраст | Гемоглобин, г/л | Гематокрит, % | Средний эритроцитарный объем, мкм3 |
Новорожденные | 165 ± 30 | 51 ± 9 | 108 ± 10 |
1 мес | 140 ± 40 | 43 ± 12 | 104 ± 19 |
6 мес | 115 ± 20 | 35 ± 6 | 91 ± 17 |
1 год | 120 ± 15 | 36 ± 3 | 78 ± 8 |
2—6 лет | 125 ± 10 | 37 ± 3 | 81 ± 6 |
6—12 лет | 135 ± 20 | 40 ± 5 | 86 ± 9 |
12—18 лет | 140 ± 20 | 42 ± 6 | 89 ± 11 |
Подготовка к анализу на гемоглобин
Подготовка к анализу на гемоглобин обычно не требуется. Перед анализом необходимо пить достаточное количество жидкости, чтобы не допустить обезвоживания. Анализ на гемоглобин может быть сдан отдельно, но чаще всего, исследование гемоглобина проводится в рамках проведения общего анализа крови. В некоторых случаях общий анализ крови может потребовать подготовки в виде 12 часового голодания.
Симптомы пониженного гемоглобина
Пониженный гемоглобин приводит к недостаточному обеспечению органов и тканей кислородом. ОБычно симптомы низкого гемоглобина включают:
- слабость
- одышку
- головокружение
- учащенное сердцебиение
- шум в ушах
- головную боль
- похолодание конечностей
- побледнение или желтизну кожи
- боль в груди
Подробно симптомы связанные с пониженным гемоглобином обсуждаются в статье об анемиях.
Источник