Участие гемоглобина в транспорте кислорода
Гемоглобин: роль в газообмене и процессе дыхания
Одним из самых сложных процессов, что происходят в организме человека, несомненно, является дыхание. И сложность эта не только в танце легких, благодаря которому человек получает кислород, но и в процессах, с помощью которых этот кислород проникает дальше, в ткани, где превращается в углекислый газ, что отправляется в обратное путешествие. О данных процессах и пойдет речь далее.
Итак, приступим. Человек делает вдох, иии… Далеко не весь кислород поступает в легкие, а затем и в кровь. Часть вдыхаемого воздуха остается в так называемом мертвом пространстве. Мертвое пространство, в свою очередь, делится на анатомическое (дыхательные пути), в котором остается около 30 % вдыхаемого воздуха, и функциональное (вентилируемые, но по каким-то причинам не перфузируемые альвеолы).
Ухудшение альвеолярного газообмена может происходить при неглубоком и частом дыхании (причиной может стать перелом ребер, паралич дыхательной мускулатуры различного генеза и др.), а также при увеличении мертвого пространства, вызванном разнообразными причинами (нарушение перфузии альвеол в результате воспалительных заболеваний легких, удаление доли или целого легкого и др.), при снижении скорости кровотока по альвеолярным капиллярам (ТЭЛА, инфаркт легкого), при наличии диффузионного барьера (отек легких) и в результате ослабления альвеолярной вентиляции при обтурации просвета бронха. Газообмен между легкими и кровью происходит путем диффузии в соответствии с законом Фика. В легочных капиллярах она происходит за счет разности парциальных давлений в альвеолах и эритроцитах.
В альвеолах парциальное давление кислорода значительно превышает таковое для углекислого газа и составляет примерно 13,3 кПа (100 мм рт. ст.) и 5,3 кПа (40 мм рт. ст.) соответственно. Альвеолы омываются приносимой легочными артериями венозной кровью, в которой соотношение парциальных давлений этих двух газов обратно пропорционально и составляет приблизительно 5,3 кПа (40 мм рт. ст.) для кислорода и 6,1 кПа (46 мм рт. ст.) для углекислого газа. В среднем разница парциальных давлений составляет около 8 кПа (60 мм рт. ст.) для кислорода и около 0,8 кПа для углекислого газа.
Как уже было сказано выше, кислород путем диффузии проникает в кровь легочных капилляров. Диффузионное расстояние для кислорода при этом составляет 1-2 мкм, то есть именно на такое расстояние он проникает внутрь капилляра. Обмен крови в легочном капилляре происходит примерно за 0,75 секунды, но этого времени хватает на то, чтобы парциальные давления в альвеолах и в крови пришли в равновесие.
Кровь, в которой показатели парциального давления для кислорода и углекислого газа примерно равны таковым в альвеолах, называется артериализированной. Однако за счет наличия в легких артериовенозных шунтов и притока венозной крови из бронхиальных вен такой она остается недолго. В результате парциальное давление кислорода в аорте составляет примерно 12,0 кПа (как уже было сказано выше, парциальное давление в артериализированной крови равно таковому в альвеолах и составляет 13,3 кПа), а давление углекислого газа меняется незначительно и не приводит к затруднению его диффузии из крови в альвеолы.
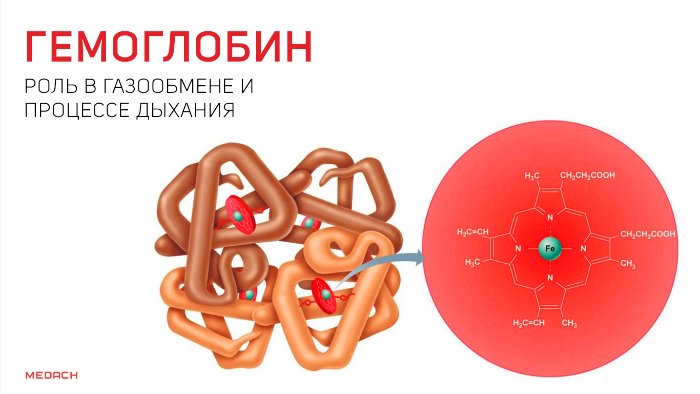
Но кислород непосредственно в ткани попадает лишь в крайне незначительных количествах: для свободного перемещения по организму ему необходим транспортер. Эту функцию выполняет содержащийся в эритроцитах белок — гемоглобин. Гемоглобин существует в оксигенированной и неоксигенированной формах. В дезокси-гемоглобине железо находится на уровне порфиринового кольца и стабилизируется электростатическими силами, что обеспечивает поддержание всей структуры. Появившись, кислород начинает «тянуть» за железо, которое переносится на проксимальный гистидин на другом конце полипептидной цепи и меняет структуру всего протеина.
В результате гемоглобин переходит в оксигенированную форму, альфа- и бета-цепи при этом поворачиваются относительно друг друга на 15 градусов, облегчая присоединение остальных молекул кислорода. В итоге каждый из четырех содержащихся в нем атомов двухвалентного железа обратимо связывается с молекулой кислорода, что превращает молекулу гемоглобина в оксигемоглобин. По сравнению с миоглобином гемоглобин имеет низкое сродство к кислороду, однако оно не статично. Так, миоглобин может связывать кислород только одним участком, поэтому кривая его связывания — гипербола. Кривая связывания гемоглобина с кислородом имеет S-образную форму, демонстрируя, что при его связывании с первой молекулой кислорода гемоглобин имеет очень низкое сродство к кислороду, но при связывании последующих молекул кислорода сродство остальных его субъединиц к нему значительно увеличивается и в конечном счете повышается примерно в 500 раз.
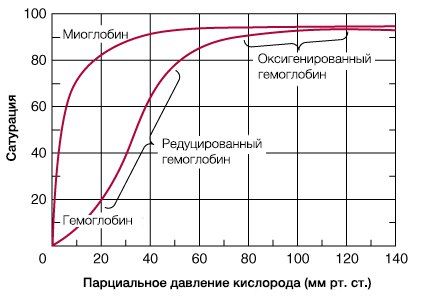
При этом альфа-цепи связывают кислород легче, чем бета-цепи. Этот процесс назван кооперативным взаимодействием. По мере снижения парциального давления кислорода в крови происходит его высвобождение из гемоглобина и поступление в ткани. Например, парциальное давление кислорода в работающих мышцах составляет всего 26 мм рт. ст, и при прохождении эритроцитов через капилляры, кровоснабжающие мышцы, происходит высвобождение и поступление в мышечные клетки примерно ⅓ всего переносимого гемоглобином кислорода. При повышении температуры тела также возрастает потребность в кислороде, что, в свою очередь, стимулирует высвобождение и поступление его в ткани. При снижении температуры, напротив, развивается гипоксия тканей, способствующая компенсаторному увеличению сродства гемоглобина к кислороду.
Гемоглобин также осуществляет перенос от тканей к легким продуктов тканевого дыхания — углекислого газа и ионов водорода. В ходе окислительных процессов в клетке выделяется углекислый газ, в результате гидратации которого образуются ионы водорода, что, в свою очередь, приводит к снижению рН. Давно известно, что снижение рН и повышение концентрации углекислого газа в крови оказывает сильное влияние на способность гемоглобина связывать кислород.
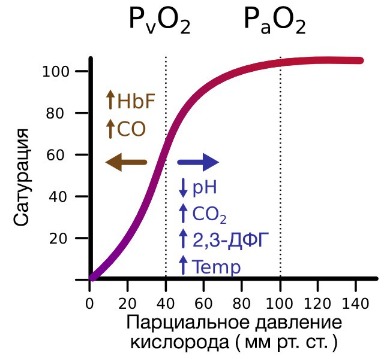
В периферических сосудах показатели рН низкие, и по мере связывания гемоглобина с ионами водорода и углекислым газом происходит снижение его сродства к кислороду. Это влияние величины рН и концентрации углекислого газа на способность гемоглобина связывать кислород называют эффектом Бора.
Обратная ситуация имеет место в альвеолярных капиллярах, где присоединение кислорода к гемоглобину превращает тот в более сильную кислоту.
При этом сродство гемоглобина к углекислому газу снижается, а повышение кислотности гемоглобина приводит к высвобождению излишка ионов водорода и образованию в крови из бикарбоната угольной кислоты, которая затем распадается на воду и углекислый газ. В обоих случаях углекислый газ из крови поступает в альвеолы, а затем в атмосферу. Данный процесс назван эффектом Холдейна. Стоит отметить, что важную роль в образовании углекислого газа в эритроцитах играет ион хлора, поступающий в плазму крови в обмен на бикарбонат при участии белка-переносчика АЕ1. Данный процесс в англоязычной литературе получил название «Chloride shift» или «перенос Хамбургера».
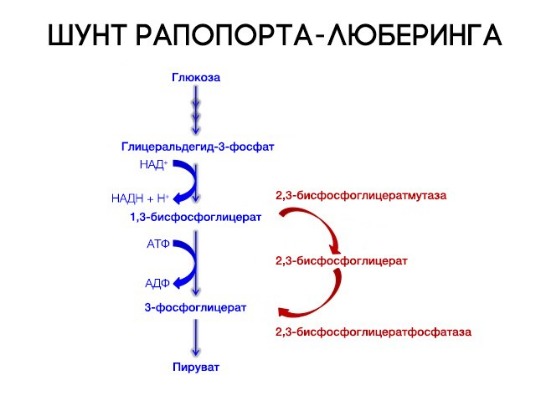
На сродство гемоглобина к кислороду оказывает влияние и присутствующее в эритроцитах вещество, получившее название 2,3-бисфосфоглицерат (БФГ). Его образование — своего рода побочная реакция анаэробного гликолиза, происходящего в эритроцитах в ходе ферментативного превращения глюкозы в пируват под действием фермента бифосфоглицератмутазы. БФГ способен самостоятельно связываться с неоксигенированной формой гемоглобина, образуя солевой мостик между двумя его бета-субъединицами и снижая сродство к кислороду.
При этом гемоглобин способен связать только одну молекулу БФГ, а при присоединении кислорода БФГ вытесняется из полости. В обычных условиях в эритроцитах крови содержится достаточно большое количество БФГ, которое может увеличиваться в условиях гипоксии (например, у дайверов при погружении на глубину), а также при восхождении на большую высоту. В первые часы подъема концентрация БФГ в эритроцитах будет возрастать, а сродство кислороду снижаться. Но на большой высоте парциальное давление будет значительно ниже такового на уровне моря, а значит, оно снизится и в тканях. При этом БФГ будет облегчать передачу кислорода от гемоглобина к тканям.
Некоторые вещества способны прочно связываться с гемоглобином или же вовсе менять его структуру. Одним из них является угарный газ, чье сродство к гемоглобину в 200 раз превышает таковое для кислорода. Отравления угарным газом часто происходят в помещениях с печным отоплением, при пожарах и авариях на производстве. Со временем кислород вытесняет угарный газ из гемоглобина, и в легких случаях пациенты помещаются под наблюдение и получают ингаляции с увлажненным кислородом. Необходимой мерой при тяжелых отравлениях угарным газом является переливание эритроцитарной массы.
К веществам, способным изменять структуру гемоглобина, относятся метгемоглобинобразователи — соединения, способные окислять двухвалентное железо в геме до трехвалентного. К ним относятся нитриты, нитраты, некоторые местные анестетики, аминофенолы, хлораты, примахин и некоторые сульфаниламиды. Состояние, характеризующееся появлением в крови окисленного гемоглобина, называют метгемоглобинемией. При высокой метгемоглобинемии капля крови, помещенная на фильтровальную бумагу, имеет характерный коричневый цвет, а при пропускании кислорода через пробирку с такой кровью ее цвет не меняется. Метгемоглобинемия выше 70 % от общего содержания гемоглобина часто приводит к гибели пациента еще до момента постановки диагноза.
Источники:
- Harrison’s hematology and oncology Longo, Dan L (Dan Louis), Third edition. New York : McGraw-Hill Education Medical, 2017.
- Наглядная физиология, С. Зильбернагль, А. Деспопулос, 2013.
- Ленинджер А. Основы биохимии: В 3-х т. Т. 1. /Д. Нельсон, М. Кокс ; Пер. с англ.-М.: БИНОМ: Лаборатория знаний, 2011.- 694 с.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Источник
Научный журнал
Научное обозрение. Медицинские науки
ISSN 2500-0780
ПИ №ФС77-57452
- Авторы
- Файлы
- English
Чеснокова Н.П. 1 Понукалина Е.В. 1 Моррисон В.В. 1 Бизенкова М.Н. 1
1 ФГБОУ ВО «Саратовский Государственный медицинский университет им. В.И. Разумовского Минздрава России»
1 1 1 1
1
Abstract:
Keywords:
4.1. Транспорт кислорода
В сложных механизмах транспорта газов кровью и газообмена в тканях важная роль отводится эритроцитам, ответственным за доставку О2 к различным органам и удаление образующегося в процессе метаболизма СО2.
Эритроцит — безъядерная клетка, лишенная митохондрий, основным источником энергии для эритроцита служит глюкоза, метаболизируемая в гексозомонофосфатном шунте или цикле Эмбдена-Мейергофа. Транспорт О2 обеспечивается в значительной мере гемоглобином, состоящим из белка глобина и гема. Последний представляет собой комплексное соединение железа и порфирина. Глобин представляет собой тетрамер полипептидной цепи. Hb A (HbA) — основной гемоглобин взрослых содержит 2 — альфа и 2 — бета — цепи, Hb A2 — содержит две альфа и две дельта цепи.
Гем состоит из иона железа, встроенного в порфириновое кольцо. Ион железа гема обратимо связывает одну молекулу О2. С одной молекулой Hb максимально связываются 4 молекулы О2 с образованием оксигемоглобина.
Гем может подвергаться не только оксигенации, но и истинному окислению, когда железо становится из двухвалентного трехвалентным. Окисленный гем носит название гематина, а молекула гемоглобина становится метгемоглобином. В крови человека метгемоглобин находится в незначительных количествах, его уровень резко возрастает при отравлениях. Метгемоглобин не способен отдавать кислород тканям.
В норме метгемоглобин составляет менее 3% общего Hb крови. Основная форма транспорта О2 — в виде оксигемоглобина. Кислород транспортируется артериальной кровью не только в связи с гемоглобином, но и в растворенном виде. Принимая во внимание тот факт, что 1 г Hb может связать 1,34 мл О2, кислородная емкость крови в среднем у взрослого человека составляет около 200 мл/л крови. Одним из показателей кислородного транспорта является насыщение артериальной крови О2(Sa O2), равного отношению О2, связанного с Hb, к кислородной емкости крови:
SaO2=O2, связанного с Hb/O2 емкость крови* 100%.
В соответствии с кривой диссоциации оксигемоглобина насыщение артериальной крови кислородом в среднем составляет 97%, в венозной крови — 75%.
PaO2 в артериальной крови около 100 мм. рт. ст., а в венозной — около 40 мм. рт. ст.
Количество растворенного кислорода в крови пропорционально парциальному давлению О2 и коэффициэнту его растворимости.
Последний для О2 составляет 0,0031/100 мл крови/ 1 мм. рт. ст.. Таким образом, 100 мл крови при PaO2, равном 100 мм. рт. ст., содержит менее 0,31 мл O2.
Диссоциация оксигемоглобина в тканях обусловлена главным образом химическими свойствами гемоглобина, а также рядом других факторов — температурой тела, рН среды, р СО2.
При понижении температуры тела наклон кривой диссоциации оксигемоглобина возрастает, а при ее повышении — снижается, и соответственно снижается сродство Hb к О2.
При снижении рН, т.е. при закислении среды, сродство гемоглобина к О2 уменьшается. Увеличение напряжения в крови СО2 также сопровождается снижением сродства Hb к О2 и уплощением кривой диссоциации оксигемоглобина.
Известно, что степень диссоциации оксигемоглобина определяется содержанием в эритроцитах некоторых фосфорорганических соединений, главным из которых является 2,3 — ДФГ (2,3 дифосфоглицерат), а также содержанием в эритроцитах катионов. В случаях развития алкалозов, поглощение О2 в легких увеличивается, но в то же время затрудняется отдача кислорода тканями. При ацидозах наблюдается обратная картина.
4.2.Утилизация кислорода тканями
Тканевое или клеточное дыхание включает три стадии. На первой стадии пируват, аминокислоты и жирные кислоты окисляются до двухуглеродных фрагментов ацетильных групп, входящих в состав ацетилкофермента А. Последние на втором этапе окисления включаются в цикл лимонной кислоты, где происходит образование высокоэнергетических атомов водорода и высвобождение СО2 — конечного продукта окисления органических субстратов. На третьей стадии клеточного дыхания атомы водорода делятся на протоны (Н+) и «высокоэнергетические» электроны, передающиеся по дыхательной цепи на молекулярный О2 и восстанавливающие его до НО2. Перенос электронов сопряжен с запасом энергии в форме АТФ, т.е. с окислительным фосфорилированием (рис.6).
Касаясь патогенеза метаболических сдвигов, свойственных гипоксическим состояниям, следует отметить, что в организме человека более 90% всего потребляемого кислорода восстанавливается с участием цитохромоксидазы митохондрий, и лишь около 10% кислорода метаболизируется в тканях с участием оксигеназ: диоксигеназы и монооксигеназы.
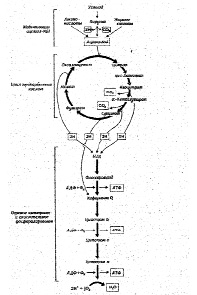
Рис.6. Схема тканевого дыхания. Конечные продукты каждой стадии даны в рамке (Ленинджер А., 1999)
Наиболее многочисленны и сложны монооксигеназные реакции, протекающие в эндоплазматическом ретикулуме клеток при участии цитохрома Р-450 и обеспечивающие гидроксилирование субстрата (стероидных гормонов, лекарственных препаратов и различных др. соединений) и, как правило, его инактивацию.
Диоксигеназы катализируют реакции, в которых в молекулу органического субстрата включаются оба атома молекулы кислорода (например, реакция окисления катехола молекулярным кислородом с раскрытием кольца).
В реакциях, связанных с переносом электронов, т.е. в реакциях окисления-восстановления, где, как указывалось выше, используется более 90% потребляемого кислорода, атомы водорода, отщепленные дегидрогеназами от субстратов в цикле лимонной кислоты, передают свои электроны в цепь переноса электронов и превращаются также в Н +. Как известно, помимо 4 пар атомов водорода, поставляемых каждым оборотом цикла лимонной кислоты, образуются и другие атомы водорода, отщепленные дегидрогеназами от пирувата, жирных кислот и аминокислот в процессе их расщепления до Ацетил-СоА и других продуктов.
Таким образом, все атомы водорода, отщепляемые дегидрогеназами от субстратов, передают свои электроны в дыхательную цепь к конечному акцептору электронов — кислороду.
Касаясь последовательности транспорта электронов в окислительно-восстановительных реакциях, протекающих на внутренней мембране митохондрий, прежде всего, следует отметить, что от всех НАД — зависимых реакций дегидрирования восстановленные эквиваленты переходят к митохондриальной НАДН — дегидрогеназе, затем через ряд железосерных ферментов передаются на убихинон М цитохрому b. Далее электроны переходят последовательно на цитохромы С1 и С, затем на цитохромы аа 3 (цитохромоксидазу — медьсодержащий фермент). В свою очередь цитохромоксидаза передает электроны на кислород. Для того, чтобы полностью восстановить кислород с образованием 2-х молекул воды требуется 4 электрона и четыре Н+ .
Скорость утилизации О2 в различных тканях различна. В среднем взрослый человек потребляет 250 мл О2 в 1 мин. Максимальное извлечение О2 из притекающей артериальной крови свойственно миокарду.
Кислород используется в клетках, в основном в метаболизме белков, жиров, углеводов, ксенобиотиков, в окислительно-восстановительных реакциях в различных субклеточных фракциях: в митохондриях, в эндоплазматическом ретикулуме, в реакциях липопероксидации, а также в межклеточном матриксе и в биологических жидкостях.
Коэффициент утилизации О2 в тканях равен отношению потребления О2 к интенсивности его доставки, широко варьирует в различных органах и тканях.
В условиях нормы минимальную потребность в О2 проявляют почки и селезенка, а максимальную потребность — кора головного мозга, миокард и скелетные мышцы, где коэффициент утилизации О2 колеблется от 0,4 до 0,6, а в миокарде до 0,7. При крайне интенсивной физической работе коэффициент утилизации О2 мышцами и миокардом может возрастать до 0,9.
Обмен дыхательных газов в тканях происходит в процессе свободной и облегченной диффузии. При этом О2 переносится по градиенту напряжения газа из эритроцитов и плазмы крови в окружающие ткани.
Одновременно происходит диффузия СО2 из тканей в кровь. На выход О2 из крови в ткани влияет диссоциация оксигемоглобина в эритроцитах, что обеспечивает так называемую облегченную диффузию О2. Интенсивность диффузионного потока О2 и СО2 определяется градиентом их напряжения между кровью и тканями, а также площадью газообмена, плотностью капилляров, распределением кровотока в микроциркуляторном русле. Интенсивность окислительных процессов в тканях определяется величиной критического напряжения О2 в митохондриях, которое в условиях нормы должно превосходить 0,1-1 мм рт. ст.
Соответствие доставки О2 к органам и тканям, возросшим потребностям в оксигенации обеспечивается на клеточном, органном уровнях за счет образования метаболитов изнашивания, а также при участии нервных, гормональных и гуморальных влияний.
4.3.Транспорт СО2
Основная масса углекислого газа (СО2) образуется в организме как конечный продукт различных метаболических реакций и транспортируется к легким с кровью. Вдыхаемый воздух содержит лишь незначительное количество СО2.
Транспорт СО2 кровью осуществляется в 3-х состояниях: в виде аниона бикарбоната, в растворенной форме и в виде карбаминовых соединений.
СО2 хорошо растворяется в плазме крови и в артериальной крови, около 5% от общей двуокиси углерода содержится в крови в растворенной форме.
Анион бикарбоната составляет около 90% от общего содержания СО2 в артериальной крови: СО2+Н2О — Н++НСО-3.
Эта реакция медленно протекает в плазме крови, но чрезвычайно интенсивно происходит в эритроцитах при участии фермента карбоангидразы. Мембрана эритроцита относительно непроницаема для Н+, как и вообще для катионов, но в тоже время, проницаема для ионов НСО-3, выход которых из эритроцитов в плазму обеспечивается притоком Cl- из плазмы в эритроциты. Часть Н+ забуферивается гемоглобином с образованием восстановленного гемоглобина.
Третьей формой транспорта СО2 кровью являются карбаминовые соединения, образованные взаимодействием СО2 с концевыми группами белков крови преимущественно с гемоглобином:
Hb NH2 + CO2 — Hb NH COOH > Hb NH COO + Н+
Карбаминовые соединения составляют около 5% от общего количества СО2, транспортируемого кровью.
В оксигенированной артериальной крови напряжение СО2 составляет 40 мм. рт. ст., а в венозной крови Рv СО2 равно 46 мм. рт. ст.
4.4.Связывание гемоглобина с окисью углерода
Угарный газ (СО) — окись углерода обладает значительно большим сродством к гемоглобину, чем О2, с последующим образованием карбоксигемоглобина. СО входит в состав бытового газа, а также выделяется при работе двигателей внутреннего сгорания. При концентрации СО во вдыхаемом воздухе всего в количестве 7*10- 4 около 50% гемоглобина превращается в карбоксигемоглобин. В норме в крови содержится около 1% HbCO, у курильщиков — 3% . В крови водителей такси концентрация карбоксигемоглобина достигает 20%. Карбоксигемоглобин диссоциирует с отдачей О2 в 200 раз медленней оксигемоглобина и в то же время препятствует его диссоциации в тканях.
Библиографическая ссылка
Чеснокова Н.П., Понукалина Е.В., Моррисон В.В., Бизенкова М.Н. ЛЕКЦИЯ 4 ФИЗИОЛОГИЯ ТРАНСПОРТА ГАЗОВ КРОВЬЮ И КИСЛОРОДНОГО ОБЕСПЕЧЕНИЯ ТКАНЕЙ // Научное обозрение. Медицинские науки. — 2017. — № 2. — С. 40-42;
URL: https://science-medicine.ru/ru/article/view?id=973 (дата обращения: 21.04.2021).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник