Угарный газ соединяется с гемоглобином
Содержание статьи
Конкуренция за эритроциты: кислород, угарный газ, сахар
Фото: фотобанк Лори
НОРМА: КИСЛОРОД И УГЛЕКИСЛЫЙ ГАЗ
Воздух, которым мы дышим, на 98% состоит из азота и кислорода. Экология мегаполисов и промышленных районов вносит свои коррективы – в воздухе появляются даже тяжелые металлы.
Но основного компонента – кислорода О2 нам все же хватает. Транспорт для кислорода – это белок гемоглобин, содержащий железо. Он содержится в «красной» крови — эритроцитах. Гемоглобин может легко соединяться с кислородом О2 и углекислым газом СО2. А самое главное – может также легко от них избавляться. Благодаря этому в легких и тканях происходит газообмен. В зависимости от количества того или иного газа и его давления кислород и углекислый газ связываются с гемоглобином.
В воздушном пространстве легких во время вдоха много кислорода – его парциальное давление большое. Поэтому кислород через специальную мембрану между тканью легкого и сосудом поступает в кровь и соединяется с гемоглобином.
С током крови оксигемоглобин поступает к тканям. Например, к мышцам и коже стопы. Там в результате жизнедеятельности клеток накапливается углекислый газ. Его давление большое, поэтому он легко вытесняет кислород из связи с гемоглобина. Кислород поступает в ткани, а СО2 уносится с током крови по венам к легким.
ОПАСНЫЙ ВРАГ №1 — УГАРНЫЙ ГАЗ
Опасность любого пожара – отравление угарным газом. Это жизнеугрожающее состояние. Угарный газ образуется при недостатке кислорода – эта молекула в отличие от углекислого газа содержит всего один атом кислорода. В результате из безобидного СО2 получается злейший СО, ведущий к отравлению организма.
Причина этого – «слабость» кислорода в сравнении с угарным газом. СО в 300 раз крепче связывается с гемоглобином! Обычное парциальное давление кислорода во вдыхаемом воздухе не поможет. Тяжесть состояния пациента в таком случае напрямую связана с объемом гемоглобина, соединенного с угарным газом. В тяжелых случаях жизненно важные органы – сердце, почки, головной мозг – практически лишаются кислорода и погибают при нормальном его содержании во вдыхаемом воздухе.
Решается проблема срочным проведением пациенту гипербарической оксигенации. При этом кислород подается пациенту под повышенным давлением – ему помогают вытеснить угарный газ из эритроцитов.
Ситуация с отравлением угарным газом обычно острая, жизнеугрожающая. Пациент находится под контролем врачей.
ОПАСНЫЙ ВРАГ №2 – ГЛЮКОЗА
Другая ситуация с хроническими заболеваниями. Здесь выявить проблему вовремя часто не удается. Кого сейчас не беспокоят слабость, утомляемость, снижение работоспособности?
Что же это – энергетический кризис в организме или просто усталость, депрессия?
Часто причина может оказаться сладкой – это глюкоза крови. В результате соединения с ней в эритроцитах формируется ГЛИКИРОВАННЫЙ ГЕМОГЛОБИН HbF1c. Его количество напрямую связано с уровнем глюкозы в крови. Основная проблема – это необратимость связывания глюкозы с гемоглобином. До конца жизни эритроцитов (пока они не попадут на распад в селезенку) гемоглобин в них остается в связанном с глюкозой состоянии. Это около 3х месяцев.
Поэтому гликированный гемоглобин, в отличие от разового измерения глюкозы, показывает средний уровень сахара в крови за 3 месяца. Для врачей это очень ценный показатель, особенно при контроле лечения сахарного диабета.
Вред, который наносит гликированный гемоглобин, такой же, как и при отравлении угарным газом. Только это не острая, а растянутая во времени проблема – хроническое кислородное голодание. Симптомы неспецифичны – это может быть и головокружение, общая слабость, плохая переносимость нагрузок. Все они являются результатом хронического дефицита кислорода и энергии.
Реализуется это пагубное влияние не так, как у угарного газа. Глюкоза связывается с гемоглобином и повышает связывание его с кислородом! В тканях кислород не может поменяться местами с углекислым газом – там накапливается СО2. Яркий медицинский пример – диабетическая стопа. При нормальном содержании кислорода в крови он не поступает в мышцы и кожу стопы. В тканях закисляется среда. Отсюда незаживающие раны при диабете. И поэтому одним из эффективных методов лечения диабетической стопы – местная (на нижние конечности) гипербарическая оксигенация.
В федеральной лаборатории «Гемотест» централизованная технологическая база площадью 3 500 квадратных метров включает 5 аналитических лабораторий.
ОБСЛЕДОВАНИЕ НА ГЛИКИРОВАННЫЙ ГЕМОГЛОБИН
Пройти обследование на показатели обмена глюкозы можно в лаборатории федерального уровня «Гемотест». Исследования в «Гемотест» выполняются на высокотехнологичном оборудовании ведущих мировых производителей, технологический комплекс площадью 3 500 кв.м. включает 5 лабораторий. Например, исследование на гликированный гемоглобин выполняется в отделе общеклинических исследований:
1.18. Гликированный гемоглобин (HbA1с)
Другие исследования углеводного обмена:
1.14.2. Глюкоза (фторид) анализ крови на сахар
1.15. Экспресс-анализ глюкозы (определяется на месте)
27.54. Сахарный диабет (скрининг) Это исследование содержит несколько показателей сахарного диабета. О возможности выполнения этого исследования в Вашем городе Вы можете узнать по телефону 8-800-550-13-13.
Всего в федеральной лаборатории «Гемотест» выполняется более 3 000 лабораторных анализов по всем медицинским специальностям. Полный список исследований Вы можете посмотреть на сайте www.gemotest.ru
Желаем Вам здоровья!
Реклама
Источник
Гемоглобин: роль в газообмене и процессе дыхания
Одним из самых сложных процессов, что происходят в организме человека, несомненно, является дыхание. И сложность эта не только в танце легких, благодаря которому человек получает кислород, но и в процессах, с помощью которых этот кислород проникает дальше, в ткани, где превращается в углекислый газ, что отправляется в обратное путешествие. О данных процессах и пойдет речь далее.
Итак, приступим. Человек делает вдох, иии… Далеко не весь кислород поступает в легкие, а затем и в кровь. Часть вдыхаемого воздуха остается в так называемом мертвом пространстве. Мертвое пространство, в свою очередь, делится на анатомическое (дыхательные пути), в котором остается около 30 % вдыхаемого воздуха, и функциональное (вентилируемые, но по каким-то причинам не перфузируемые альвеолы).
Ухудшение альвеолярного газообмена может происходить при неглубоком и частом дыхании (причиной может стать перелом ребер, паралич дыхательной мускулатуры различного генеза и др.), а также при увеличении мертвого пространства, вызванном разнообразными причинами (нарушение перфузии альвеол в результате воспалительных заболеваний легких, удаление доли или целого легкого и др.), при снижении скорости кровотока по альвеолярным капиллярам (ТЭЛА, инфаркт легкого), при наличии диффузионного барьера (отек легких) и в результате ослабления альвеолярной вентиляции при обтурации просвета бронха. Газообмен между легкими и кровью происходит путем диффузии в соответствии с законом Фика. В легочных капиллярах она происходит за счет разности парциальных давлений в альвеолах и эритроцитах.
В альвеолах парциальное давление кислорода значительно превышает таковое для углекислого газа и составляет примерно 13,3 кПа (100 мм рт. ст.) и 5,3 кПа (40 мм рт. ст.) соответственно. Альвеолы омываются приносимой легочными артериями венозной кровью, в которой соотношение парциальных давлений этих двух газов обратно пропорционально и составляет приблизительно 5,3 кПа (40 мм рт. ст.) для кислорода и 6,1 кПа (46 мм рт. ст.) для углекислого газа. В среднем разница парциальных давлений составляет около 8 кПа (60 мм рт. ст.) для кислорода и около 0,8 кПа для углекислого газа.
Как уже было сказано выше, кислород путем диффузии проникает в кровь легочных капилляров. Диффузионное расстояние для кислорода при этом составляет 1–2 мкм, то есть именно на такое расстояние он проникает внутрь капилляра. Обмен крови в легочном капилляре происходит примерно за 0,75 секунды, но этого времени хватает на то, чтобы парциальные давления в альвеолах и в крови пришли в равновесие.
Кровь, в которой показатели парциального давления для кислорода и углекислого газа примерно равны таковым в альвеолах, называется артериализированной. Однако за счет наличия в легких артериовенозных шунтов и притока венозной крови из бронхиальных вен такой она остается недолго. В результате парциальное давление кислорода в аорте составляет примерно 12,0 кПа (как уже было сказано выше, парциальное давление в артериализированной крови равно таковому в альвеолах и составляет 13,3 кПа), а давление углекислого газа меняется незначительно и не приводит к затруднению его диффузии из крови в альвеолы.
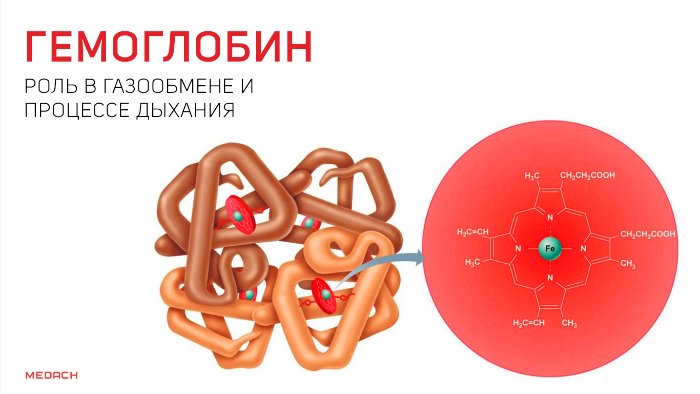
Но кислород непосредственно в ткани попадает лишь в крайне незначительных количествах: для свободного перемещения по организму ему необходим транспортер. Эту функцию выполняет содержащийся в эритроцитах белок — гемоглобин. Гемоглобин существует в оксигенированной и неоксигенированной формах. В дезокси-гемоглобине железо находится на уровне порфиринового кольца и стабилизируется электростатическими силами, что обеспечивает поддержание всей структуры. Появившись, кислород начинает «тянуть» за железо, которое переносится на проксимальный гистидин на другом конце полипептидной цепи и меняет структуру всего протеина.
В результате гемоглобин переходит в оксигенированную форму, альфа- и бета-цепи при этом поворачиваются относительно друг друга на 15 градусов, облегчая присоединение остальных молекул кислорода. В итоге каждый из четырех содержащихся в нем атомов двухвалентного железа обратимо связывается с молекулой кислорода, что превращает молекулу гемоглобина в оксигемоглобин. По сравнению с миоглобином гемоглобин имеет низкое сродство к кислороду, однако оно не статично. Так, миоглобин может связывать кислород только одним участком, поэтому кривая его связывания — гипербола. Кривая связывания гемоглобина с кислородом имеет S-образную форму, демонстрируя, что при его связывании с первой молекулой кислорода гемоглобин имеет очень низкое сродство к кислороду, но при связывании последующих молекул кислорода сродство остальных его субъединиц к нему значительно увеличивается и в конечном счете повышается примерно в 500 раз.
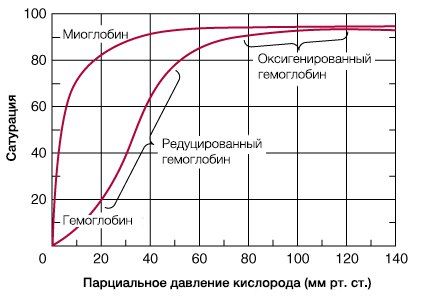
При этом альфа-цепи связывают кислород легче, чем бета-цепи. Этот процесс назван кооперативным взаимодействием. По мере снижения парциального давления кислорода в крови происходит его высвобождение из гемоглобина и поступление в ткани. Например, парциальное давление кислорода в работающих мышцах составляет всего 26 мм рт. ст, и при прохождении эритроцитов через капилляры, кровоснабжающие мышцы, происходит высвобождение и поступление в мышечные клетки примерно ⅓ всего переносимого гемоглобином кислорода. При повышении температуры тела также возрастает потребность в кислороде, что, в свою очередь, стимулирует высвобождение и поступление его в ткани. При снижении температуры, напротив, развивается гипоксия тканей, способствующая компенсаторному увеличению сродства гемоглобина к кислороду.
Гемоглобин также осуществляет перенос от тканей к легким продуктов тканевого дыхания — углекислого газа и ионов водорода. В ходе окислительных процессов в клетке выделяется углекислый газ, в результате гидратации которого образуются ионы водорода, что, в свою очередь, приводит к снижению рН. Давно известно, что снижение рН и повышение концентрации углекислого газа в крови оказывает сильное влияние на способность гемоглобина связывать кислород.
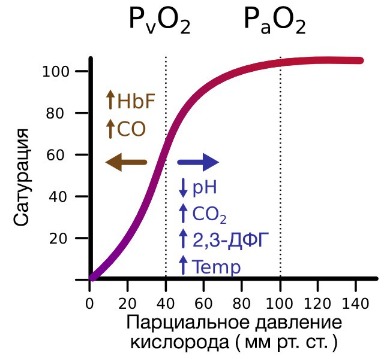
В периферических сосудах показатели рН низкие, и по мере связывания гемоглобина с ионами водорода и углекислым газом происходит снижение его сродства к кислороду. Это влияние величины рН и концентрации углекислого газа на способность гемоглобина связывать кислород называют эффектом Бора.
Обратная ситуация имеет место в альвеолярных капиллярах, где присоединение кислорода к гемоглобину превращает тот в более сильную кислоту.
При этом сродство гемоглобина к углекислому газу снижается, а повышение кислотности гемоглобина приводит к высвобождению излишка ионов водорода и образованию в крови из бикарбоната угольной кислоты, которая затем распадается на воду и углекислый газ. В обоих случаях углекислый газ из крови поступает в альвеолы, а затем в атмосферу. Данный процесс назван эффектом Холдейна. Стоит отметить, что важную роль в образовании углекислого газа в эритроцитах играет ион хлора, поступающий в плазму крови в обмен на бикарбонат при участии белка-переносчика АЕ1. Данный процесс в англоязычной литературе получил название «Chloride shift» или «перенос Хамбургера».
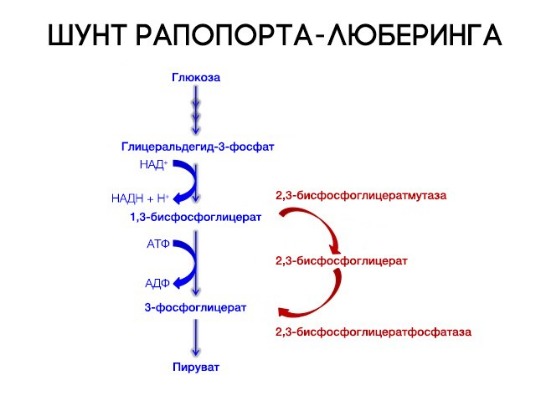
На сродство гемоглобина к кислороду оказывает влияние и присутствующее в эритроцитах вещество, получившее название 2,3-бисфосфоглицерат (БФГ). Его образование — своего рода побочная реакция анаэробного гликолиза, происходящего в эритроцитах в ходе ферментативного превращения глюкозы в пируват под действием фермента бифосфоглицератмутазы. БФГ способен самостоятельно связываться с неоксигенированной формой гемоглобина, образуя солевой мостик между двумя его бета-субъединицами и снижая сродство к кислороду.
При этом гемоглобин способен связать только одну молекулу БФГ, а при присоединении кислорода БФГ вытесняется из полости. В обычных условиях в эритроцитах крови содержится достаточно большое количество БФГ, которое может увеличиваться в условиях гипоксии (например, у дайверов при погружении на глубину), а также при восхождении на большую высоту. В первые часы подъема концентрация БФГ в эритроцитах будет возрастать, а сродство кислороду снижаться. Но на большой высоте парциальное давление будет значительно ниже такового на уровне моря, а значит, оно снизится и в тканях. При этом БФГ будет облегчать передачу кислорода от гемоглобина к тканям.
Некоторые вещества способны прочно связываться с гемоглобином или же вовсе менять его структуру. Одним из них является угарный газ, чье сродство к гемоглобину в 200 раз превышает таковое для кислорода. Отравления угарным газом часто происходят в помещениях с печным отоплением, при пожарах и авариях на производстве. Со временем кислород вытесняет угарный газ из гемоглобина, и в легких случаях пациенты помещаются под наблюдение и получают ингаляции с увлажненным кислородом. Необходимой мерой при тяжелых отравлениях угарным газом является переливание эритроцитарной массы.
К веществам, способным изменять структуру гемоглобина, относятся метгемоглобинобразователи — соединения, способные окислять двухвалентное железо в геме до трехвалентного. К ним относятся нитриты, нитраты, некоторые местные анестетики, аминофенолы, хлораты, примахин и некоторые сульфаниламиды. Состояние, характеризующееся появлением в крови окисленного гемоглобина, называют метгемоглобинемией. При высокой метгемоглобинемии капля крови, помещенная на фильтровальную бумагу, имеет характерный коричневый цвет, а при пропускании кислорода через пробирку с такой кровью ее цвет не меняется. Метгемоглобинемия выше 70 % от общего содержания гемоглобина часто приводит к гибели пациента еще до момента постановки диагноза.
Источники:
- Harrison’s hematology and oncology Longo, Dan L (Dan Louis), Third edition. New York : McGraw-Hill Education Medical, 2017.
- Наглядная физиология, С. Зильбернагль, А. Деспопулос, 2013.
- Ленинджер А. Основы биохимии: В 3-х т. Т. 1. /Д. Нельсон, М. Кокс ; Пер. с англ.-М.: БИНОМ: Лаборатория знаний, 2011.- 694 с.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Источник
Оксигемоглобин: понятие, механизм образования, кривая диссоциации и её сдвиги
© Автор: З. Нелли Владимировна, врач лабораторной диагностики НИИ трансфузиологии и медицинских биотехнологий, специально для СосудИнфо.ру (об авторах)
Красный пигмент крови человека, сложный железосодержащий белок (хромопротеин, состоящий из глобина и четырех гемов с двухвалентным железом в центре каждого) – гемоглобин (Hb), соединяясь с молекулярным кислородом (O2) в легких, образует оксигенированную форму – оксигемоглобин (HHbO2). Оксигемоглобин, приобретая уникальные свойства и обеспечивая дыхание, как одно из элементарных проявлений жизни, продолжает саму жизнь организма. Например, достаточно ввести окись углерода вместо кислорода или нарушить потребление О2 клетками при попадании цианидов (солей синильной кислоты), которые ингибируют ферментные системы тканевого дыхания, как тут же наступает гибель организма.
Дыхание, на первый взгляд, кажется совсем простым процессом. Между тем, оно основано на взаимодействии многих компонентов, составляющих гигантскую молекулу красного пигмента крови – хромопротеина гемоглобина, который, в свою очередь, отличается многообразием производных, где из их числа несомненный интерес вызывает оксигемоглобин. Итак, оксигемоглобин образуется в легких путем соединения сложного железосодержащего белка гемоглобина с кислородом, поступающим с вдыхаемым воздухом.
Образование и распад оксигемоглобина
В спокойном состоянии тканям человеческого тела достаточно около 0,2 л кислорода в одну минуту, но все меняется при физической нагрузке и чем она интенсивнее, тем больше необходимого для дыхания газа запрашивают ткани. Для удовлетворения их нужд потребность в кислороде может увеличиваться в 10 – 15 раз и составлять до 2, а то и 3 литров О2 в одну минуту. Однако газообразный кислород в данном количестве никак не сможет пробраться в ткани, поскольку он почти не растворим и в воде, и в плазме, то есть, этот элемент в ткани должен доставить какой-то белок, способный соединиться с ним и решить задачу транспорта.
Кровь, как биологическая среда, реализует свои функциональные обязанности по обеспечению дыхания за счет присутствия в ней сложного содержащего железо протеина – гемоглобина, физиологическая роль которого, как транспортного средства кислорода, базируется на способности Hb связывать и отдавать О2 в корреляции с концентрацией (парциальным давлением – P) данного газа в крови. Образование оксигемоглобина осуществляется в паренхиме легких, куда кислород прибывает при дыхании из воздуха окружающей среды.
Процесс образования HHbO2 происходит в доли секунды (0,01 с), поскольку кровь в легких задерживается всего-то на полсекунды. Схематично и коротко образование оксигемоглобина можно представить в следующем виде:
- Попадая в капиллярные сосуды легких, кровь обогащается кислородом, то есть, красный кровяной пигмент к своим 4 гемам присоединяет кислород – идет реакция окисления (оксигенации);
- Кислород связывается с гемами хромопротеина при помощи координационных связей феррума (железо – Fe) и, не изменяя в данном случае валентности последнего (в геме валентность железа всегда – II), переводит его (Hb) в несколько иное состояние;
- Гем железосодержащего протеина представляет собой активный центр, с его помощью хромопротеин в результате вышеуказанной реакции переходит в непрочный комплекс – оксигенированный гемоглобин (HHbO2), который, находясь в красных кровяных тельцах – эритроцитах, с током крови доставляется к клеткам тканей, чтобы через распад оксигемоглобина и выделения в процессе диссоциации кислорода, обеспечить их дыхание.
Таким образом, результатом реакции оксигенации становится образование оксигемоглобина, подкисление биологической жидкости, снижение ее щелочного резерва, то есть, ее умения связывать углекислоту (СО2), которое, разумеется, на тот момент снижается.
Железосодержащий протеин, насытившись в легочной паренхиме кислородом и приобретя оксигенированную форму, уносит О2 к тканям, в капиллярных сосудах которых его концентрация в крови резко понижена. Там происходит распад оксигемоглобина (диссоциация), кислород уходит на тканевое дыхание, гемоглобин забирает отработанный углекислый газ, превращаясь в другую физиологическую модель – карбогемоглобин (HHbCO2), и в этом качестве отправляется в главный орган дыхания, чтобы обменять CO2 на очередную порцию необходимого организму газа.
Кривая образования и распада (диссоциации) оксигемоглобина
Агентом, гарантирующим быстрое насыщение железосодержащего белка кислородом (образование оксигемоглобина), выступает высокое напряжение (парциальное давление) О2 в легочных альвеолах (порядка 100 мм рт. ст.).
Корреляцию между степенью насыщения красного кровяного пигмента кислородом и парциальным давлением O2 (PO2) выражают в виде S-образной кривой (сигмоиды), которую называют кривой диссоциации оксигемоглобина.
Свойственная красному кровяному пигменту S-образная (сигмоида) кривая диссоциации оксигемоглобина свидетельствует о том, что контактирование первой молекулы О2 с одним из гемов Hb открывает путь присоединению других молекул элемента остальными тремя гемами. Кривой насыщения железосодержащего белка кислородом принадлежит немалая физиологическая значимость – S-образная конфигурация позволяет крови обогатиться данным газом при изменениях концентрации кислорода в биологической жидкости в довольно обширных интервалах. К примеру, не следует ожидать таких особенных расстройств дыхательной функции крови, как выраженное кислородное голодание (гипоксия), при подъеме на высоту до 3,5 км над уровнем моря или во время перелета на самолете. Хотя PO2 во вдыхаемом воздухе сильно понизится, концентрация кислорода в крови будет находиться на достаточно высоком уровне, чтобы обеспечить насыщение Hb данным газом. На это указывает и отлогий график формирования и распада оксигемоглобина на верхнем его отрезке (верхний отрезок кривой свидетельствует о течении процесса насыщения О2 красного пигмента крови в легочной паренхиме и находится в пределах 75 – 98%).
Кривая диссоциации оксигемоглобина может быть разделена на 4 отрезка, каждому их которых соответствует определенный период образования оксигемоглобина (зависимость скорости насыщения хромопротеина кислородом от парциального давления газа в крови):
- 0 – 10 мм рт. ст. – гемоглобин не спешит насыщаться;
- 10 – 40 мм рт. ст. – оксигенация резко ускоряется (стремительный подъем кривой), доходя до 75%;
- 40 – 60 мм рт. ст. – оксигенация заметно замедляется, потихоньку добираясь до 90%;
- Значения PO2 пересекают отметку 60 мм рт. ст. – насыщение идет слабо (линия лениво ползет вверх). Однако кривая медленно продолжает стремиться к отметке 100%, но, так и не достигнув ее, останавливается на уровне 96 – 98%. Кстати, и такие показатели насыщения Hb кислородом отмечаются только у молодых и здоровых людей (PO2 артериальной крови ≈ 95 мм рт. ст., легочных капилляров – ≈ 100 мм рт. ст.). С возрастом дыхательные способности крови снижаются.
Несовпадение парциального давления кислорода артериальной крови и смеси газов в альвеолах легких трактуется:
- Некоторыми разногласиями между интенсивностью тока крови и вентилированием разных отделов главного органа дыхания – легких;
- Притоком незначительного объема крови из бронхиальных вен в венозные сосуды легких (шунтирование), где, как известно, течет артериальная кровь;
- Прибытием доли крови из коронарных вен в левый желудочек сердца посредством тебезиевых вен (вены Тебезия-Вьессена), в которых проходимость возможна в обоих направлениях.
Между тем, причины, вследствие которых кривая образования и диссоциации оксигемоглобина приобрела сигмоидную форму, пока остаются не до конца выясненными.
Смещение кривой диссоциации оксигемоглобина
Но кривая диссоциации оксигемоглобина, о которой идет речь выше, справедлива, если в организме все нормально. В других ситуациях график может сдвигаться в ту или иную сторону.
В числовом выражении сродство гемоглобина к кислороду обозначается величиной P50 – напряжение полунасыщения красного пигмента крови кислородом или иными словами: парциальное напряжение О2, при котором 50% Hb пребывает в форме оксигемоглобина (оптимальные условия: рН – 7,4, tº – 37ºC). Нормальные значения этого показателя в артериальной крови приближаются к величине 34,67 гПа (26 мм рт. ст.). Смещение графика вправо указывает на то, что способность красного кровяного пигмента соединяться с кислородом снижается, что, естественно, увеличивает значения P50. И, наоборот – смещение кривой влево говорит об увеличении сродства этого хромопротеина к кислороду (↓P50.).
Ходу сигмоиды помогают некоторые факторы, повышающие обогащение крови кислородом и таким образом участвующие в тканевом дыхании, поэтому названные вспомогательными:
- Повышение водородного показателя (pH) крови (эффект Бора), поскольку способность гемоглобина присоединять кислород связана с водородным показателем (pH) данной биологической среды (гемоглобин представляет одну из четырех буферных систем и влияет на регуляцию кислотно-основного баланса, поддерживая pH на нужном уровне: 7,36 – 7,4). Следовательно, чем выше водородный показатель, тем активнее ведет себя гемоглобин в отношении кислорода и наоборот – снижение pH отнимает возможности хромопротеина присоединять кислород, например: ↓pH до 7,2 заставит график отклоняться вправо (≈ на 15%), ↑pH до 7,6 передвинет кривую диссоциации оксигемоглобина влево (≈ на 15%);
- Отделение углекислого газа от карбогемоглобина в легких и выход СО2 с выдыхаемым воздухом (эффект Бора-Вериго) на фоне повышения водородного показателя создает условия для жадного насыщения гемоглобина кислородом (образование оксигемоглобина в легких);
- Возрастание уровня значимого для обмена фосфата – 2,3-дифосфоглицерата (2,3-ДФГ), содержание которого в крови меняется в зависимости от условий протекания обменных процессов;
- Снижение температуры в легких (в тканях она выше, нежели в легких) и чем ниже упадет tº, тем больше способностей присоединять кислород появляется у железосодержащего белка (при повышении температуры идет обратный эффект).
Уровень красного пигмента в крови, а также его способность присоединять кислород (кривая диссоциации оксигемоглобина) в некоторой степени подвержены возрастным колебаниям. Так, у младенцев, только-только известившим мир о своем появлении первым криком, количество гемоглобина заметно выше, что объясняется присутствием фетального гемоглобина, который, как известно, обладает повышенным сродством к кислороду. Красный пигмент крови стариков, напротив, постепенно снижает способности связывать кислород.
В заключение хочется заметить, что гемоглобин не только имеет сродство к кислороду и довольно легко соединяется с углекислым газом. Кроме физиологических соединений красного кровяного пигмента при определенных условиях возникают связи с другими газами, в частности – с угарным газом (CO) и оксидом азота (NO), причем соединение происходит также непринужденно
Высокое сродство Hb к угарному газу влечет образование карбоксигемоглобина (HHbCO), который препятствует соединению хромопротеина с кислородом, а в результате этого ткани остаются без O2. К чему это может привести – всем известно: при отравлении угарным газом высок риск смертельного исхода, если вовремя не помочь человеку.
При отравлении оксидом азота или парами нитробензола гемоглобин переходит в метгемоглобин (HHbOH) с изменением валентности железа (II → III). Метгемоглобин также не позволяет кислороду соединиться с гемоглобином, в итоге – наступает кислородное голодание тканей, создается угроза жизни организма.
Видео: о транспорте кислорода и углекислого газа гемоглобином
Рекомендации читателям СосудИнфо дают профессиональные медики с высшим образованием и опытом профильной работы.
На ваш вопрос в форму ниже ответит один из ведущих авторов сайта.
В данный момент на вопросы отвечает: А. Олеся Валерьевна, к.м.н., преподаватель медицинского вуза
Поблагодарить специалиста за помощь или поддержать проект СосудИнфо можно произвольным платежом по ссылке.
Источник