В состав молекулы гемоглобина входит двухвалентный катион
Содержание статьи
Гемоглобин — основной белок крови
Гемоглобин входит в состав группы белков гемопротеины, которые сами являются подвидом хромопротеинов и подразделяются на неферментативные белки (гемоглобин, миоглобин) и ферменты (цитохромы, каталаза, пероксидаза). Небелковой частью их является гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями.
Строение гемоглобина
Строение гемоглобина А
Гемоглобин представляет собой белок, включающий 4 гемсодержащие белковые субъединицы. Между собой протомеры соединяются гидрофобными, ионными, водородными связями, при этом они взаимодействуют не произвольно, а определенным участком – контактной поверхностью. Этот процесс высокоспецифичен, контакт происходит одновременно в десятках точек по принципу комплементарности. Взаимодействие осуществляют разноименно заряженные группы, гидрофобные участки, неровности на поверхности белка.
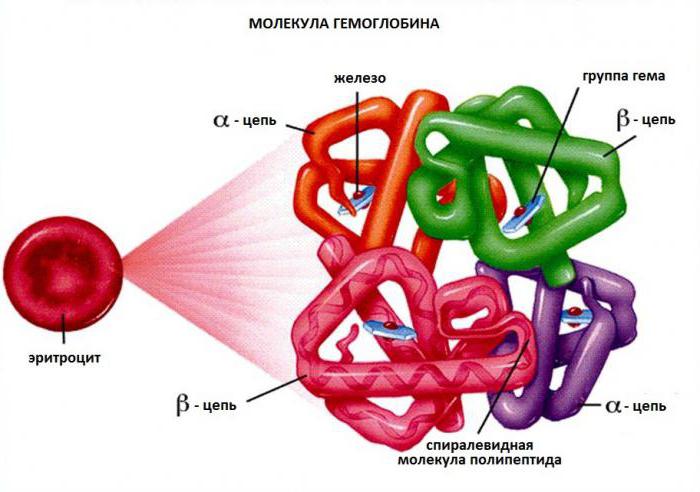
Белковые субъединицы в нормальном гемоглобине могут быть представлены различными типами полипептидных цепей: α, β, γ, δ, ε, ξ (соответственно, греч. — альфа, бета, гамма, дельта, эпсилон, кси). В состав молекулы гемоглобина входят по две цепи двух разных типов.
Гем соединяется с белковой субъединицей, во-первых, через остаток гистидина координационной связью железа, во-вторых, через гидрофобные связи пиррольных колец и гидрофобных аминокислот. Гем располагается как бы «в кармане» своей цепи и формируется гемсодержащий протомер.
Нормальные формы гемоглобина
Существует несколько нормальных вариантов гемоглобина:
- HbР (primitive) – примитивный гемоглобин, содержит 2ξ- и 2ε-цепи, встречается в эмбрионе между 7-12 неделями жизни,
- HbF (foetal) – фетальный гемоглобин, содержит 2α- и 2γ-цепи, появляется через 12 недель внутриутробного развития и является основным после 3 месяцев,
- HbA (adult) – гемоглобин взрослых, доля составляет 98%, содержит 2α- и 2β-цепи, у плода появляется через 3 месяца жизни и к рождению составляет 80% всего гемоглобина,
- HbA2 – гемоглобин взрослых, доля составляет 2%, содержит 2α- и 2δ-цепи,
- HbO2 – оксигемоглобин, образуется при связывании кислорода в легких, в легочных венах его 94-98% от всего количества гемоглобина,
- HbCO2 – карбогемоглобин, образуется при связывании углекислого газа в тканях, в венозной крови составляет 15-20% от всего количества гемоглобина.
Патологические формы гемоглобина
HbS – гемоглобин серповидно-клеточной анемии.
MetHb – метгемоглобин, форма гемоглобина, включающая трехвалентный ион железа вместо двухвалентного. Такая форма образуется спонтанно, при взаимодействии молекулы O2 и гемового Fe2+, но обычно ферментативных мощностей клетки хватает на его восстановление. При использовании сульфаниламидов, употреблении нитрита натрия и нитратов пищевых продуктов, при недостаточности аскорбиновой кислоты ускоряется переход Fe2+ в Fe3+. Образующийся metHb не способен связывать кислород и возникает гипоксия тканей. Для восстановления Fe3+ в Fe2+ в клинике используют аскорбиновую кислоту и метиленовую синь.
Hb-CO – карбоксигемоглобин, образуется при наличии СО (угарный газ) во вдыхаемом воздухе. Он постоянно присутствует в крови в малых концентрациях, но его доля может колебаться от условий и образа жизни.
Угарный газ является активным ингибитором гем-содержащих ферментов, в частности, цитохромоксидазы, 4-го комплекса дыхательной цепи.
Карбоксигемоглобин присутствует и в норме в количестве 0,5-1,5%, в сельской местности меньше, чем в городе. У курильщиков концентрация Hb-CO возрастает, в зависимости от количества сигарет в день, до 8-9%.
HbA1С – гликозилированный гемоглобин. Концентрация его нарастает при хронической гипергликемии и является хорошим скрининговым показателем уровня глюкозы крови за длительный период времени (время жизни эритроцита, 3-4 месяца).
Источник
В состав гемоглобина входит…? Качественный состав гемоглобина
Какой микроэлемент входит в состав гемоглобина и эритроцитов? Кровь является самой важной субстанцией организма человека. Она обеспечивает питание, а кроме того, межклеточный обмен.
Гемоглобин представляет собой вещество белковой природы, которое входит в состав кровяных телец, которые отвечают за так называемую транспортировку кислорода между клетками различных органов человека и легкими. В том случае, если гемоглобин в крови человека понижен, то кислород к тканям поступает весьма слабо.
Нарушение столь важного процесса может очень плохо отразиться на общем самочувствии человека. Но также негативно на здоровье сказывается и его повышенный уровень.
Элемент, входящий в состав гемоглобина, интересует многих.
Отклонения содержания гемоглобина в крови
Дефицит данного вещества способен вызывать упадок сил наряду с общей слабостью организма, снижением трудоспособности и нарушением памяти. В качестве сопутствующих симптомов человек может наблюдать у себя частые обморочные состояния либо следующие признаки:
- Высыхание слизистых.
- Высыхание кожных покровов.
- Ослабление ногтей и волос.
Ионы железа
Ионы железа, которые входят в состав гемоглобина, занимаются доставкой кислорода к клеткам всех тканей. Поэтому нехватка данных элементов вызывает так называемую железодефицитную анемию.
Подобные патологические состояния способны вызвать у людей не только снижение уровня железа в гемоглобине. Вероятна обильная потеря этого элемента во время месячных, в процессе родов. Основным источником этого элемента в продуктах выступает животный белок. Собственно, его недостаток и вызывает плохое самочувствие.
Что касается высокого показателя гемоглобина, то это свидетельствует о повышенном уровне сахара, об онкологических процессах либо всевозможных нарушениях работы сердца и так далее. О данном состоянии может свидетельствовать и дефицит фолиевой кислоты, витамина В12. При повышенных показателях гемоглобина кровь обладает высокой вязкостью и густой консистенцией. Такое явление может послужить причиной образования тромбов в сосудах, что гарантированно приводит к инфарктам.
Таким образом, показатель гемоглобина в составе крови обязательно должен находиться в норме. Для того чтобы предупредить столь опасные патологии в организме, как анемия, доктора всегда назначают сдачу крови на гемоглобин.
О чем говорит анализ крови?
Без выполнения общего анализа крови нельзя произвести ни одного диагностирования. Расшифровка составляющих компонентов имеет несколько этапов, позволяющих определить степень опасности заболевания, динамику его развития в рамках проведенного лечения.
Главным в анализе служит значение наличия эритроцитов наряду с лейкоцитами, уровнем гемоглобина, лейкоцитарной формулой, скоростью оседания эритроцитов и гематокритом. Какой микроэлемент входит в состав гемоглобина? Это железо.
Как уже было отмечено, пониженный уровень может послужить причиной возникновения анемии. Показатель эритроцитов сообщает о присутствии красных кровяных телец в клетках, которые в своем составе содержат гемоглобин, играя при этом роль некоего транспорта для кислорода, который нужен тканям. Эритроциты выполняют защитную роль, так как принимают участие в иммунных и аутоиммунных процессах, абсорбируя токсины.
Они, помимо всего прочего, отвечают и за доставку аминокислот от пищеварительных органов к тканям человеческого организма. А вот какие ионы входят в состав гемоглобина?
В расшифровке анализа присутствует такой показатель как гематокрит, демонстрирующий соотношение объема эритроцитов к плазме. Собственно, этот показатель и помогает определить, имеются нарушения процесса соединения гемоглобина или нет. Данное значение фиксируют в процентном соотношении. Нормальным показателем у женщин до тридцати лет является 43,5 %, а у мужчин – 49 %. У женщин в возрасте от 50 до 65 лет это значение доходит до 45 %, а у мужчин – до 49 %.
Все приведенные значения при общей совокупности дают возможность доктору своевременно определить начало развития той или иной патологии, осуществить своевременное лечение для пациента.
Что входит в состав гемоглобина?
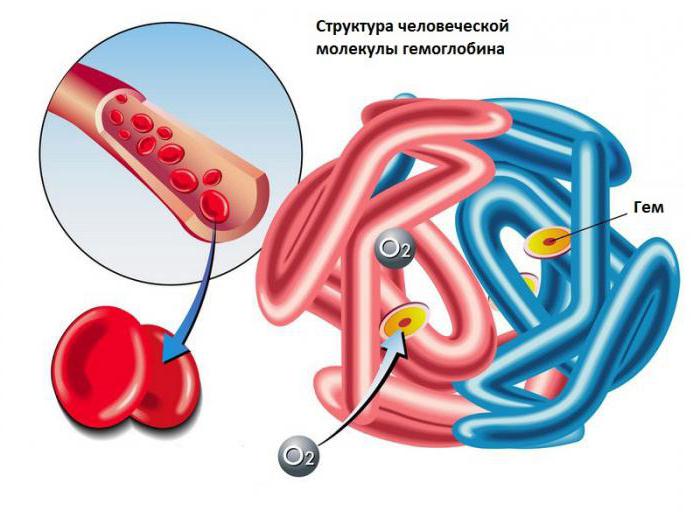
Итак, гемоглобин служит главным компонентом эритроцитов. В его состав входит «гем», что представляет собой комплексное соединение железа, и «глобин». Непосредственно в крови данный белок присутствует в форме соединения гемоглобина с кислородом.
Также существует форма другого вида гемоглобина, который называется оксигемоглобин. Этот тип остается без кислорода и находится в артериальной крови. Что касается венозной крови, то в ней присутствуют обе представленные формы. Какой микроэлемент входит в состав гемоглобина и эритроцитов?
Гематокрит
Важную роль в рамках диагностирования анемических патологий играет определение значения концентрации гемоглобина, общей величины гематокрита. Напомним, что этот элемент является объемом красных клеток, содержащихся в крови. Таким образом, анемию, как правило, диагностируют при следующих показателях:
Среди мужчин, при факте снижения концентрации гемоглобина менее 140 грамм на литр, а показатель гематокрита ниже 42 %.
Среди женщин, при снижении меньше 120 грамм на литр и 37 % гематокрита.
В том случае, если была диагностирована анемия, концентрация данного вещества, что входит в состав гемоглобина, может колебаться. Это зависит от формы и общей степени ее выраженности.
Анемия, которая вызывается дефицитом железа в крови, сообщает об умеренном снижении гемоглобина, то есть не больше, чем 114 грамм на литр. На фоне сильных кровопотерь данный показатель может приобретать значение, равное 85 граммам на литр. Минимальным показателем этого вещества в крови у живых людей является 10 грамм на литр.
В состав гемоглобина входят молекулы белка.

Заключение
Для того чтобы повысить уровень гемоглобина и предотвратить появление анемии необходимо обратить внимание на питание, которое обязательно должно являться сбалансированным и полноценным. В особенности следует остановиться на продуктах, которые содержат железо.
Самые богатые на это вещество: говядина, куриные яйца, курага и грецкие орехи. В рацион также следует включить и кисломолочные изделия. Так, мы выяснили, что входит в состав гемоглобина.
Источник
Просто о сложном: что представляет собой синтез гемоглобина

Синтез гемоглобина происходит в костном мозге. Он образуется из гема и глобина. Гем – это соединение порфирина и железа, а глобин представлен двумя цепочками аминокислот: 2 альфа и 2 бета.
Один гем и глобин называются субъединицей, в гемоглобине их 4. Каждая может присоединять из воздуха и отдавать клетке кислород, а в обратном направлении переносится углекислый газ. При недостатке железа развивается железодефицитная анемия, так как железо удерживает части гема, обеспечивает соединение гема и глобина.
При нарушении образования цепей глобина развивается талассемия со склонностью к тромбозу и серповидно-клеточная анемия с поражением печени, селезенки, накоплением железа. Если есть врожденный дефект синтеза порфирина, то возникают порфирии, их типичный признак – это красная моча. Печеночная порфирия также появляется при злоупотреблении снотворными группы барбитуратов.
Синтез гемоглобина: пояснение простыми словами
Синтез гемоглобина проходит в клетках-предшественниках эритроцитов – эритробластах и ретикулоцитах костного мозга. Для его образования нужны порфирины, глобин (белок) и ионы железа. Порфирин – это аморфное (некристаллическое) вещество, при пропускании через него света появляется красное окрашивание. Источниками для его синтеза является аминокислота, глицин и коэнзим А (производное янтарной кислоты).
Из порфирина и железа образуется гем. Биохимия этого процесса включает ряд последовательных реакций с появлением порфобилиногена. Потом требуется его 4 молекулы для формирования комплекса уропорфириногена, превращающегося в протопорфирин. Именно последний и соединяется с железом. Одновременно и в том же количестве образуется белок глобин из аминокислот. При соединении гема и глобина появляется гемоглобин.
Для нормального образования гема требуется витамин В6, В12, фолиевая кислота, ионы меди и кобальта. Поэтому при однообразном питании с дефицитом мяса, овощей, ягод и круп уменьшается синтез гемоглобина. Также причиной нарушений бывают и врожденные болезни с нарушением усвоения витаминов и минералов. Так развиваются дефицитные анемии. Наиболее известная и распространенная форма – это железодефицитная, но возможны и фолиеводефицитная, В12-дефицитная.
Какую структуру имеет молекула гемоглобина
Молекула гемоглобина в структуре содержит белковую часть – глобин и пигментный комплекс с железом (гем). У взрослого человека белок имеет 2 альфа и 2 бета цепи, они состоят из 141 и 146 аминокислот соответственно. Нормальный гемоглобин имеет обозначение HbA1. Следовые количества представлены HbA2, в нем вместо бета-цепей есть дельта-цепи. Такой комплекс прочно удерживает кислород и с трудом его отдает тканям.
В крови у плода есть два вида гемоглобина – эмбриональный и фетальный. Они имеют другую первичную структуру. У новорожденного 80% составляет фетальный, а к концу первого месяца молекула приобретает вид обычного, характерного для взрослого.
Число гемов в составе молекулы
Молекула гемоглобина состоит из четырех гемов. Каждый гем внутри содержит железо и окружен глобином, образующим гемовый «карман». Такое расположение обеспечивает растворимость и возможность соединения с кислородом. Каждая субъединица может связывать одну молекулу кислорода.
Поэтому на каждый гемоглобин эритроцита приходится 4 молекулы кислорода. После того, как доставка кислородных молекул завершена, гемоглобин забирает из тканей углекислоту, и в легких она выделяется в воздух при выдохе.
Роль железа в синтезе гемоглобина
Железо является необходимым компонентом для синтеза гемоглобина, так как оно обеспечивает связи ядер порфирина, аминокислот глобина, то есть оно удерживает весь комплекс. Биологическая роль железа состоит также в:
- связывании кислорода в легких;
- транспортировке кислорода к тканям и внутриклеточном переносе к митохондриям;
- использовании кислородных ионов для образования энергии;
- обезвреживании токсичных соединений.
Источниками минерала является пища и ионы, образовавшиеся при распаде гемоглобина (повторное использование). Усиление всасывания железа из кишечника происходит при снижении его запасов. Хранится микроэлемент в виде ферритина.
Болезни с нарушением синтеза гемоглобина
Снижение синтеза гемоглобина происходит при дефицитных анемиях, но есть и более редкие формы нарушений – образование неправильных цепей глобина (гемоглобинозы) и дефекты порфирина (порфирии).
Гемоглобинозы
Гемоглобинозы делятся на гемоглобинопатии и талассемии.
Гемоглобинопатии характеризуются образованием гемоглобина неправильной структуры. Могут протекать бессимптомно при мелких изменениях или тяжело при существенных аномалиях. Примером опасной формы является серповидно-клеточная анемия. При ней образуется HbS. Глутаминовая кислота в нем заменена на валин в шестом положении бета-цепи. Это приводит к снижению растворимости гемоглобина внутри эритроцита, и он образует осадок в виде серпа. Для этого заболевания характерны:
- нарушение кровотока в мелких сосудах;
- склонность к тромбозам;
- высокий риск инсульта, инфаркта;
- ускоренное разрушение эритроцитов (гемолитическая анемия);
- одышка, особенно при физических нагрузках.
При талассемии нарушается синтез одной из цепей гемоглобина. Чаще всего изменяется бета-цепь. Фетальный гемоглобин из-за этого не превращается в полноценный HbA1, его в крови у взрослых содержится до 60%, а вторая форма с плохой отдачей кислорода HbA2 составляет около 15%. Эти формы гемоглобина нестойкие, поэтому эритроциты быстро разрушаются. Болезнь сопровождается:
- разрастанием и разрушением костного мозга;
- изменениями формы лица и черепа;
- поражением селезенки и печеночной ткани;
- увеличением количества железа в сыворотке крови и его отложением в тканях.
Причиной смерти больного чаще всего бывает сердечная недостаточность из-за накопления железа в миокарде.
Порфирии
Нарушение янтарно-глицинового пути образования порфирина приводит к порфирии. Это врожденные и приобретенные болезни, наиболее распространены эритроцитарная и печеночная. Первая характеризуется дефектом ферментов, участвующих в синтезе гема. В организме накапливается уропорфириноген, он не может включиться в гемовый остаток и выделяется с мочой, концентрируется в костном мозге. Типичные признаки:
- красная моча;
- ускоренное разрушение эритроцитов;
- красноватый оттенок зубов;
- высокая чувствительность к солнечным лучам.
Печеночная порфирия бывает врожденной и на фоне злоупотребления барбитуратами (снотворные). Моча имеет цвет красного вина, больные предъявляют жалобы на частую рвоту, запоры, нарушения работы сердца, боль в животе. Нередко возникают психические расстройства.
Для синтеза гемоглобина нужно железо, белок, витамины, немного меди и кобальта. Его образование происходит в костном мозге, а при нарушении возникает талассемия, порфирии, серповидно-клеточная и дефицитные анемии.
Источник
22
Ζ
.
22.1.
,
.
.
,
. ,
,
, .
.
.
,
.
64 500, 16 000 [2, 7, 18].
.
. ,
.
,
, (.
22.1). ,
.
,
, .
. O2
, .
, ()
(O2). ,
,
, ; .
, ,
.
,
.
(. 22.2). (),
.
,
.
,
.

. 22.1.

. 22.2. , ( )
( ).
( . 22.3)
.
, 10000 ,
. ,
140 .
.
[26, 27]. .
22.3 ,
. ,
.
. ,
, .
()

. 22.3. (
[26, 27])
, 141
, a,
( 146 )b.
(HbF) b g,
. HbF [2].
.
, ,
. ,
,
.
.
(,
, ) ,
, . . ,
() .
,
,
( ),
( )
577 541 [II].
, ,
.
.
555 .
.
.
, (
) .
.
(I0) (I)
. I/I0 ,
(I0 I)/I0 .
.

. 22.4. (bO2) (b).
,
. . 22.4
. ,
,
.
, , .
, ,
.
,
, ,
b bO2
.
,
. ,
,
(. ).
, , ,
,
, . . 600, 577, 470 .
. (. . 22.4).
.
()
( . 22.4 ):
E=lgI/I, (1)
I ,
I . ,
:
E=lgIo/I= e× C ×d,
(2)
d , e (,
). ,
.
.
;
.
158 / (15,8 /) 140 / (14
/) . ,
.
(. 22.5).
. 200 /,
(. 22.5). 115 /,
, .
, , .
,
.
. ,
, 130 / 120
/ .
.
, :
1) O2 (1
1,36 O2);
2) (
0,34%);
3) (
);
4) ().
,

. 22.5.
(♂), (♀) .
,
; μ (),
(, ;
,
)
, .
.
.
,
, .
.
, (K3[Fe(CN)6]),
(KCN) (N3).
, HbCN (
), .
546
. e d,
, [ (2)],
. , ,
.
[32].
.
,
, . ()
( mean corpuscular hemoglobin,
MCH). ,
.
.
. 1
158 b 5,1 106
(1 = 106 ). :
= 158
/5 ,1·1012=
31 1012 = 31
:
= 140
/4,6·1012=
31 1012 = 31
( ;
= 29 ( ).
(2636 ) . ,
, .
. ,
,
,
. (, )
,
.
.
( ),
( ).
.
,
,
(), (/)
(). , (), ()
( mean corpuscular hemoglobin concentration, MCHC) ().
.
:
, = 5· 1061,
[] = 150 /, = 0,45, : = 30 ,
=/, =0,09106 = 90 () = 90 3
22.2.
() .
.
.
( ,
),
, .
.
, , .
( ),
1 , 1 (1 = 760 . . =
101 ).
:
[] = a/760 Pr (3)
760,
, r
.
, . . 22.1
. [ (3)],
,
. , ( O2 = 95 . . CO2 = 40 . .)
O2 0,003 O2 1 , O20,026 O2, 1
. O2 , O2,
O2, 9 . ,
O2 20 , O2.
22.1.
a ( ·
1· 1)
O2, O2 N2
a2 | aCO2 | a N2 | |
, 20 | 0,031 | 0,88 | 0,016 |
, 37 | 0,024 | 0,57 | 0,012 |
, 37 | 0,024 | 0,49 | 0,012 |
O2 O2
,
.
,
. , O2 O2
.
.
. , O2
, ,
(. 22.3). ,
:
+4O2
↔(O2)4. (4)
, 1 4
O2. 1
22,4 , 64 500 4 22,4 O2,
1 1,39 O2.
(1,341,36 O2
1 ). ,
[25]. , , invivo 1 Hb 1,34 2 (
).
. 1 Hb (=
16 100 Hb) 1 O2 (= 22,4 O2).
, .
, ,
, : [O2]max =
(1,34 O2 1 )·(150 Hb 1 ) =
0,2 O2 1 .
,
, (PO2 > 300 . .);
(4) .
O2,
.
.
(4) . ,
O2 ;
, , O2.
(SO2 ) :
SO2=[O2]/
[Hb] + [O2]·
100% (5)
, SO2 =0%;
, SO2 = 100%. O2.
. . 22.6, S .
(.
). , ,
2, ..
O2,
50%. ( 7,4 t=37C) 50
26 . . (3,46 ) [9, 29].
.
S
.
O2,

. 22.6. (Hb)
(Mb) 7,4 t 37
[11]. ,
,
(Mb), [1].
, 1:4.
,
O2:
Mb + O2 ↔ bO2. (6)
. 22.6. ,
S bO2
O2,
. ,
O2 ,
. ,
, .
,
,
. ,
,
S bO2 [11,14].
.
.
O2
(PO2)
. O2
95 . ,. (12,6 ). . 22.6 ,
97%. (
) O2
, ,
,
. , O2
60 . . (8,0 )
90%. ,
,
.
.
PO2 .
PO2
40 . . (5,3 ), 73% .
5 . . (0,7 ),
7%; O2
.
O2
.
(SO2 ). SO2 , ,
, O2 ( O2
1 ):
[O2]= 1,34·[Hb]·SO2·105 (7)
SO2 , a [Hb]
.
, , (SO2 = 97%)
0,20, (SO2 = 73%) 0,15.
, (O2
) 0,05 (. 22.2). ,
25% .
,
(. . 23.2), ,
. 22.2, ,
.
0,1.
,
b2
,
[2, 12, 14], ,
S . , ,
O2 ,
.
.
( )
.
, (. 22.7, ).
22.2.
O2 | SO2% | [O2], / | PCO2 | [CO2], / | |||
.. | .. | ||||||
95 | 12,6 | 97 | 0,20 | 40 | 5,3 | 0,48 | 7,40 |
40 | 5,3 | 73 | 0,15 | 46 | 6,1 | 0,52 | 7,37 |
0,05 | 0,04 | ||||||
. 22.7.
[9, 29]. . . . ( ). .
O2. . 2,3 (2,3)
. , ( )
( ),
,
.
PO2.
+ (
. 22.7, , +
). , . . ,
. . 22.7,
, +
. ,
.
(. . 22.7, ) .
O2 (O2 ): O2
, . . 22.7,
O2· ,
O2
bO2.
,
, O2
. ,
[14].
.
,
(
). , .
O2 O2,
.
. 22.7, ,
bO2.
( ; pO2 = 40 . ., CO2 = 46 . .),
, ( ;PO2 = 95 . ., CO2 = 40 . .),
. ,
,
. ,
. O2
.
O2,
.
( . 22.7, ).
,
2
. ,
.
.
. ,
(, ),
( ).
. ,
,
.
2,32,3 (. 22.7, )
[16. 22].
. :
()
, , ()
. ,
.
. ,
, .
.
, , in vivo
( , ).
.
, , [7, 21].
. 22.8

. 22.8.
[O2] (PO2)
.
O2 (
) ( ), ‘
( ), ‘ ( )
.
.
(120 180 / ),
, O2 .
() ‘ ‘ (). ,
O2 , .
, PO2= 25 . . (3,3 ) O2
0,08, 0,11.
.
O2 ,
( . 22.8 ). .
( , )
, .
:
+ ↔
b. (8)
,
.
,
b , O2 [3].
O2
30 ppm ( ),
FCO2 3·105 (0,003 .%).
,
, b 5%
. O2,
b bO2
5%, 1 : 350. ,
b 350
, O2.
. ,
.
; ,
.
, O2.
b 1 %
; 20%. ,
, ,
3·104.
.
, .
b, (
, ) [3]
.
O2 .
,
,
,
.
, O2 .
,
, .
22.3. 2
O2
(O2, )
. ,
, .
O2 .
, , O2,
.
O2 [15]. O2 ,
, 40 . . (5,3 ).
, , O2 ,
.
O2
.
, O2
(. 22.9). O2
, :
O2 + 2
↔ 23+ + H+
(9)
;
10 . .
[6, 24].
, O2,
, .

. 22.9.
, ()
()
3
,
. 3
,
. 3
, .
,
, 3 1.
(
).
O2 3«, +.
, , ,
. , ,
. ,
, ,
+.
O2
.
():
HbNH2 + O2 ↔ HbNHCOOH + +)
, O2, ( ).
. 22.9. ,
O2 .
, O2 ;
, .
O2 . ,
, ; 40 .. ,
,
46 .. 1 1,8
O2. 12%
(bO2),
11% , 27%
, 50%
3 . ;
.
O2 (
O2, .
O2
( , ),
O2 .
O2;
, (saturatio),
. . (.:
, 1988).
,
, O2 )
O2 .
O2
O2 , . O2
. CO2 O2 .
O2 ,
. . 22.11
.
,
, ,
+ . ,
,
, O2. ,
, , O2
[6, 20]. O2
.
O2
. bO2
, O2 .
O2 O2 ,
.
O2 ,
( O2/ /).
O2 (. 22.10)
.
(. 22.16).
. O2
,
O2.
O2 .
( . 22.10).
,
O2 .
, O2 .
.

.
22.10. O2
. ( O2),
( ) ( ),
, ,
, O2 .
(. 22.10). , O2 ,
O2. , ,
O2 ,
.
22.4. ,
. ,
, (
), , (
).
.
↔
H+ + .
(11)
( ) .
,
(
).
.
, .
, l, (11)
. ,
.
(. 22.11).
.
.
.
+:
p=lg[+]. (12)
, 7 ( ),
H+ [+] 107
/. .
, , .
,
, . ,
,
,
H+, . .

.
22.11. .
‘ ‘.
+
. ,
.
,
.
( ͖)
.
, +.
.
,
.
.
͖ ,
.
.
.
.
( 37 ) 7,37 7,43,
7.40. ,
( , ,
). . ,
7,27,3, . .
. , .
,
.
,
, , .
,
. (. .
) .
, .
.
,
+
.
[H+] ·[]/[HA]= K (13)
,
, , ; ‘ ,
( ‘ ,
, ). H+ ,
. ,
,
H+, .
, ,
H+.
[H+].
+ +
.
(13) :
lg[H+]= IgK‘lg[]/ []’
(14)
= ‘ + lg[]/[] (15)
,
, .
‘, ‘,,
(‘ = IgK’). (15)
:
= ‘ +
lg a/1a (16)
a = []/
[]+[]
a,
, []
([] + []). ,
. 22.11, a .
,
, ‘ + 2.
.
,
, , H+
, , .
= ‘ (. 20.11).
,
‘ .
.
.
, O2,
:
O2
+ 2 ↔ 2↔ H+ + 3 (17)
:
= ‘ +
lg [3]/[2]
(18)
[O2] O2 (PCO2)
= ‘ +
lg [3]/0,03·P2](19)
0,03 ·
1 ..1,
, [3] /, a PCO2 ..
‘ 6,1.
, ‘ (7,4)
.
,
.
, O2 (40
. .), 3
(24 /). , O2 ,
.
,
, O2 ( , )
.
.
, ,
24 ,
42. ‘
(6,8) ,
.
.
.
,
‘ .
, , .
(
, ), .
,
,
.
, ,
O2.
[3],
O2,
[
(19)]. O2;
O3- ,
,
O2 (.
22.12). ,
,
,
O2.

.
22.12. O2
. ,
. O2.
,

. 22.13.
( 2,3) ( [19] ).
Pi- ;
. HbO2 Hb .
b
bO2, 1
b
0,45 H+
. . 22.13,
( )
. ,
, .
, , +
. ,
,
+ O2.
. , O2
.
.
;
().
, ,
( buffer bases, BB) [10].
. 22.14
, ( ).
. ,
, ( ),
( 1),
, S042
( ). ,
3
, . 1/3
.
48 /. ,
O2. .
, , O2 . H+
3 . +
, .
,
(. 22.15).

.
22.14. , .
(
); , .
, , CI; Kt+

.
22.15. CO2.
( 48
/)
,
, . , CO2 40 50
.., 0,06, 0,1.
, H+ 105 /.
, . 22.15.
PCO2,
,
.
(48 /) (
baseexcess, BE).
, BE .
BE
, .
, .
.
O2 ,
. 230
O2/, 15 .
.
H+.
,
.
. ,
,
H+ (),
O2, 3 + +→ 2
→ 2 + O2, ,
. ,
; O2 H+
,
.
.
. ,
. 4060
+, .
,
H+ .
. ,
H+ ,
.
H+
,
. H+ 4 NH3,
.
3
.
.
,
( ,
) .
, ,
.
( < 7,37) , (
> 7,43) .
.
(
2 ,
).
()
.
(, ) ;
, l ( )
. .
, ,
, .
. ,
,
2(PCO2)
(BE).
PCO2
(BE = 0). ,
PCO2 ,
BE .
( ),
( );

.
22.16. O2
(BE).
()
O2 .
O2
BE =
( )
( BE).
O2 , [3].
O2
(BE) (. 22.16).
( )
O2,
. ,
O2.
. 22.17.
, .
O2. , BE CO2
. ,
, .
(
).
, , BE .
,

.
22.17.
. BE, PCO2.
;
;
( ) BE = 0 /, CO2 = 60 .., ; BE = 15
/, CO2 =40 ..,
(, ) .
.
, . .
,
( ).
:
1.
. ,
,
.
2.
, H+
3 .
. 22.17.
( 1).
, . ,
O2 .
( 1).
CO2 ,
.
, CO2 , ,
()
.
( 2)
PCO2, ( 2).
, . ( ), , ,
, O2 .
.
,
( 36). , (
4), O2,
( 4).
.
.
,
,
.
[4, 5, 8, 10].
.
1. . ,
+ ( 7,377,43)
.
,
.
2. O2. O2
(3545 ..)
.
3. (BE). BE
. ( 2,5 +2,5 /)
.
4. .
.
,
(O2 = = 40 . .)
37 . 24 /.
, .
. 22.3
,
.
.
,
O2 [10].
22.3.
. ;
(↑ ;
↓)
BE | O2 | |
↓↓ | ↓↓ | ↓ |
↑↑ | ↑↑ | ↑ |
↓↓ | ↑ | ↑↑ |
↑↑ | ↓ | ↓↓ |
,
O2. .
O2
(. 22.18). ,
( ),
.
.
22.18. O2
[10].
, ,
O2 . ,
, , .
O2.
BE
. 1
( ): O2 44 . ., 7,37, BE = 0 /;
. 2 ( ): O2= 32 . ., 7,28, BE = 11 /;
, ().
O2 .
. , . 22.18
,
(BE =11 /),
O2 (CO2= 32 ..;
).
O2
. , CO2 , BE
( ),
[28]. .
22.19 BE CO2.
. CO2 ,

.
22.19. BE
C2
. ,
.
; BE .
. ( ): C2=32
. ., 7,28; BE = 11
/. [29]
.
BE . , , .
22.19, CO2 =32 .. 7,28; BE =11
/. ,
( 2 . 22.18).
22.5.
1. Antonini
E., Brunori M. Hemoglobin and myoglobin in their reactions with ligands.
Amsterdam. North Holland, 1971.
2. Baumann
R., Barlels H., Bauer C. Blood oxygen transport. In: Fahri L. E., Tenney
S. M. (eds.). Handbook of Physiology, Sect. 3: The Respiratory System, Vol.
IV. Bethesda. Amer. Physiol. Soc., 1987.
3. Coburn
R.F., Forman H.J. Carbon monoxide toxicity. In: Fahri L. E., Tenney S.
M. (eds.). Handbook of Physiolofy, Sect. 3: The Respiratory System, Vol.
IV. Bethesda. Amer Physiol. Soc., 1987.
4. Hills
A. G. Acidbase balance: chemistry, physiology, pathophysiology. Baltimore.
Wiiliams and Wilkens, 1973.
5. Kildberg
P. Clinical acidbase physiology. Baltimore. Williams and Wilkens, 1968.
6. Klocke
R.A. Carbon dioxide transport. In: Fahri L.E., Tenney S. M. (eds.).
Handbook of Physiology, Sect. 3. The Respiratory System, Vol. IV. Bethesda.
Amer. Physiol. Soc., 1987.
7. Lungo
L. 0. Respiratory gas exchange in the placenta. In: Fahri L. E., Tenney
S. M. (eds.). Handbook of Physiology, Sect. 3. The Respiratory System, Vol.
IV. Betehesda, Amer Physiol. Soc., 1987,
8. Masoro
E. J., Siegel P. D. Acidbase regulation. Its physiology and pathophysiology.
PhiladelphiaLondonToronto. Saunders, 1971.
9. Severinghaus
J. W. Blood gas concentrations. In: Handbook of Physiology, Respiration II.
Washington, Amer. Physiol. Soc., 1965.
10. SiggaardAndersen
0. The acidbase status of the blood. Copenhagen. Munksgaard, 1974.
11. Weissbluth
M. Hemoglobin: Cooperativity and electronic properties. BerlinHeidelberg
New York. Springer, 1974.
12. Wood
S. C., Lenfant C. Phylogeny of the gasexchange system: red cell function.
In: Fahri L. E., Tenney S. M. (eds.). Handbook of Physiology, Sect. 3.
The Respiratory System, Vol. IV, Bethesda. Amer Physiol. Soc., 1987.
13. Adair
G.S. The hemoglobin system. VI. The oxygen dissociation curve of
hemoglobin. J. Biol. Chem., 63, 529 (1925).
14. Bauer
C. On the respiratory function of haemoglobin. Rev. Physiol. Biochem.
Pharmacol., 70, 1 (1974).
15. Bauer
C., Gros G., Bartels H. (eds.). Biophysics and physiology of carbon
dioxide. BerlinHeidelbergNew York. Springer, 1980.
16. Benesch
R. E., Benesch R. Yu, C.I. The oxygenation of hemoglobin in the presence of
2,3diphosphoglycerate. Effect of temperature, pH, ionic strenght and
hemoglobin concentration. Biochemistry, 8, 2567 (1969).
17. Braunilzer
G. The molecular weight of human haemoglobin. Bibl. heamat. (Basel), 18, 59
(1964).
18. Braunilzer
G., Hilse ., RudloffV., Hilschman N. The hemoglobins. Adv.
Protein. Chem., 19, 1 (1964).
19. Brodda
. Zur Theorie des SaureBasenHaushaltes von
menschlichem Blut. Akadem. Wiss. Lit. Mainz; Wesbaden. Steiner, 1975.
20. Christiansen
J., Douglas C.G., Haldane J.S. The absorption and dissociation of carbon
dioxide by human blood. J. PhysioL, XLVIII, 244 (1914).
21. Fischer
W.M., Vogel H.R., Thews G. O2 and CO2, exchange in
the human placenta. In: Lubbers D.W., LuftU.C., Thews G.. Witzler E.
Oxygen transport in blood and tissue. Stuttgart. Thieme, 1968.
22. Kilmartin
J. V., RossiBernardi L. Interactions of hemoglobin with hydrogen ions,
carbon dioxide, and organic phosphates. Physiol. Rev., 53, 836 (1973).
23. King
E. J., Gilchrist M. Determination of haemoglobin by a cyanhaematin method.
Lancet. II, 201 (1947).
24. Maren
.. Carbonic anhydrase: Chemistry, physiology, and
inhibition. Physiol. Rev., 47, 595 (1967).
25. MerletBenichou
E., Sinet M., Blayo M. C., Gaudebout C. Oxydencombining capacity in dog.
In vitro and in vivo determination. Respir. Physiol., 21, 87 (1974).
26. Perutz
M. F. The hemoglobin molecule. Proc. Roy. Soc., B, 173, 113 (1969).
27. Perutz
M.F. Stereochemistry of cooperative effects in haemoglobin. Nature, 228,
726 (1970).
28. Thews
G. Bin Nomogramm fur die O2Abhangigkeit des SaureBasenStatus
im menschlichen Blut. Pflugers Arch. ges. Physiol., 296, 212 (1967).
29. Thews
G. (ed.). Nomogramme zum SaureBasenStatus des Blutes und zum
Atemgastransport. BerlinHeidelbergNew York. Springer, 1971.
Источник