Вычислите какое количество кислорода отдает оксигенированный гемоглобин
Содержание статьи
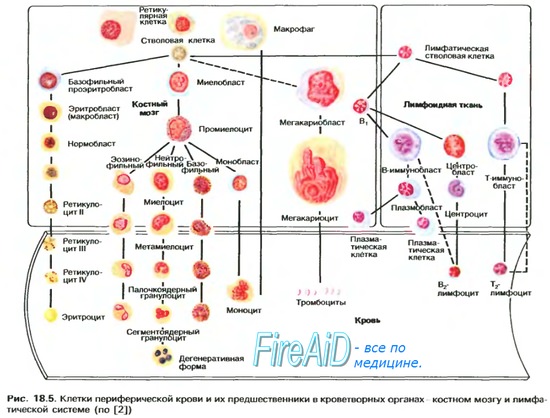
ранспорт газов кровью. Транспорт кислорода. Кислородная емкость гемоглобина.
Оглавление темы «Вентиляция легких. Перфузия легких кровью.»:
1. Вентиляция легких. Вентиляция кровью легких. Физиологическое мертвое пространство. Альвеолярная вентиляция.
2. Перфузия легких кровью. Влияние гравитации на вентиляцию легких. Влияние гравитации на перфузию легких кровью.
3. Коэффициент вентиляционно-перфузионных отношений в легких. Газообмен в легких.
4. Состав альвеолярного воздуха. Газовый состав альвеолярного воздуха.
5. Напряжение газов в крови капилляров легких. Скорость диффузии кислорода и углекислого газа в легких. Уравнение Фика.
6. Транспорт газов кровью. Транспорт кислорода. Кислородная емкость гемоглобина.
7. Сродство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.
8. Углекислый газ. Транспорт углекислого газа.
9. Роль эритроцитов в транспорте углекислого газа. Эффект Холдена..
10. Регуляция дыхания. Регуляция вентиляции легких.
Транспорт газов кровью. Транспорт кислорода. Кислородная емкость гемоглобина.
Кровообращение выполняет одну из важнейших функций переноса кислорода от легких к тканям, а углекислого газа — от тканей к легким. Потребление кислорода клетками тканей может изменяться в значительных пределах, например при переходе от состояния покоя к физической нагрузке и наоборот. В связи с этим кровь должна обладать большими резервами, необходимыми для увеличения ее способности переносить кислород от легких к тканям, а углекислый газ в обратном направлении.
Транспорт кислорода.
При 37 С растворимость 02 в жидкости составляет 0,225 мл • л-1 • кПа-1 (0,03 мл/л/мм рт. ст.). В условиях нормального парциального давления кислорода в альвеолярном воздухе, т. е. 13,3 кПа или 100 мм рт.ст., 1 л плазмы крови может переносить только 3 мл 02, что недостаточно для жизнедеятельности организма в целом. В покое в организме человека за минуту потребляется примерно 250 мл кислорода. Чтобы тканям получить такое количество кислорода в физически растворенном состоянии, сердце должно перекачивать за минуту огромное количество крови. В эволюции живых существ проблема транспорта кислорода была более эффективно решена за счет обратимой химической реакции с гемоглобином эритроцитов. Кислород переносится кровью от легких к тканям организма молекулами гемоглобина, которые содержатся в эритроцитах.
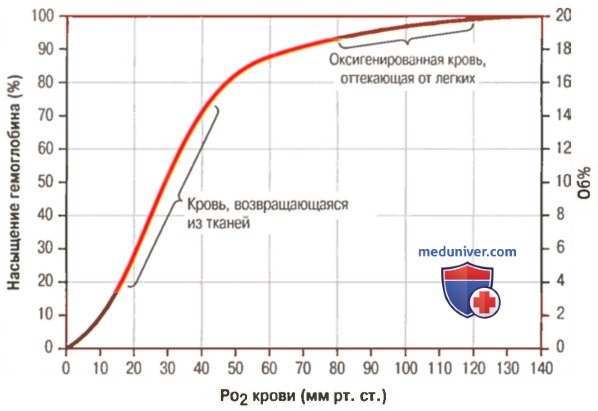
Гемоглобин способен захватывать кислород из альвеолярного воздуха (соединение называется ок-сигемоглобином) и освобождать необходимое количество кислорода в тканях. Особенностью химической реакции кислорода с гемоглобином является то, что количество связанного кислорода ограничено количеством молекул гемоглобина в эритроцитах крови. Молекула гемоглобина имеет 4 места связывания с кислородом, которые взаимодействуют таким образом, что зависимость между парциальным давлением кислорода и количеством переносимого кислорода с кровью имеет S-образную форму, которая носит название кривой насыщения или диссоциации оксигемоглобина (рис. 10.18). При парциальном давлении кислорода 10 мм рт. ст. насыщение гемоглобина кислородом составляет примерно 10 %, а при Р02 30 мм рт. ст. — 50—60 %. При дальнейшем увеличении парциального давления кислорода от 40 мм рт. ст. до 60 мм рт. ст. происходит уменьшение крутизны кривой диссоциации оксигемоглобина и процент его насыщения кислородом возрастает в диапазоне от 70—75 до 90 % соответственно. Затем кривая диссоциации оксигемоглобина начинает занимать практически горизонтальное положение, поскольку увеличение парциального давления кислорода с 60 до 80 мм рт. ст. вызывает прирост насыщения гемоглобина кислородом на 6 %. В диапазоне от 80 до 100 мм рт. ст. процент образования оксигемоглобина составляет порядка 2. В результате кривая диссоциации оксигемоглобина переходит в горизонтальную линию и процент насыщения гемоглобина кислородом достигает предела, т. е. 100. Насыщение гемоглобина кислородом под влиянием Р02 характеризует своеобразный молекулярный «аппетит» этого соединения к кислороду.
Значительная крутизна кривой насыщения гемоглобина кислородом в диапазоне парциального давления от 20 до 40 мм рт. ст. способствует тому, что в ткани организма значительное количество кислорода может диффундировать из крови в условиях фадиента его парциального давления между кровью и клетками тканей (не менее 20 мм рт. ст.). Незначительный процент насыщения гемоглобина кислородом в диапазоне его парциального давления от 80 до 100 мм рт. ст. способствует тому, что человек без риска снижения насыщения артериальной крови кислородом может перемещаться в диапазоне высот над уровнем моря до 2000 м.
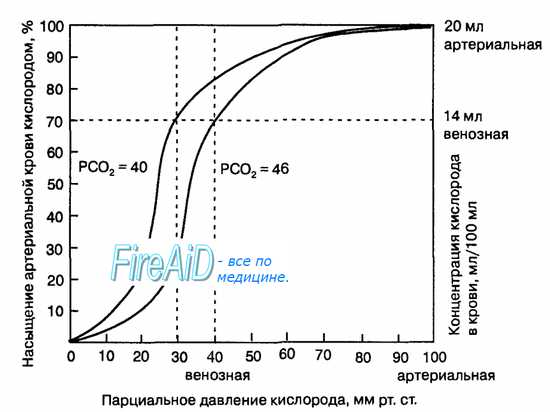
Рис. 10.18. Кривая диссоциации оксигемоглобина. Пределы колебания кривой при РС02 = 40 мм рт. ст. (артериальная кровь) и РС02 = 46 мм рт. ст. (венозная кровь) показывают изменение сродства гемоглобина к кислороду (эффект Ходена).
Общие запасы кислорода в организме обусловлены его количеством, находящимся в связанном состоянии с ионами Fe2+ в составе органических молекул гемоглобина эритроцитов и миоглобина мышечных клеток.
Один грамм гемоглобина связывает 1,34 мл 02. Поэтому в норме при концентрации гемоглобина 150 г/л каждые 100 мл крови могут переносить 20,0 мл 02.
Количество 02, которое может связаться с гемоглобином эритроцитов крови при насыщении 100 % его количества, называется кислородной емкостью гемоглобина. Другим показателем дыхательной функции крови является содержание 02 в крови (кислородная емкость крови), которое отражает его истинное количество, как связанного с гемоглобином, так и физически растворенного в плазме. Поскольку в норме артериальная кровь насыщена кислородом на 97 %, то в 100 мл артериальной крови содержится примерно 19,4 мл 02.
— Также рекомендуем «Сродство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.»
Источник
родство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.
Оглавление темы «Вентиляция легких. Перфузия легких кровью.»: Сродство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.Молекула гемоглобина может находиться в двух формах — напряженной и расслабленной. Расслабленная форма гемоглобина имеет свойство насыщаться кислородом в 70 раз быстрее, чем напряженная. Изменение фракций напряженной и расслабленной формы в общем количестве гемоглобина в крови обусловливает S-образный вид кривой диссоциации оксигемоглобина, а следовательно, так называемое сродство гемоглобина к кислороду. Если вероятность перехода от напряженной формы гемоглобина к расслабленной больше, то возрастает сродство гемоглобина к кислороду, и наоборот. Вероятность образования указанных фракций гемоглобина изменяется в большую или меньшую сторону под влиянием нескольких факторов. Основной фактор — это связывание кислорода с геминовой фуппой молекулы гемоглобина. При этом чем больше геминовых фупп гемоглобина связывают кислород в эритроцитах, тем более легким становится переход молекулы гемоглобина к расслабленной форме и тем выше их сродство к кислороду. Поэтому при низком Р02, что имеет место в метаболически активных тканях, сродство гемоглобина к кислороду ниже, а при высоком Р02 — выше. Как только гемоглобин захватывает кислород, повышается его сродство к кислороду и молекула гемоглобина становится насыщенной при связывании с четырьмя молекулами кислорода.
Когда эритроциты, содержащие гемоглобин, достигают тканей, то кислород из эритроцитов диффундирует в клетки. В мышцах он поступает в своеобразного депо кислорода — в молекулы миоглобина, из которого кислород используется в биологическом окислении мышц. Диффузия кислорода из гемоглобина эритроцитов в ткани обусловлена низким Р02 в тканях — 35 мм рт. ст. Внутри клеток тканей напряжение кислорода, необходимое для поддержания нормального метаболизма, составляет еще меньшую величину — не более 1 кПа. Поэтому кислород путем диффузии из капилляров достигает метаболически активных клеток. Некоторые ткани приспособлены к низкому содержанию Р02 в капиллярах крови, что компенсируется высокой плотностью капилляров на единицу объема тканей. Например, в скелетной и сердечной мышцах Р02 в капиллярах может снизиться чрезвычайно быстро во время сокращения. В мышечных клетках содержится белок миоглобин, который имеет более высокое сродство к кислороду, чем гемоглобин. Миоглобин интенсивно насыщается кислородом и способствует его диффузии из крови в скелетную и сердечную мышцы, где он обусловливает процессы биологического окисления. Эти ткани способны экстрагировать до 70 % кислорода из крови, проходящей через них, что обусловлено снижением сродства гемоглобина к кислороду под влиянием температуры тканей и рН. Эффект рН и температуры на сродство гемоглобина к кислороду. Молекулы гемоглобина способны реагировать с ионами водорода, в результате этой реакции происходит снижение сродства гемоглобина к кислороду. При насыщении гемоглобина менее 100 % низкое рН понижает связывание кислорода с гемоглобином — кривая диссоциации оксигемоглобина смещается вправо по оси х. Это изменение свойства гемоглобина под влиянием ионов водорода называется эффектом Бора. Метаболически активные ткани продуцируют кислоты, такую как молочная, и С02. Если рН плазмы крови снижается от 7,4 в норме до 7,2, что имеет место при сокращении мыщц, то концентрация кислорода в ней будет возрастать вследствие эффекта Бора. Например, при постоянном рН 7,4 кровь отдавала бы порядка 45 % кислорода, т. е. насыщение гемоглобина кислородом снижалось до 55 %. Однако когда рН снижается до 7,2, кривая диссоциации смещается по оси х вправо. В результате насыщение гемоглобина кислородом падает до 40 %, т. е. кровь может отдавать в тканях до 60 % кислорода, что на 1/з больше, чем при постоянном рН.
Метаболически активные ткани повышают продукцию тепла. Повышение температуры тканей при физической работе изменяет соотношение фракций гемоглобина в эритроцитах и вызывает смещение кривой диссоциации оксигемоглобина вправо вдоль оси х. В результате большее количество кислорода будет освобождаться из гемоглобина эритроцитов и поступать в ткани. Эффект 2,3-дифосфоглицерата (2,3-ДФГ) на сродство гемоглобина к кислороду. При некоторых физиологических состояниях, например при понижении Р02 в крови ниже нормы (гипоксия) в результате пребывания человека на большой высоте над уровнем моря, снабжение тканей кислородом становится недостаточным. При гипоксии может понижаться сродство гемоглобина к кислороду вследствие увеличения содержания в эритроцитах 2,3-ДФГ. В отличие от эффекта Бора, уменьшение сродства гемоглобина к кислороду под влиянием 2,3-ДФГ не является обратимым в капиллярах легких. Однако при движении крови через капилляры легких эффект 2,3-ДФГ на снижение образования оксигемоглобина в эритроцитах (плоская часть кривой диссоциации оксигемоглобина) выражен в меньшей степени, чем отдача кислорода под влиянием 2,3-ДФГ в тканях (наклонная часть кривой), что обусловливает нормальное кислородное снабжение тканей. — Также рекомендуем «Углекислый газ. Транспорт углекислого газа.» |
Источник
емоглобин. Роль гемоглобина в транспорте кислорода
Гемоглобин. Роль гемоглобина в транспорте кислородаОбычно из легких в ткани переносятся эритроцитами в химической связи с гемоглобином около 97% кислорода. Оставшиеся 3% кислорода транспортируются в физической растворенной форме плазмой крови. Таким образом, в нормальных условиях почти весь кислород переносится в ткани, будучи связанным с гемоглобином. а) Обратимая связь кислорода с гемоглобином. Химический состав гемоглобина представлен в отдельных статьях на сайте, где говорилось, что молекула кислорода легко и обратимо связывается с гемом гемоглобина. При высоком PO2, как это бывает в легочных капиллярах, кислород связывается с гемоглобином, а при низком PO2, как в капиллярах тканей, кислород освобождается от связи с гемоглобином. Такой механизм обеспечивает почти весь транспорт кислорода из легких в ткани.
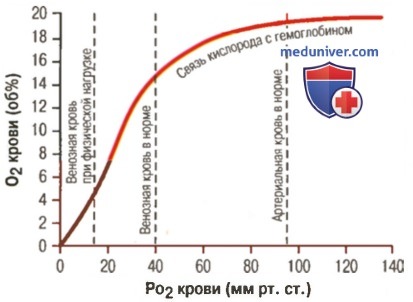
1. Кривая диссоциации оксигемоглобина. На рисунке выше приведена кривая диссоциации оксигемоглобина, демонстрирующая прогрессивный прирост процентной доли оксигемоглобина (процента насыщения гемоглобина кислородом) при увеличении PO2 в крови. В крови, покидающей легкие и входящей в системные артерии, напряжение О2 обычно составляет примерно 95 мм рт. ст., и на кривой диссоциации видно, что насыщение системной артериальной крови кислородом составляет 97%. В нормальной возвращающейся из периферических тканей венозной крови напряжение О2 составляет около 40 мм рт. ст. и 75% — насыщение гемоглобина кислородом. 2. Максимальное количество кислорода, которое может находиться в связи с гемоглобином крови. В 100 мл крови здорового человека содержится около 15 г гемоглобина, и каждый грамм гемоглобина может связать максимально 1,34 мл кислорода (химически чистый гемоглобин может связать 1,39 мл кислорода, но примеси типа метгемоглобина снижают это количество). Итак, 15×1,34 = 20,1, значит, в среднем содержащееся в 100 мл количество гемоглобина при 100% насыщении может связать около 20 мл кислорода. Обычно это обозначают как 20 об% (объемных процентов). Кривая диссоциации оксигемоглобина может строиться не от процентного насыщения гемоглобина кислородом, а от количества содержания объемных процентов кислорода. 3. Количество кислорода, высвобождаемого гемоглобином во время прохождения артериальной крови через ткани. В обычных условиях в системной артериальной крови, насыщенной кислородом на 97%, общее количество связанного с гемоглобином кислорода составляет около 19,4 мл на 100 мл крови (для облегчения понимания просим вас изучить рисунок ниже). При прохождении через капилляры ткани этот объем снижается до 14,4 мл (PO2 — 40 мм рт. ст., насыщение гемоглобина — 75%). Итак, в нормальных условиях каждые 100 мл крови доставляют от легких к тканям около 5 мл кислорода.
4. Транспорт кислорода при тяжелой физической нагрузке. При тяжелой физической работе мышечные клетки потребляют кислород с повышенной скоростью, что может привести к падению PO2 в интерстициальной жидкости мышцы от нормального уровня 40 мм рт. ст. до 15 мм рт. ст. При таком низком парциальном давлении в каждых 100 мл крови остается только 4,4 мл связанного с гемоглобином кислорода. В этом случае каждые 100 мл протекающей крови отдают тканям 19,4 — 4,4, или 15 мл кислорода, т.е. каждый объем крови отдает тканям в 3 раза больше кислорода, чем в покое. Вспомните, что у хорошо тренированных бегунов-марафонцев сердечный выброс может увеличиться в 6-7 раз, чем при покое. Если умножить это увеличение сердечного выброса (6-7 раз) на увеличение высвобождения кислорода в тканях каждым объемом крови (3 раза), получается, что к тканям было доставлено в 20 раз больше кислорода, чем в покое. Далее в этой главе Вы узнаете о существовании других факторов, улучшающих доставку кислорода в ткани во время физической нагрузки, поэтому даже при очень напряженной физической работе наблюдается только очень небольшое снижение PO2 в мышечной ткани. — Также рекомендуем «Коэффициент использования кислорода. Сохранение постоянства кислорода в тканях» Оглавление темы «Кислород и его доставка в организме»: |
Источник
Транспорт кислорода кровью. Кислородная емкость гемоглобина и кислородная емкость крови. Кривая диссоциации оксигемоглобина. Эффект Бора. — КиберПедия
Кислород переносится кровью от легких к тканям организма молекулами гемоглобина, которые содержатся в эритроцитах. Гемоглобин способен захватывать кислород из альвеолярного воздуха (оксигемоглобин) и освобождать необходимое кол-во кислорода в тканях. Кол-во связанного О2 ограничено кол-ом молекул гемоглобина в эритроцитах. Молекула гемоглобина имеет 4 места связывания с О2, которые взаимодействуют таким образом, что зависимость между парциальным давлением О2 и кол-ом переносимого О2 с кровью имеет S-образную форму, которая называется Кривая диссоциации оксигемоглобина. При парциальном давлении О2 10 мм.рт.ст. Насыщение гемоглобина О2 составляет 10%. При дальнейшем повышении 40-60 происходит уменьшение крутизны кривой диссоциации оксигемоглобина (КДО) и % его насыщения О2 возрастает 75-90% Далее КДО занимает горизонтальное положение, т. к. увеличение Парц.Р с 60 до 80 вызывает прирост насыщения гемоглобина О2 на 6%. Насыщение гемоглобином О2 под влиянием РО2 характеризует молекулярный аппетит этого соединения к О2. Крутизна кривой насыщения гемоглобина О2 в диапазоне Парц.Р 20-40 способствует тому, что в ткани организма значительное кол-во О2 может диффундировать из крови в условиях градиента его Парц.Р между кровью и клетками тканей. Незначительный % насыщения гемоглобина О2 в диапазоне его Парц.Р 80-100 мм.рт.ст. Способствует тому, что человек без риска снижения насыщения артериальной крови О2 может перемещаться в диапазоне высот над уровнем моря до 2000м. Общие запасы О2 в организме обусловлены его кол-вом, находящимся в связанном состоянии с ионами Fe2+ в составе органических молекул гемоглобина эритроцитов и миоглобинов мышечных клеток.
Кислородная емкость гемоглобина — кол-во О2, которое может связаться с гемоглобином
эритроцитов крови пр насыщении 100% его кол-ва. Еще показатель дыхательной функции крови является содержание О2 в крови — Кислородная емкость крови.Она отражает его истинное кол-во, как связанного с гемоглобином, так и физически растворенного в плазме.
Молекула гемоглобина находится в двух формах:
—Расслабленной — насыщается в 70 раз быстрее, чем Напряженная форма.
Изменение фракций этих двух форм в общем кол-ве гемоглобина в крови обуславливают S-образный вид КДО, а следовательно Сродство гемоглобина к О2.
1)Если вероятность перехода от напряженной формы гемоглобина к расслабленной больше, то возрастаетсродство гемоглобина к О2.
2)Образование указанных фракций гемоглобина изменяется в большую или меньшую сторону под влиянием связывание О2 с геминовой группой молекулы гемоглобина. При этом чем больше геминовых групп связывают О2 в эритроцитах, тем более легким становится переход молекулы гемоглобина к расслабленной форме и тем выше сродство к О2.
3)При низком РО2 сродство гемоглобина к О2 ниже и наоборот.
4)Как только гемоглобин захватывает О2, повышается сродство к О2
5)В мышечных клетках содержится белок миоглобин, имеющий высокое сродство к О2. Он интенсивно насыщается О2 и способствует его диффузии из крови в скелетную и сердечную мышцы, где он обуславливает процессы биологического окисления. Эти ткани способны эстрагировать до 70% О2 из крови, проходящей через них, что обусловлено снижениемсродства гемоглобина к О2 под влияниемтемпературы тканей и рН.
Эффект Бора —при насыщении гемоглобина менее 100% низкое рН понижает связывание О2 с гемоглобином — КДО смещаетсяВправо по оси х. Метаболически активные ткани продуцируют кислоты: молочная, СО2. Если рН плазмы крови снижается от 7,4 в норме до 7,2, что имеет место при сокращении мышц, то концентрация О2 в ней будет возрастать вследствие эффекта Бора. Метаболически активные ткани повышают продукцию тепла. Повышение температуры тканей при физической работе изменяет соотношение фракций гемоглобина в эритроцитах и вызывает смещение КДО Вправо вдоль оси х. В результате большое кол-во О2 будет освобождаться из гемоглобина эритроцитов и поступать в ткани
140.Транспорт углекислого газа . Углекислый газ является конечным продуктом клеточного метаболизма.
C02 образуется в тканях, диффундирует в кровь и переносится кровью к легким в трех формах: растворенной в плазме, в составе бикарбоната и в виде карбаминовых соединений эритроцитов.
Количество СО2, растворимого в плазме, как и для О2, определяется законом Генри, однако его растворимость в 20 раз выше, поэтому количество растворенного СО2 довольно значительно и составляет до 5—10 % от общего количества СО2 крови.
Реакция образования бикарбоната описывается следующей формулой:
СО2 + Н2О <-> Н2СО3 <->Н+ + НСО3-.
Первая реакция протекает медленно в плазме и быстро — в эритроцитах, что связано с содержанием в клетках фермента карбоангидразы. Вторая реакция- диссоциация угольной кислоты — протекает быстро, без участия ферментов. При повышении в эритроците ионов НСО3- происходит их даффузия в кровь через клеточную мембрану, в то время как для ионов Н+ мембрана эритроцита относительно непроницаема и они остаются внутри клетки. Поэтому для обеспечения электронейьральности клетки в нее из плазмы входят ионы Сl-(так называемый хлоридный сдвиг).
Высвобождающиеся ионы Н+ связываются с гемоглобином:
H+ + Нb02 <->Н+ • Hb + O2.
Восстановленный гемоглобин является более слабой кислотой, чем оксигемоглобин. Таким образом, наличие восстановленного Нb в венозной крови способствует связыванию СО2, тогда как окисление Нb в сосудах легких облегчает его высвобождение. Такое повышение сродства С02 к гемоглобину называется эффектом Холдейна. На долю бикарбоната приходится до 90 % всего СОз, транспортируемого кровью.
Карбаминовые соединения образуются в результате связывания СОз с концевыми группами аминокислот белков крови, важнейшим из которых является гемоглобин (его глобиновая часть):
Hb •NN2 + CO2 <->Hb•NH•COOH.
В ходе этой реакции образуется карбаминогемоглобин. Реакция протекает быстро и не требует участия ферментов. Как и в случае с ионами Н+, восстановленный Нb обладает большим сродством к СО2, чем оксигемоглобин.
Поэтому деоксигенированный гемоглобин облегчает связывание СО2 в тканях, а соединение НЬ с O2 способствует высвобождению СО2. В виде карбаминовых соединений содержится до 5 % общего количества СО2 крови.
Кривая диссоциации СО2 — гемоглобин значительно отличается от
кривой диссоциации оксигемоглобина — она более линейна.
Концентрация СО2 при любой величине РСО2 зависит от степени насыщения гемоглобина кислородом: чем выше насыщение, тем меньше концентрация СО2 (эффект Холдена).
Определений парциального напряжения О2 и СО2 крови проводится
при помощи автоматических газоанализаторов, использующих для каждого из измеряемых газов специальный электрод.
Источник