Выполняющий функции аналогичные гемоглобину
Содержание статьи
,
71. В крови содержится: 4.5 — 5.0*1012/л эритроцитов у мужчин и 4.0-4.5 *1013 /л эритроцитов у женщин.
72. Абсолютный эритроцитоз наблюдается у жителей высоких широт вследствие хронической гипоксии.
73. У взрослого человека содержится разновидность гемоглобина НвА.
74. В норме цветной показатель составляет 0,8-1.0.
75. Гемоглобин образуется в костном мозге.
76. Из соединений гемоглобина патологическим является карбоксигемоглобин.
77. В мышцах содержится миоглобин, выполняющий функции, аналогичные гемоглобину
78. Гемолизом называется разрушение оболочки эритроцитов, сопровождающееся выходом гемоглобина в плазму крови.
79. Осмотический гемолиз эритроцитов возникает при уменьшении осмотического давления плазмы крови.
80. Лейкопения — это снижение количества лейкоцитов.
81. В норме у человека (без учета пола содержится) 4.0 — 9.0 *109 л. лейкоцитов.
82. В красном костном мозге образуются эритроциты, лейкоциты, тромбоциты.
83. Т-лимфоциты обеспечивают клеточный иммунитет.
84. Роль B-зависимых лимфоцитов — создание гуморального иммунитета.
85. Реактивный (истинный) лейкоцитоз возникает при воспалительных процессах.
86. Иммунитет это способ защиты организма от микробов, вирусов, паразитов и генетически чуждых клеток и веществ.
87. К специфическим механизмам иммунитета относится образование антител или иммуноглобулинов.
88. К неспецифическим механизмам защиты относится фагоцитоз.
89. Для клинициста при анализе изменений крови более важно изменение взаимоотношений в лейкоцитарной формуле.
90. Выработку красных клеток крови стимулируют эритропоэтины.
91. Выработку белых клеток крови стимулируют лейкопоэтины.
92. Диаметр эритроцитов у человека — 7-8 мк.
93. Содержание моноцитов в крови здорового человека составляет 4 — 8%.
94. Основными фагоцитами крови являются нейтрофилы.
95. Антитела вырабатывают лимфоциты.
96. Функция эозинофилов заключается в детоксикации продуктов, образующихся при аллергических реакциях.
97. Продуцируют гепарин базофилы.
98. В литре крови в норме содержится 2 -3 *1011/л тромбоцитов.
99. В крови здорового мужчины количество гемоглобина составляет 130-160 г/л.
100. В крови эритроцит живет 100-120 дней.
101. Продолжительность жизни гранулоцитов в крови — 1-15 дней.
102. Продолжительность жизни тромбоцитов — до 5 дней.
103. Костному мозгу не свойственна функция разрушение эритроцитов (эритродиерез).
104. Один грамм гемоглобина связывает 1,34-1,36 мл кислорода.
105. Киллерами являются Т -лимфоциты.
106. Дифференцировку клеток костного мозга в сторону эритроцитов направляет эритропоэтин.
107. Эритропоэтин вырабатывается в юкстагломерулярном аппарате почек.
108. Внутренний фактор Кастла необходим для всасывания витамина В-12 в кишечнике.
109. Процент палочкоядерных нейтрофилов в лейкоцитарной формуле в норме составляет 3-5%.
110. Содержание лимфоцитов в крови здорового человека составляет 20-40 %.
111. Подсчет лейкоцитов после обеда покажет увеличение их числа в вашей крови.
112. Существуют суточные колебания количества клеток в крови.
113. Содержание нейтрофилов в крови здорового человека составляет 47 — 72%.
114. Содержание эозинофилов в крови здорового человека составляет 1-5%.
115. Лейкоциты осуществляют .защитные реакции.
116. Нейтрофилы участвуют в фагоцитозе и разрушении микроорганизмов.
117. Функция лимфоцитов заключается в распознавании антигенов и выработке иммуноглобулинов (антител).
118. Процентное соотношение отдельных форм лейкоцитов называется лейкоцитарной формулой.
119. Повышенное содержание лейкоцитов в периферической крови называется лейкоцитозом.
120. Лимфоциты играют важную роль в процессах иммунитета.
121. Незернистые лейкоциты, способные к амебоидному движению и фагоцитозу, называются моноцитами.
122. Зернистые лейкоциты, обладающие фагоцитарной активностью и свойством связывать токсины, называются эозинофилами.
123. Для подсчета эритроцитов в счетной камере Горяева кровь разводят 3% раствором хлористого натрия.
124. Для подсчета лейкоцитов в счетной камере Горяева кровь разводят 5% раствором уксусной кислоты с метиленовой синькой.
125. Для определения СОЭ используют 5% раствор цитрата натрия.
126. Оксигемоглобин — это соединение гемоглобина с кислородом.
127. Карбогемоглобин — это соединение гемоглобина с углекислым газом.
128. Карбоксигемоглобин — соединение гемоглобина с угарным газом.
129. Метгемоглобин — это окисленный гемоглобин, в котором железо трехвалентно.
130. Цветной показатель — это показатель степени насыщения эритроцитов гемоглобином.
131. Цветной показатель в норме равен 0,8-1,0.
132. Анемия — это пониженное содержание в крови гемоглобина и эритроцитов (и, значит, ее кислородной емкости).
133. К макрофагам относятся моноциты.
134. К микрофагам относятся нейтрофилы, эозинофилы, базофилы.
135. Продолжительность жизни нейтрофилов — от нескольких часов до нескольких суток.
136. Продолжительность жизни лимфоцитов — более 20 лет.
137. Продолжительность жизни тромбоцитов — 5-11 суток.
138. Функции лимфатических узлов — барьерная и образование В- лимфоцитов.
139. Форма эритроцита — двояковогнутый диск.
140. Нормальный по форме эритроцит называется дискоцитом.
141. Снижение среднего диаметра эритроцитов ниже 6,0 мкм называется микроцитозом.
142. Двояковогнутая форма эритроцита позволяет всем молекулам Нв быть максимально приближенными к поверхности, иметь большую площадь клетки и высокую эластичность.
143. Днем эритроцитов в крови больше, чем ночью.
144. В артериальной крови преимущественно находится оксигемоглобин.
145. Валентность железа в метгемоглобине равна 3.
146. В периферической крови в норме содержатся ретикулоциты и эритроциты.
147. Средний процент ретикулоцитов в периферической крови взрослого человека в норме — 0-1 %.
148. Преимущественный путь разрушения эритроцитов — гемолиз в клетках ретикулоэндотелиальной системы.
149. Разрушение эритроцитов идет в печени, селезенке.
150. Белковый компонент гемоглобина, появляющегося в ходе эритродиереза, в дальнейшем подвергается гидролизу до аминокислот с использованием на энергетические и пластические цели.
151. Билирубиновые конъюгаты из просвета кишечника выводятся с калом и частично всасываются.
152. Т-лимфоциты дифференцируются в тимусе.
153. В- лимфоциты дифференцируются в скоплениях лимфоидной ткани.
154. Увеличение процента молодых форм лейкоцитов называют сдвигом лейкоцитарной формулы влево.
155. За 1 секунду в организме человека разрушаются сотни тысяч эритроцитов.
156. Рецепторы функциональной системы, обеспечивающей постоянство эритроцитов крови, и воспринимающие концентрацию кислорода, расположены в дуге аорты и синокаротидной зоне.
157. Воспринимающее звено функциональной системы которая поддерживает постоянства числа эритроцитов в крови, представлено специфическими хеморецепторами.
158. Нервные центры, регулирующие процессы кроветворения, находятся в гипоталамусе.
159. Внутренний фактор Кастла вырабатывается в желудке. Он способствует всасыванию витамина В12, необходимого для нормального процесса эритропоэза.
160. При тяжелой физической работы количество лейкоцитов в периферической крови увеличивается, потому что они выходят из депо.
161. Эритропоэтины являются специфическими регуляторами эритропоэза. Они образуются в ЮГА почки.

Источник
Миоглобин скелетных мышц
Дано определение миоглобина и описаны его структура и функции. Приведены данные о концентрации миоглобина в скелетных мышцах человека и животных, а также в плазме крови человека. Приведен сравнительный анализ гемоглобина и миоглобина.
Определение
Миоглобин (Mb) — белок, который связывает кислород в скелетных мышцах и миокарде (сердечной мышце) почти всех млекопитающих, в том числе и человека. Молекулярная масса миоглобина — 17,2 кДа (1Да=1,66 10-24 г.).
Структура миоглобина
Первичная структура миоглобина представлена одной полипептидной цепью, состоящей из 146-154 аминокислотных остатков. Вторичная структура — α-спираль. Третичная структура миоглобина представлена свернутой в шар α-спиралью (глобулой) и небелковой частью — гемом (рис.1). Присутствие гема придает миоглобину красный цвет. В геме имеется железо, которое связывает кислород. В 1957 году Джон Кендрю посредством рентгеновской кристаллографии впервые определил пространственное расположение полипептидной цепи в молекуле белка миоглобина, а в 1959 году установил его детальное строение, подтвердив наличие в нём α-спиралей, которое еще в 1951 году предсказал Лайнус Полинг.
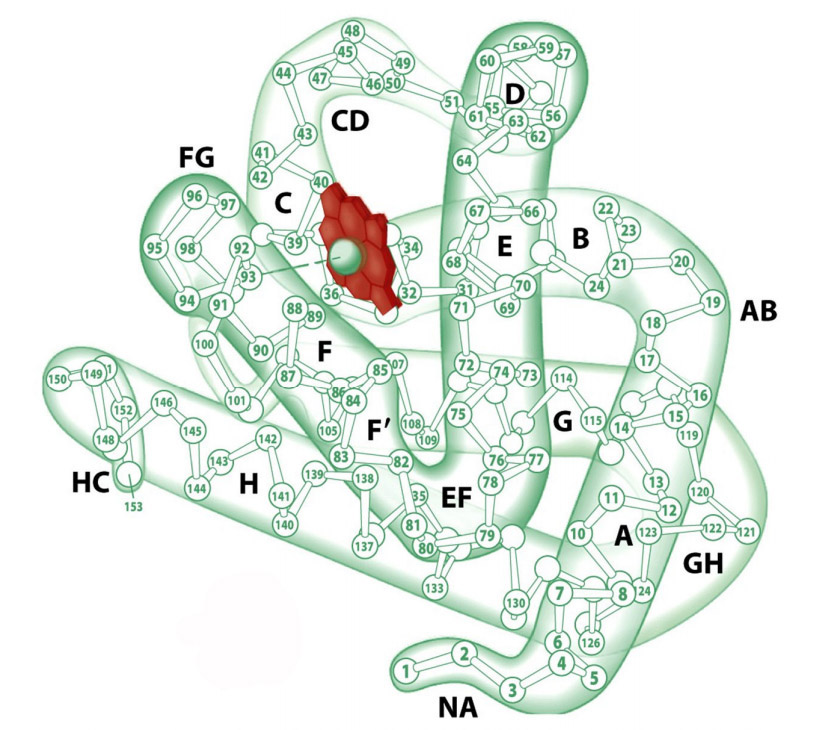
Рис.1. Структура миоглобина. Красным цветом выделен гем (illustration I. Geis)
Функции миоглобина
В мышечных волокнах миоглобин выполняет следующие функции:
- Депонирует кислород. Мышцы, поглощая кислород из крови, накапливают его в мышечных волокнах в вида оксимиоглобина. Таким образом создается резерв миоглобина, который используется для усиления окислительных процессов при тяжелой физической работе. Депонирование происходит в период покоя, расход в момент сокращения мышц. Однако емкость этого депо невелика. Оно может обеспечить снабжение кислородом скелетные мышцы в течение 8 с, а миокард в течение 15-20 с (Стародуб Р.Ф., Коробов В.Н., Назаренко В.И., 1992).
- Переносит кислород от плазматической мембраны к митохондриям. Тем самым обеспечивая функционирование тканевого дыхания.
- Связывает и освобождает оксид азота (NO) — одну из главных сигнальных молекул, играющих критическую роль в контроле поглощения кислорода, вазодилятации (расширения) сосудов и защиты мышечных волокон от активных форм кислорода (Кулева Н.В., Красовская И.Е., 2016).
Более подробно строение и функции мышц описаны в моих книгах
Концентрация миоглобина в мышечных волокнах
В мышечных волокнах скелетных мышц человека концентрация миоглобина составляет 0,4-0,5 мM (0,25 мг на 1 г ткани). Миоглобин присутствует во всех типах мышечных волокон, однако в разных концентрациях. В мышечных волокнах типа I его концентрация в 1,5 раза выше, чем в мышечных волокнах типа IIB. Именно поэтому мышечные волокна типа I имеют более красную окраску по сравнению с мышечными волокнами типа II. У морских млекопитающих концентрация миоглобина в мышечных волокнах может достигать 3,8 мM. Установлена значительная корреляция между концентрацией миоглобина в мышцах морских животных и глубиной ныряния. Установлено также, что концентрация миоглобина в мышечных волокнах коррелирует с объемной плотностью митохондрий и плотностью кровеносных капилляров.
Концентрация миоглобина в крови
В обычных условиях концентрация миоглобина в крови настолько низка (100 нг/мл), что он не определяется лабораторными методами. Однако при сильных повреждениях мышечных волокон скелетных мышц (краш-синдроме, синдроме позиционной ишемии) миоглобин может попасть в кровь. Так как молекулы миоглобина достаточно крупные, они могут закупоривать канальцы почек и приводить к их некрозу. В результате возникает острая почечная недостаточность и тканевая гипоксия. Это может привести к смерти человека.
При тяжелых силовых и аэробных тренировках (например при марафонском беге), также происходит частичное повреждение мышечных волокон скелетных мышц и миоглобин поступает в кровь.
При остром инфаркте миокарда концентрация миоглобина в крови повышается через 2-4 часа. Поэтому его относят к неспецифическим маркерам этого заболевания (Тереньев А.А., 2016).
Гемоглобин и миоглобин
Миоглобин похож на гемоглобин (Hb) — кислородсвязывающий белок в эритроцитах крови. Гемоглобин осуществляет транспорт кислорода от легких к тканям (в том числе и мышцам), а миоглобин — депонирование и транспорт кислорода внутри мышечных волокон. Структура гемоглобина более сложная, чем миоглобина. Молекула гемоглобина состоит из четырех полипептидных цепочек и гема, а молекула миоглобина — из одной полипепдиной цепочки и гема. Молекулярная масса гемоглобина человека 66,8 кДа. Миоглобин человека обладает большим сродством к кислороду, чем гемоглобин, и способен связывать до 14% от общего количества кислорода в организме.
Литература
- Кулева Н.В., Красовская И.Е. Новая роль миоглобина в функционировании сердечной и скелетной мышц // Молекулярная биофизика, 2016.- Т. 61., Вып. 5.- С. 861-864.
- Стародуб Р.Ф., Коробов В.Н., Назаренко В.И. Миоглобин: структура, свойства, синтез и биологическая роль.- Киев: Наукова думка, 1992.- 281 с.
- Терентьев А.В. Биохимия мышечной ткани: Учебное пособие.- М.: ФГБОУ ВО РНИМУ им. Н.И.Пирогова Минздрава России, 2019.- 2019 с.
С уважением, А.В. Самсонова
Источник
емоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина.
| Оглавление темы «Функции клеток крови. Эритроциты. Нейтрофилы. Базофилы.»: 1. Функции клеток крови. Функции эритроцитов. Свойства эритроцитов. Цикл Эмбдена-Мейергофа. Строение эритроцитов. 2. Гемоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина. 3. Старение эритроцитов. Разрушение эритроцитов. Длительность жизни эритроцита. Эхиноцит. Эхиноциты. 4. Железо. Железо в норме. Роль ионов железа в эритропоэзе. Трансферрин. Потребность организма в железе. Дефицит железа. ОЖСС. 5. Эритропоэз. Эритробластические островки. Анемия. Эритроцитоз. 6. Регуляция эритропоэза. Эритропоэтин. Половые гормоны и эритропоэз. 7. Лейкоциты. Лейкоцитоз. Лейкопения. Гранулоциты. Лейкоцитарная формула. 8. Функции нейтрофильных гранулоцитов ( лейкоцитов ). Дефенсины. Кателицидины. Белки острой фазы. Хемотаксические факторы. 9. Бактерицидный эффект нейтрофилов. Гранулопоэз. Нейтрофильный гранулопоэз. Гранулоцитоз. Нейтропения. 10. Функции базофилов. Функции базофильных гранулоцитов. Нормальное количество. Гистамин. Гепарин. Гемоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина.Гемоглобин — это гемопротеин, с молекулярной массой около 60 тыс., окрашивающий эритроцит в красный цвет после связывания молекулы O2 с ионом железа (Fe++). У мужчин в 1 л крови содержится 157 (140-175) г гемоглобина, у женщин — 138 (123-153) г. Молекула гемоглобина состоит из четырех субъединиц гема, связанных с белковой частью молекулы — глобином, сформированной из полипептидных цепей.
Синтез гема протекает в митохондриях эритробластов. Синтез цепей глобина осуществляется на полирибосомах и контролируется генами 11-й и 16-й хромосом. Схема синтеза гемоглобина у человека представлена на рис. 7.2. Гемоглобин, содержащий две а- и две В-цепи, называется А-тип (от adult — взрослый). 1 г гемоглобина А-типа связывает 1,34 мл O2. В первые три месяца жизни плода человека в крови содержатся эмбриональные гемоглобины типа Gower I (4 эпсилон цепи) и Gower II (2а и 25 цепи). Затем формируется гемоглобин F (от faetus — плод). Его глобин представлен двумя цепями а и двумя В. Гемоглобин F обладает на 20-30 % большим сродством к O2, чем гемоглобин А, что способствует лучшему снабжению плода кислородом. При рождении ребенка до 50-80 % гемоглобина у него представлены гемоглобином F и 15-40 % — типом А, а к 3 годам уровень гемоглобина F снижается до 2 %. Соединение гемоглобина с молекулой 02 называется оксигемоглобином. Сродство гемоглобина к кислороду и диссоциация оксигемоглобина (отсоединения молекул кислорода от оксигемоглобина) зависят от напряжения кислорода (Р02), углекислого газа (РС02) в крови, рН крови, ее температуры и концентрации 2,3-ДФГ в эритроцитах. Так, сродство повышают увеличение Р02 или снижение РС02 в крови, нарушение образования 2,3-ДФГ в эритроцитах. Напротив, повышение концентрации 2,3-ДФГ, снижение Р02 крови, сдвиг рН в кислую сторону, повышение РС02 и температуры крови — уменьшают сродство гемоглобина к кислороду, тем самым облегчая ее отдачу тканям. 2,3-ДФГ связывается с р-цепями гемоглобина, облегчая отсоединение 02 от молекулы гемоглобина. Увеличение концентрации 2,3-ДФГ наблюдается у людей, тренированных к длительной физической работе, адаптированных к длительному пребыванию в горах. Оксигемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином. В состоянии физиологического покоя у человека гемоглобин в артериальной крови на 97 % насыщен кислородом, в венозной — на 70 %. Чем выраженней потребление кислорода тканями, тем ниже насыщение венозной крови кислородом. Например, при интенсивной физической работе потребление кислорода мышечной тканью увеличивается в несколько десятков раз и насыщение кислородом оттекающей от мышц венозной крови снижается до 15 %. Содержание гемоглобина в отдельном эритроците составляет 27,5-33,2 пикограмма. Снижение этой величины свидетельствует о гипохромном (т. е. пониженном), увеличение — о гиперхромном (т. е. повышенном) содержании гемоглобина в эритроцитах. Этот показатель имеет диагностическое значение. Например, гиперхромия эритроцитов характерна для В|2-дефицитной анемии, гипохромия — для железодефицитной анемии. — Также рекомендуем «Старение эритроцитов. Разрушение эритроцитов. Длительность жизни эритроцита. Эхиноцит. Эхиноциты.» |
Источник
В чём разница?
Ключевое различие между Гемоцианином и Гемоглобином заключается в том, что Гемоцианин является медьсодержащим внеклеточным дыхательным пигментом, присутствующим в крови некоторых беспозвоночных, в то время как Гемоглобин является железосодержащим внутриклеточным дыхательным белком, присутствующим в крови позвоночных.
В аэробных организмах газообмен происходит через металлопротеины, присутствующие в крови. Таким образом, Гемоцианин и Гемоглобин — это два металлопротеина, с помощью которых происходит газообмен у членистоногих, моллюсков и животных соответственно. Гемоцианин — это медьсодержащий дыхательный пигмент, который находится во взвешенном состоянии в гемолимфе членистоногих и моллюсков. Напротив, Гемоглобин является железосодержащим дыхательным белком у животных, который связывается с эритроцитами. Оксигенированная форма гемоцианина имеет синий цвет. А оксигенированная форма гемоглобина имеет ярко-красный цвет.
 Отличие в цвете крови у различных живых существ
Отличие в цвете крови у различных живых существ
Содержание
- Обзор и основные отличия
- Что такое Гемоцианин
- Что такое Гемоглобин
- Сходство между Гемоцианином и Гемоглобином
- В чем разница между Гемоцианином и Гемоглобином
- Заключение
Что такое Гемоцианин?
Гемоцианин — это дыхательный пигмент, присутствующий у различных моллюсков, членистоногих и так же у онихофор. Это медьсодержащий металлопротеин, который проявляет сродство к кислороду. Он выполняет функцию, аналогичную гемоглобину у позвоночных. Но, в отличие от гемоглобина, гемоцианин не связан ни с одной клеткой. Вместо этого он подвешен непосредственно в гемолимфе и переносит кислород по всему организму. Поэтому Гемоцианин является свободно плавающим белком в крови. Первоначально гемоцианин бесцветен. Как только он становится связан с кислородом, цвет его меняется на синий.
Гемоцианин членистоногих и моллюсков
Структурно гемоцианин состоит из множества субъединиц, содержащих имидазольные кольца из шести остатков гистидина. Примечательно, что каждая субъединица весит около 75 килодальтон (кДа), а 1 дальтон равен 1 а.е.м.(атомная единица массы). Поскольку в гемоцианине имеется множество субъединиц, гемоцианин — это большая молекула, имеющая больший молекулярный вес по сравнению с гемоглобином.
Кроме того, согласно исследованиям, было установлено, что гемоцианин является видоспецифичным. Это означает, что членистоногие и моллюски имеют различные типы гемоцианинов.
 Гемоцианин имеется у Осьминога
Гемоцианин имеется у Осьминога
Что такое Гемоглобин?
Гемоглобин (Hgb) — это жизненно важная молекула металлопротеиназы, присутствующая в эритроцитах позвоночных, которая транспортирует кислород из легких в другие ткани организма и выводит обратно углекислый газ. Таким образом, он работает как дыхательный белок.
 Гемоглобин
Гемоглобин
Молекула гемоглобина состоит из четырех суб-белковых молекул — протомеров, в которых две цепи являются альфа-глобулиновыми цепями, а две другие — бета-глобулиновыми цепями. В каждой глобулиновой цепи есть железосодержащее порфириновое соединение, называемое гемовой группой. Внутри каждой гемовой группы есть внутри атом железа. Эти железосодержащие белки гемоглобина отвечают за красный цвет крови. Структурно гемоглобин состоит из таких элементов как: C, H, N и O.
 Химическая структура Гемоглобина
Химическая структура Гемоглобина
Гемоглобин является основной белковой молекулой, которая обеспечивает типичную форму эритроцитов, то есть круглую форму с узким центром. Атомы железа и форма красных кровяных телец имеют решающее значение для транспортировки кислорода в крови. Если форма гемоглобина разрушается, он не может транспортировать кислород. Серповидноклеточный гемоглобин (эритроцит) является одним из типов аномальной молекулы гемоглобина, которая вызывает анемию, называемую серповидноклеточной анемией.
В нормальном гемоглобине в бета-цепях 6-е положение аминокислотной цепи состоит из глутаминовой кислоты. Однако в серповидноклеточных гемоглобинах 6-е место занимает другая аминокислота, которая называется валин. Хотя это единственная разница аминокислот, именно она отвечает за это опасное для жизни состояние анемии.
Как правило, гемоглобин проявляет более высокое сродство к кислороду, поскольку внутри молекулы гемоглобина находятся четыре места, связывающих кислород. Как только молекула гемоглобина насыщается кислородом, кровь приобретает ярко-красный цвет, и это состояние известно как насыщенная кислородом кровь. Второе состояние гемоглобина известно как дезоксигемоглобин, которому не хватает кислорода. В этом состоянии кровь имеет темно-красный цвет.
Каковы сходства между Гемоцианином и Гемоглобином?
- Гемоцианин и гемоглобин являются белками.
- Оба типа молекул работают как дыхательные пигменты.
- Они несут кислород к тканям организма.
- Следовательно, они могут связываться с кислородом.
В чем разница между Гемоцианином и Гемоглобином?
Гемоцианин — это медьсодержащий пигмент, присутствующий в гемолимфе моллюсков, членистоногих и онихофор, который транспортирует кислород в организме. С другой стороны, Гемоглобин является железосодержащим белком в эритроцитах позвоночных, который переносит кислород и углекислый газ в крови. Структурно Гемоцианин состоит из множества белковых субъединиц, в то время как Гемоглобин состоит из двух альфа-цепей и двух бета-цепей.
Гемоцианин является свободно плавающим белком, в то время как Гемоглобин связан с эритроцитами. Еще одно важное различие между Гемоцианином и Гемоглобином заключается в том, что центральным Ионом Гемоцианина является медь, а центральным Ионом Гемоглобина — железо. Самое главное различие, что цвет Гемоцианина синий, а цвет Гемоглобина красный.
Заключение — Гемоцианин против Гемоглобина
Гемоцианин и Гемоглобин — два металлопротеина, которые транспортируют кислород в крови. Следовательно, они являются дыхательными пигментами, которые работают в качестве переносчиков кислорода. Ключевое различие между Гемоцианином и Гемоглобином заключается в том, что Гемоцианин является медьсодержащим внеклеточным пигментом, а Гемоглобин является железосодержащим внутриклеточным белком.
Кроме того, Гемоцианины имеются у моллюсков, членистоногих и онихофор, в то время как Гемоглобины имеются в крови у позвоночных. Кроме того, оксигенированный Гемоцианин имеет синий цвет, а оксигенированный Гемоглобин — красный.
Источник
