Жирные кислоты холестерин клетка
Содержание статьи
, . , . , . () , . , .
, , ,
, (, , D, ). , — . (, , ) , .
—
12- , . — , — . , — , , .
, , , (). a -. — , b -, :
, , — , . , , , : — — . 0,3 , . . — .
:
.
: — — . .
(-) — , . -, , , . . 50-100 . — .
, , . — . 5-7 , . , — . , , , . , :
- ,
- , ,
- .
— , . , . ( ), .
, , . , .
() . .
. , , . , . , .
:
- b —
. b — , , , .
, — . — . — . — . b — -, . b -. b — -.
b — 1 -, 12 . , 1 FADH2 1 NADH, 2 3 ( 5).
, , , (16) 7 b -, 8 -, 7 FADH2 7 NADH++. , 35 b — 96 , 131 .
()
b — , .
-, b — , , : b -.
. . 2 /. , , . , , . , , ( , , ). . , () . , , .
. 16 ().
, , .
, , . — , . : , — . , — . — — -. — , . . — — , , . , . , , — . b —, . , . — SH- . . 16 , .
(7 ): -+7-+14(NADPH++) → + 8HS-CoA+ 7CO2+14NADP++7H2O
NADPH . , , , . , . , .
, — . . , , , 20:4 (5,8,11,14), .
. — — . , . — , — , , . — — , «» b -. , — «» «» b — . — -, , . .
—. — . .
, , , , , .
. : , , D3. . :
- ( )
- ( )
.
. . «» -. b — b — , NADPH . , . 2-3 .
— . — .
, , , . — , , . : — , — , — , — . : (), ( — ).
| B-48 ,A-I, IV | |
| Pre- b | B-100, E, C-I, II, III |
| b | B-100, E |
| b | B-100 |
| a 1 | A-I, II |
— (). . , . : , , , . . -. , — , . , (-, ). , -11 -. -, . . :
| . | Apo-E | . | apo-E |
| , . | |||
| Apo-B-100, apo-E | , | , . | , |
.
— 90% , -. .
, . , , . — , . , .
— . —100, . . . , , . , , . , . . — (). b — . , . , . , , . , , . . .
. — ( ) .
( ). . . , 10 . — . . , , . , , . , .
Источник
Хороший, плохой, злой холестерин
Статья на конкурс «био/мол/текст»: Вряд ли сейчас найдется человек, который не слышал, что высокий холестерин — это плохо. Однако столь же мала вероятность встретить человека, который знает, ПОЧЕМУ высокий холестерин — это плохо. И чем определяется высокий холестерин. И что такое высокий холестерин. И что такое холестерин вообще, зачем он нужен и откуда берется.
Итак, история вопроса такова. Давным-давно, в одна тысяча девятьсот тринадцатом году, петербуржский физиолог Аничков Николай Александрович показал: не что иное, как холестерин, вызывает атеросклероз у экспериментальных кроликов, содержащихся на пище животного происхождения [1]. Вообще же, холестерин необходим для нормального функционирования животных клеток и является основной составляющей клеточных мембран , а также служит субстратом для синтеза стероидных гормонов и желчных кислот.
Главный липидный компонент пищевого жира и жировых отложений — это триглицериды, которые представляют собой эфиры глицерина и жирных кислот. Холестерин и триглицериды, будучи неполярными липидными веществами, транспортируются в плазме крови в составе липопротеиновых частиц. Частицы эти подразделяют по размеру, плотности, относительному содержанию холестерина, триглицеридов и белков на пять больших классов: хиломикроны, липопротеины очень низкой плотности (ЛПОНП), липопротеины промежуточной плотности (ЛППП), липопротеины низкой плотности (ЛПНП) и липопротеины высокой плотности (ЛПВП) [2]. Традиционно ЛПНП считается «плохим» холестерином, а ЛПВП — «хорошим» (рис. 1).
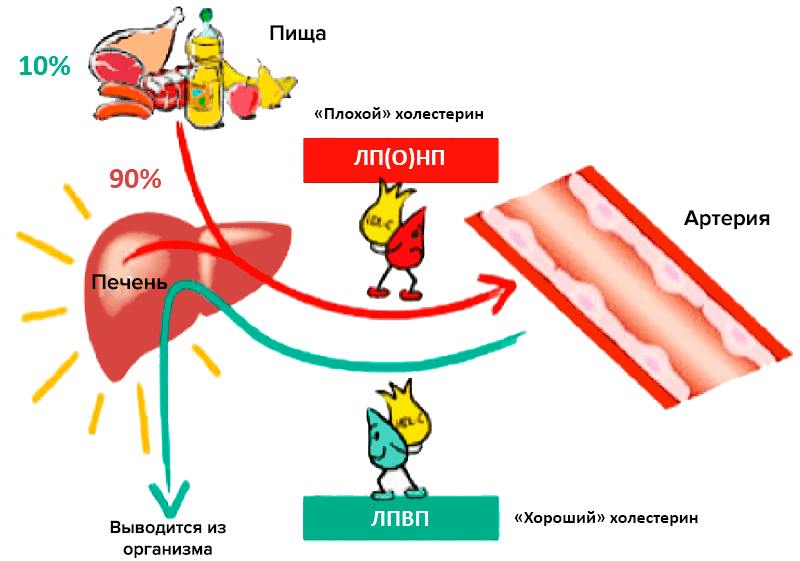
Рисунок 1. «Плохой» и «хороший» холестерины. Участие различных липопротеиновых частиц в транспорте липидов и холестерина.
Схематично структура липопротеина включает неполярное ядро, состоящее по большей части из холестерина и триглицеридов, и оболочку из фосфолипидов и апопротеинов (рис. 2). Ядро — функциональный груз, который доставляется до места назначения. Оболочка же участвует в распознавании клеточными рецепторами липопротеиновых частиц, а также в обмене липидными частями между различными липопротеинами [3].
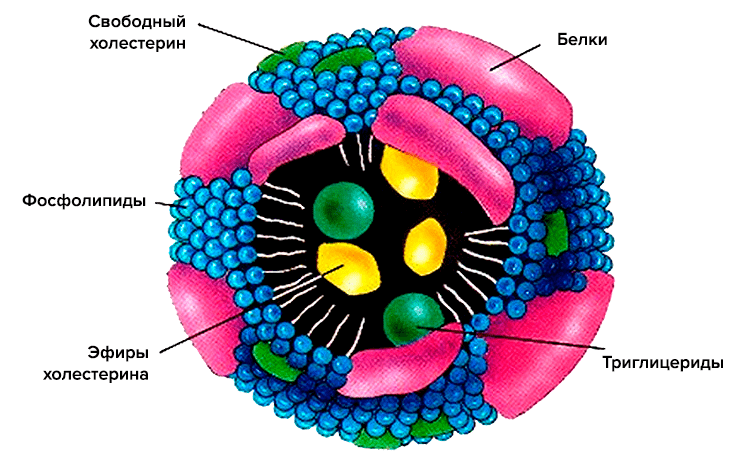
Рисунок 2. Схематическое строение липопротеиновой частицы
Баланс уровня холестерина в организме достигается следующими процессами: внутриклеточный синтез, захват из плазмы (главным образом из ЛПНП), выход из клетки в плазму (главным образом в составе ЛПВП). Предшественник синтеза стероидов — ацетил коэнзим А (CoA). Процесс синтеза включает, по крайней мере, 21 шаг, начиная с последовательного преобразования ацетоацетил CoA. Лимитирующая стадия синтеза холестерина в большой степени определяется количеством холестерина, абсорбируемого в кишечнике и транспортируемого в печень [4]. При недостатке холестерина происходит компенсаторное усиление его захвата и синтеза.
Транспорт холестерина
Систему транспорта липидов можно разделить на две большие части: внешнюю и внутреннюю.
Внешний путь начинается с всасывания в кишечнике холестерина и триглицеридов. Его конечный результат — доставка триглицеридов в жировую ткань и мышцы, а холестерина — в печень. В кишечнике пищевой холестерин и триглицериды связываются с апопротеинами и фосфолипидами, формируя хиломикроны, которые через лимфоток попадают в плазму, мышечную и жировую ткани. Здесь хиломикроны взаимодействуют с липопротеинлипазой — ферментом, который освобождает жирные кислоты. Эти жирные кислоты поступают в жировую и мышечную ткани для накопления и окисления соответственно. После изъятия триглицеридного ядра остаточные хиломикроны содержат большое количество холестерина и апопротеина Е. Апопротеин Е специфически связывается со своим рецептором в клетках печени, после чего остаточный хиломикрон захватывается и катаболизируется в лизосомах. В результате этого процесса освобождается холестерин, который затем преобразуется в желчные кислоты и выводится или участвует в формировании новых липопротеинов, образующихся в печени (ЛПОНП). При нормальных условиях хиломикроны находятся в плазме в течение 1-5 ч. после приема пищи [2], [3].
Внутренний путь. Печень постоянно синтезирует триглицериды, утилизируя свободные жирные кислоты и углеводы. В составе липидного ядра ЛПОНП они выходят в кровь. Внутриклеточный процесс формирования этих частиц схож с таковым для хиломикронов, за исключением различия в апопротеинах. Последующее взаимодействие ЛПОНП с липопротеинлипазой в тканевых капиллярах приводит к формированию остаточных ЛПОНП, богатых холестерином (ЛППП). Примерно половина этих частиц выводится из кровотока клетками печени в течение 2-6 ч. Остальные претерпевают модификацию с замещением оставшихся триглицеридов эфирами холестерина и освобождением от всех апопротеинов, за исключением апопротеина В. В результате формируются ЛПНП, которые содержат ¾ всего плазменного холестерина. Их главная функция — доставка холестерина в клетки надпочечников, скелетных мышц, лимфоцитов, гонад и почек [3]. Модифицированные ЛПНП (окисленные продукты, количество которых возрастает при повышенном содержании в организме активных форм кислорода, так называемом окислительном стрессе) могут распознаваться иммунной системой как нежелательные элементы. Тогда макрофаги их захватывают и выводят из организма в виде ЛПВП. При чрезмерно высоком уровне ЛПНП макрофаги становятся перегруженными липидными частицами и оседают в стенках артерий, образуя атеросклеротические бляшки.
Основные транспортные функции липопротеинов приведены в таблице.
Таблица. Функции липопротеинов [5].
| Класс | Размеры | Функция |
|---|---|---|
| ЛПВП | 4-14 нм | Транспорт холестерина от периферийных тканей к печени |
| ЛПНП | 20-22,5 нм | Транспорт холестерина, триглицеридов и фосфолипидов от печени к периферийным тканям |
| ЛППП | 25-35 нм | Транспорт холестерина, триглицеридов и фосфолипидов от печени к периферийным тканям |
| ЛПОНП | 30-80 нм | Транспорт холестерина, триглицеридов и фосфолипидов от печени к периферийным тканям |
| Хиломикроны | 75-1200 нм | Транспорт холестерина и жирных кислот, поступающих с пищей, из кишечника в периферические ткани и печень |
Регуляция уровня холестерина
Уровень холестерина в крови в большой степени определяется диетой. Пищевые волокна снижают уровень холестерина, а пища животного происхождения повышает его содержание в крови.
Один из основных регуляторов метаболизма холестерина — рецептор LXR (рис. 3). LXR α и β принадлежат к семейству ядерных рецепторов, которые образуют гетеродимеры с ретиноидным Х рецептором и активируют гены-мишени. Их естественные лиганды — оксистерины (окисленные производные холестерина). Обе изоформы идентичны на 80% по аминокислотной последовательности. LXR-α обнаружен в печени, кишечнике, почках, селезенке, жировой ткани; LXR-β в небольшом количестве обнаруживается повсеместно [6]. Метаболический путь оксистеринов быстрее, чем у холестерина, и поэтому их концентрация лучше отражает краткосрочный баланс холестерина в организме. Существует всего три источника оксистеринов: ферментативные реакции, неферментативное окисление холестерина и поступление с пищей. Неферментативные источники оксистеринов как правило минорные, но в патологических состояниях их вклад возрастает (окислительный стресс, атеросклероз), и оксистерины могут действовать наряду с другими продуктами перекисного окисления липидов [6]. Основное влияние LXR на метаболизм холестерина: обратный захват и транспорт в печень, вывод с желчью, снижение кишечного всасывания. Уровень продукции LXR различается на протяжении аорты; в дуге, зоне турбулентности, LXR в 5 раз меньше, чем в участках со стабильным течением. В здоровых артериях повышение экспрессии LXR в зоне сильного потока оказывает антиатерогенное действие [7].
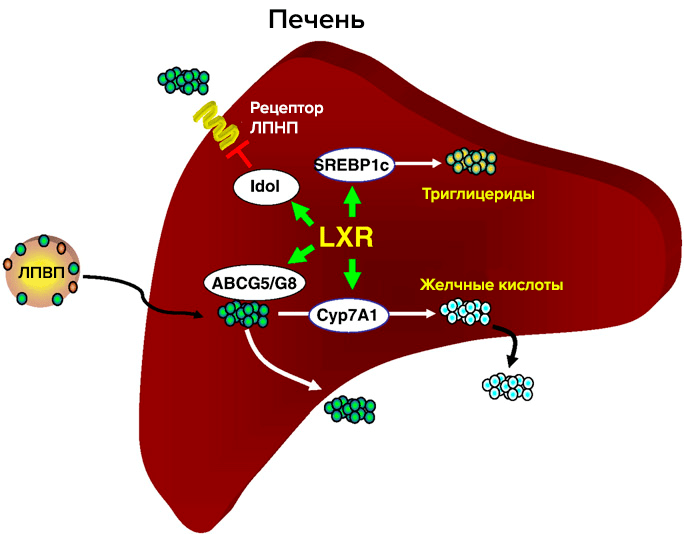
Рисунок 3. Участие рецептора LXR в метаболизме холестерина в печени
Важную роль в метаболизме холестерина и стероидов играет рецептор-«мусорщик» SR-BI (рис. 4). Он был обнаружен в 1996 году как рецептор для ЛПВП [8]. В печени SR-BI отвечает за избирательный захват холестерина из ЛПВП. В надпочечниках SR-BI опосредует избирательный захват этерифицированного холестерина из ЛПВП, который необходим для синтеза глюкокортикоидов. В макрофагах SR-BI связывает холестерин, что является первым этапом в обратном транспорте холестерина. SR-BI также захватывает холестерин из плазмы и опосредует его прямой выход в кишечник [9].
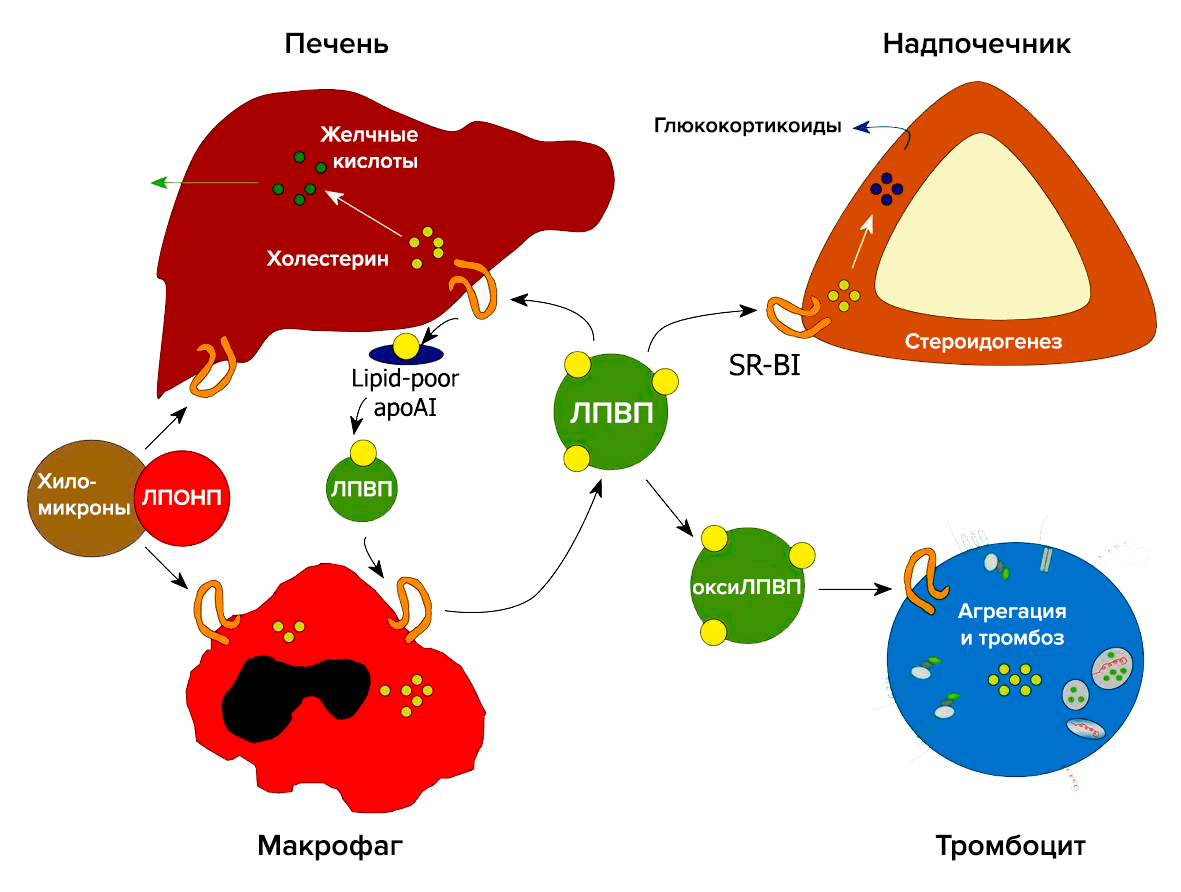
Рисунок 4. Участие рецептора SR-BI в метаболизме холестерина
Выведение холестерина из организма
Классический путь выведения холестерина: транспорт холестерина с периферии в печень (ЛПВП), захват клетками печени (SR-BI), экскреция в желчь и выведение через кишечник, где большая часть холестерина возвращается в кровь [10].
Основная функция ЛПВП — обратный транспорт холестерина в печень. Плазменные ЛПВП являются результатом комплекса различных метаболических событий. Состав ЛПВП очень различается по плотности, физико-химическим свойствам и биологической активности. Это сферические или дисковидные образования. Дисковидные ЛПВП в основном состоят из апопротеина A-I с вложенным слоем фосфолипидов и свободного холестерина. Сферические ЛПВП больше и дополнительно содержат гидрофобное ядро из эфиров холестерина и небольшого количества триглицеридов.
При метаболическом синдроме активируется обмен триглицеридов и эфиров холестерина между ЛПВП и триглицерид-богатыми липопротеинами. В результате содержание триглицеридов в ЛПВП повышается, а холестерина снижается (т.е. холестерин не выводится из организма) [11]. Отсутствие ЛПВП у людей встречается при болезни Tangier, главные клинические проявления которой — увеличенные оранжевые миндалины, роговичная дуга, инфильтрация костного мозга и мукозного слоя кишечника [3].
Если коротко обобщить, то страшен не сам холестерин, который является необходимым компонентом, обеспечивающим нормальную структуру клеточных мембран и транспорт липидов в крови, а кроме того он является сырьем для производства стероидных гормонов. Метаболические расстройства же проявляются при нарушении баланса ЛПНП и ЛПВП , что отражает нарушение системы транспорта липопротеинов, включающей работу печени, образование желчи и участие макрофагов. Поэтому любые заболевания печени, а также аутоиммунные процессы могут вызвать развитие атеросклероза даже при вегетарианской диете. Если мы вернемся к изначальным опытам Н.А. Аничкова по кормлению кроликов пищей, богатой холестерином, то увидим, что холестерин не встречается в естественном рационе кроликов и поэтому, как яд, нарушает работу печени, вызывает сильное воспаление сосудов и, как следствие, образование бляшек.
- Anitschkow N. and Chalatow S. (1983). Classics in arteriosclerosis re: On experimental cholesterin steatosis and its ificance in the origin of some pathological processes by N. Anitschkow and S. Chalatow, translated by Mary Z. Pelias, 1913. Arteriosclerosis, Thrombosis, and Vascular Biology. 3, 178-182;
- Климов А.Н. Причины и условия развития атеросклероза. Превентивная кардиология. М.: «Медицина», 1977. — 260-321 с.;
- Cox R.A. and Garcia-Palmieri M.R. Cholesterol, triglycerides, and associated lipoproteins. Clinical methods: the history, physical, and laboratory examinations (3rd Edition). Boston: Butter-worths, 1990. — 153-160 p.;
- Grundy S.M. (1978). Cholesterol bolism in man. West. J. Med. 128, 13-25;
- Википедия: «Липопротеины»;
- Wójcicka G., Jamroz-Wisniewska A., Horoszewicz K., Beltowski J. (2007). Liver X receptors (LXRs). Part I: Structure, , regulation of activity, and role in lipid bolism. Postepy Hig. Med. Dosw. 61, 736-759;
- Calkin A. and Tontonoz P. (2010). Liver X Receptor aling pathways and atherosclerosis. Arterioscler. Thromb. Vasc. Biol. 30, 1513-1518;
- S. Acton, A. Rigotti, K. T. Landschulz, S. Xu, H. H. Hobbs, M. Krieger. (1996). Identification of Scavenger Receptor SR-BI as a High Density Lipoprotein Receptor. Science. 271, 518-520;
- Vrins C.L.J. (2010). From blood to gut: Direct secretion of cholesterol via transintestinal cholesterol efflux. World J. Gastroenterol. 16, 5953-5957;
- Van der Velde A.E. (2010). Reverse cholesterol transport: From classical view to new insights. World J. Gastroenterol. 16, 5908-5915;
- Wilfried Le Goff, Maryse Guerin, M.John Chapman. (2004). Pharmacological modulation of cholesteryl ester transfer protein, a new therapeutic target in atherogenic dyslipidemia. Pharmacology & Therapeutics. 101, 17-38;
- Липидный фундамент жизни;
- Наночастицами — по «плохому» холестерину!.
Источник
Холестерин и его функции в организме
Холестери́н (др.-греч. χολή — жёлчь и στερεός — твёрдый) — органическое соединение, природный полициклический липофильный спирт, содержащийся в клеточных мембранах всех животных и человека. Холестерин в составе клеточной плазматической мембраны придает ей определённую жёсткость за счёт увеличения плотности «упаковки» молекул фосфолипидов. Таким образом, холестерин — стабилизатор текучести плазматической мембраны. Холестерин открывает цепь биосинтеза стероидных половых гормонов (эстрогены, прогестерон, тестостерон) и кортикостероидов (кортизол, альдостерон), служит основой для образования желчных кислот и витаминов группы D, участвует в регулировании проницаемости клеток и предохраняет эритроциты крови от действия гемолитических ядов.
Холестерин бывает двух видов: низкой плотности (ЛПНП) и высокой плотности (ЛПВП). Большое содержание ЛПВП в крови характерно для здорового организма, поэтому часто эти липопротеиды называют «хорошими». Высокомолекулярные липопротеиды хорошо растворимы и не склонны к выделению холестерина в осадок, и тем самым защищают сосуды от атеросклеротических изменений (то есть не являются атерогенными).
Уровень холестерина в крови измеряется либо в ммоль/л (миллимоль на литр — единица, действующая в РФ) либо в мг/дл (миллиграмм на децилитр, 1 ммоль/л равен 38,665 мг/дл). Идеально, когда уровень «плохих» низкомолекулярных липопротеидов ниже 2,586 ммоль/л (для лиц с высоким риском сердечно-сосудистых заболеваний — ниже 1,81 ммоль/л). Такой уровень, однако, у взрослых достигается редко. Если уровень низкомолекулярных липопротеидов выше 4,138 ммоль/л, рекомендуется использовать диету для снижения его ниже 3,362 ммоль/л (что может привести к депрессивным расстройствам, повышенному риску инфекционных и онкологических заболеваний. Если этот уровень выше 4,914 ммоль/л или упорно держится выше 4,138 мг/дл, рекомендуется рассмотреть возможность лекарственной терапии. Для лиц с высоким риском сердечно-сосудистых заболеваний эти цифры могут снижаться. Доля «хороших» высокомолекулярных липопротеидов в общем уровне холестерин-связывающих липопротеидов чем выше, тем лучше. Хорошим показателем считается, если он гораздо выше 1/5 от общего уровня холестерин-связывающих липопротеидов.
К факторам, повышающим уровень «плохого» холестерина, относятся:
- курение;
- избыточный вес или ожирение, переедание;
- гиподинамия или недостаточная физическая активность;
- неправильное питание с высоким содержанием трансжиров (содержащихся в частично гидрогенизированных жирах), высоким содержанием в пище углеводов (особенно легкоусваиваемых, вроде сладостей и кондитерских изделий), недостаточным содержанием клетчатки и пектинов, липотропных факторов, полиненасыщенных жирных кислот, микроэлементов и витаминов;
- застой жёлчи в печени при различных нарушениях работы этого органа;
- также некоторые эндокринные нарушения — сахарный диабет, гиперсекреция инсулина, гиперсекреция гормонов коры надпочечников, недостаточность гормонов щитовидной железы, половых гормонов.
В организме здорового человека в результате обменных процессов количество холестерина поддерживается на постоянном уровне. При этом некоторое его количество поступает в организм с продуктами питания, так называемый пищевой холестерин, а большая часть синтезируется в организме из жиров и углеводов. Прием холестерина в пределах суточной нормы (0,6 г) существенно не влияет на его уровень в крови. Холестерин преимущественно продуцируется в печени, причем его синтез находится в обратной зависимости от количества холестерина, поступающего с пищей. Повышенное потребление продуктов с высоким содержанием холестерина при нормальном липидном обмене снижает его выработку в организме. Однако, при длительном потреблении пищевого холестерина сверх дневной нормы его уровень в крови повышается. При нарушенном липидном обмене даже незначительное увеличение потребляемого с пищей холестерина приводит к повышению его уровня в крови. Нарушение липидного обмена может произойти при длительном несоблюдении правильного режима питания, при некоторых хронических заболеваниях, в результате изменения гормонального фона организма, от генетической предрасположенности и т.д. Наряду с тем, что холестерин относится к физиологически необходимым веществам, выполняющим жизненно важные функции в организме, он также является основным фактором развития атеросклероза.
К продуктам с высоким содержанием холестерина относятся яичный желток, говяжий жир, мозги животных, печень, почки, икра, масло, сметана и другие жирные молочные продукты. При нарушении липидного обмена следует сократить потребление продуктов с высоким содержанием холестерина, особенно больным атеросклерозом и ишемической болезнью сердца, а также людям пожилого возраста. Исключение составляют яйца и молочные жиры, содержащие лицетин. Благодаря содержанию в нем фосфора и холина, лецитин является биологическим антагонистом холестерина, он способствует улучшению процессов обмена холестерина в организме и препятствует возникновению атеросклероза. Здоровым людям не следует строго соблюдать бесхолестериновые диеты. Пища, даже с высоким содержанием холестерина, потребляемая в умеренных количествах, не может вызвать серьезных отрицательных последствий. Но и перегружать организм избыточным потреблением продуктов с высоким содержанием холестерина тоже нельзя.
Подводя итоги можно сделать вывод, что холестерин — это сложное и важное вещество, ответственное за выполнение широкого спектра функций в организме. Поэтому, здоровый образ жизни, правильное питание, отказ от табакокурения и чрезмерного употребления алкоголя, борьба со стрессом и позитивный настрой помогут контролировать соотношение липопртеинов в организме, укрепляя естественным образом наше здоровье и долголетие.
Информация подготовлена врачом по гигиеническому воспитанию ФБУЗ «Центр гигиены и эпидемиологии в Калининградской области» Деревягиной В.А.
Источник